Sobresaturación
El estado de sobresaturación ocurre en una solución química cuando la concentración de un soluto excede el valor máximo de solubilidad en equilibrio que tiene el solvente. Esto ocaciona que una parte de la solución no reaccione.
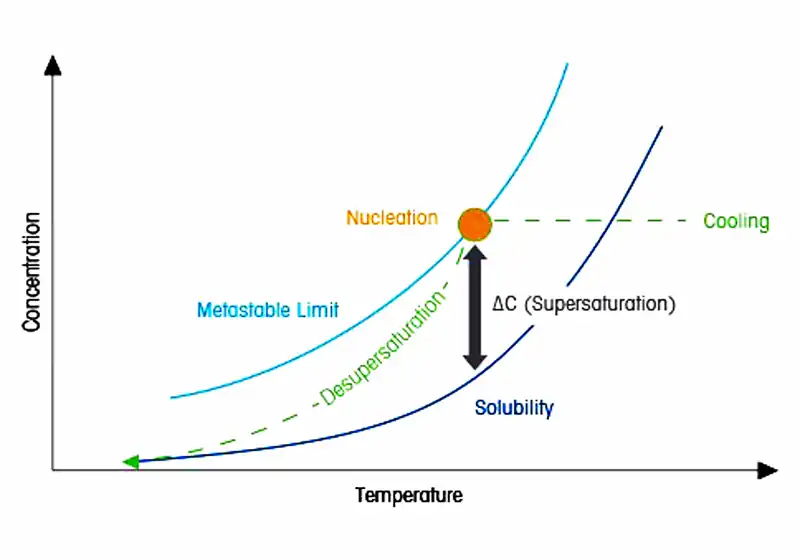
Las soluciones sobresaturadas están en un estado metaestable, es decir, pueden ser forzadas a volver de nuevo al equilibrio separando el exceso de soluto del resto de la solución, por ejemplo mediante filtración. Comúnmente, el término se aplica a una solución de un sólido en un líquido. El término también se puede aplicar a una mezcla de gases.
Historia
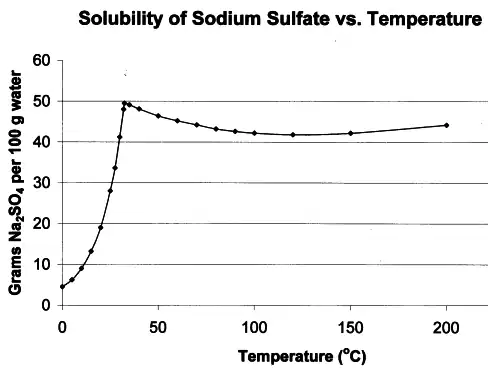
Los primeros estudios del fenómeno se realizaron con sulfato de sodio, también conocido como sal de Glauber porque, inusualmente, la solubilidad de esta sal en agua puede disminuir con el aumento de la temperatura. Los primeros estudios han sido resumidos por Tomlinson.Se demostró que la cristalización de una solución sobresaturada no proviene simplemente de su agitación (la creencia anterior) sino de la entrada de materia sólida y que actúa como un sitio de "inicio" para la formación de cristales, ahora llamados "semillas". Ampliando esto, Gay-Lussac llamó la atención sobre la cinemática de los iones de sal y las características del recipiente que tienen un impacto en el estado de sobresaturación. También pudo ampliar el número de sales con las que se puede obtener una solución sobresaturada. Posteriormente Henri Löwel llegó a la conclusión de que tanto los núcleos de la solución como las paredes del recipiente tienen un efecto catalizador sobre la solución que provoca la cristalización. Explicar y modelar este fenómeno ha sido una tarea asumida por investigaciones más recientes.
Ocurrencia y ejemplos
Precipitado sólido, disolvente líquido
Una solución de un compuesto químico en un líquido se sobresaturará cuando cambie la temperatura de la solución saturada. En la mayoría de los casos, la solubilidad disminuye al disminuir la temperatura; en tales casos, el exceso de soluto se separará rápidamente de la solución en forma de cristales o de un polvo amorfo. En unos pocos casos se produce el efecto contrario. El ejemplo del sulfato de sodio en agua es bien conocido y por eso se utilizó en los primeros estudios de solubilidad.
La recristalización es un proceso utilizado para purificar compuestos químicos. Se calienta una mezcla del compuesto impuro y el disolvente hasta que se disuelve el compuesto. Si queda alguna impureza sólida, se elimina por filtración. Cuando la temperatura de la solución se reduce posteriormente, se sobresatura brevemente y luego el compuesto cristaliza hasta que se alcanza el equilibrio químico a la temperatura más baja. Las impurezas permanecen en el líquido sobrenadante. En algunos casos, los cristales no se forman rápidamente y la solución permanece sobresaturada después del enfriamiento. Esto se debe a que existe una barrera termodinámica para la formación de un cristal en un medio líquido. Comúnmente, esto se supera agregando un pequeño cristal del compuesto soluto a la solución sobresaturada, un proceso conocido como "siembra". Otro proceso de uso común es frotar una varilla en el costado de un recipiente de vidrio que contiene la solución para liberar partículas de vidrio microscópicas que pueden actuar como centros de nucleación. En la industria, se utiliza la centrifugación para separar los cristales del líquido sobrenadante.
Algunos compuestos y mezclas de compuestos pueden formar soluciones sobresaturadas de larga duración. Los carbohidratos son una clase de tales compuestos; La barrera termodinámica para la formación de cristales es bastante alta debido a los extensos e irregulares enlaces de hidrógeno con el disolvente, el agua. Por ejemplo, aunque la sacarosa se puede recristalizar fácilmente, su producto de hidrólisis, conocido como "azúcar invertido" o "jarabe de oro", es una mezcla de glucosa y fructosa que existe como un líquido viscoso y sobresaturado. La miel clara contiene carbohidratos que pueden cristalizarse en un período de semanas.
Se puede encontrar sobresaturación cuando se intenta cristalizar una proteína.
Soluto gaseoso, solvente líquido
La solubilidad de un gas en un líquido aumenta al aumentar la presión del gas. Cuando se reduce la presión externa, el exceso de gas sale de la solución.
Las bebidas gaseosas se elaboran sometiendo el líquido a dióxido de carbono, bajo presión. En el champagne el CO 2 se produce de forma natural en la etapa final de la fermentación. Cuando se abre la botella o lata, se libera algo de gas en forma de burbujas.
La liberación de gas del torrente sanguíneo puede causar que un buceador de aguas profundas sufra de enfermedad por descompresión (también conocida como curvas) cuando regresa a la superficie. Esto puede ser fatal si el gas liberado ingresa al corazón.
Los gases disueltos pueden liberarse durante la exploración de petróleo cuando se realiza una huelga. Esto ocurre porque el petróleo en la roca que contiene petróleo está bajo una presión considerable de la roca suprayacente, lo que permite que el petróleo esté sobresaturado con respecto a los gases disueltos.
Formación de líquido a partir de una mezcla de gases.
Un chaparrón es una forma extrema de producción de agua líquida a partir de una mezcla sobresaturada de aire y vapor de agua en la atmósfera. La sobresaturación en fase vapor está relacionada con la tensión superficial de los líquidos a través de la ecuación de Kelvin, el efecto Gibbs-Thomson y el efecto Poynting.
La Asociación Internacional para las Propiedades del Agua y el Vapor (IAPWS) proporciona una ecuación especial para la energía libre de Gibbs en la región de vapor metaestable del agua en su Publicación revisada sobre la Formulación industrial de IAPWS de 1997 para las propiedades termodinámicas del agua y el vapor. Todas las propiedades termodinámicas para la región de vapor metaestable del agua se pueden derivar de esta ecuación por medio de las relaciones apropiadas de las propiedades termodinámicas con la energía libre de Gibbs.
Medición
Cuando se mide la concentración de un soluto en una mezcla líquida o gaseosa sobresaturada, es obvio que la presión dentro de la cubeta puede ser mayor que la presión ambiental. Cuando esto sea así, se debe utilizar una cubeta especializada. La elección de la técnica analítica a utilizar dependerá de las características del analito.
Aplicaciones
Las características de sobresaturación tienen aplicaciones prácticas en términos de productos farmacéuticos. Al crear una solución sobresaturada de un determinado fármaco, se puede ingerir en forma líquida. El fármaco se puede llevar a un estado sobresaturado a través de cualquier mecanismo normal y luego evitar que se precipite agregando inhibidores de la precipitación. Los medicamentos en este estado se denominan "servicios de administración de medicamentos sobresaturados" o "SDDS". El consumo oral de un fármaco en esta forma es sencillo y permite la medición de dosis muy precisas. Principalmente, proporciona un medio para convertir fármacos con muy baja solubilidad en soluciones acuosas. Además, algunas drogas pueden sufrir una sobresaturación dentro del cuerpo a pesar de ser ingeridas en forma cristalina.Este fenómeno se conoce como sobresaturación in vivo.
La identificación de soluciones sobresaturadas se puede utilizar como una herramienta para que los ecólogos marinos estudien la actividad de organismos y poblaciones. Los organismos fotosintéticos liberan gas O 2 en el agua. Por lo tanto, es probable que se pueda determinar que un área del océano sobresaturada con gas O 2 es rica en actividad fotosintética. Aunque algo de O 2 se encontrará de forma natural en el océano debido a propiedades químicas físicas simples, más del 70 % de todo el oxígeno gaseoso que se encuentra en las regiones sobresaturadas se puede atribuir a la actividad fotosintética.
La sobresaturación en fase de vapor suele estar presente en el proceso de expansión a través de boquillas de vapor que funcionan con vapor sobrecalentado en la entrada, que pasa a estado saturado en la salida. La sobresaturación se convierte así en un factor importante a tener en cuenta en el diseño de turbinas de vapor, ya que da como resultado un flujo de masa real de vapor a través de la boquilla que es de 1 a 3% mayor que el valor calculado teóricamente que se esperaría si la expansión el vapor pasó por un proceso adiabático reversible a través de estados de equilibrio. En estos casos la sobresaturación se produce debido a que el proceso de expansión se desarrolla tan rápidamente y en tan poco tiempo, que el vapor en expansión no puede alcanzar su estado de equilibrio en el proceso, comportándose como si estuviera sobrecalentado. De ahí la determinación de la relación de expansión,
El estudio de la sobresaturación también es relevante para los estudios atmosféricos. Desde la década de 1940 se conoce la presencia de sobresaturación en la atmósfera. Cuando el agua está sobresaturada en la troposfera, se observa con frecuencia la formación de redes de hielo. En un estado de saturación, las partículas de agua no formarán hielo en condiciones troposféricas. No es suficiente que las moléculas de agua formen una red de hielo a presiones de saturación; requieren una superficie para condensarse o conglomerados de moléculas de agua líquida para congelarse. Por estas razones, las humedades relativas sobre el hielo en la atmósfera se pueden encontrar por encima del 100 %, lo que significa que se ha producido una sobresaturación. La sobresaturación de agua es en realidad muy común en la troposfera superior y ocurre entre el 20% y el 40% del tiempo.Esto se puede determinar usando datos satelitales del Atmospheric Infrared Sounder.
Contenido relacionado
Anilina
Ánodo
Calcógenos