Gas
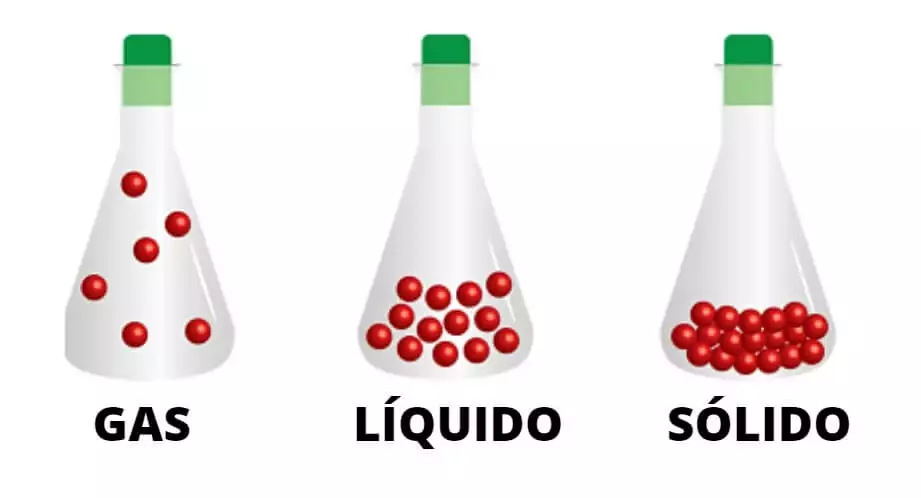
El gas o estado gaseoso es uno de los cuatro estados fundamentales de la materia (los otros son sólido, líquido y plasma).
Un gas puro puede estar formado por átomos individuales (p. ej., un gas noble como el neón), moléculas elementales formadas por un tipo de átomo (p. ej., oxígeno) o moléculas compuestas formadas por una variedad de átomos (p. ej., dióxido de carbono). Una mezcla de gases, como el aire, contiene una variedad de gases puros. Lo que distingue a un gas de los líquidos y los sólidos es la gran separación de las partículas de gas individuales. Esta separación generalmente hace que un gas incoloro sea invisible para el observador humano.
El estado gaseoso de la materia ocurre entre los estados líquido y plasma, el último de los cuales proporciona el límite de temperatura superior para los gases. Limitando el extremo inferior de la escala de temperatura se encuentran los gases cuánticos degenerativos que están ganando cada vez más atención. Los gases atómicos de alta densidad sobreenfriados a temperaturas muy bajas se clasifican por su comportamiento estadístico como gases de Bose o gases de Fermi. Para obtener una lista completa de estos estados exóticos de la materia, consulte la lista de estados de la materia.
Gases elementales

Los únicos elementos químicos que son moléculas homonucleares diatómicas estables en STP son hidrógeno (H 2), nitrógeno (N 2), oxígeno (O 2) y dos halógenos: flúor (F 2) y cloro (Cl 2). Cuando se agrupan junto con los gases nobles monoatómicos: helio (He), neón (Ne), argón (Ar), criptón (Kr), xenón (Xe) y radón (Rn), estos gases se denominan "gases elementales"..
Etimología
La palabra gas fue utilizada por primera vez por el químico flamenco de principios del siglo XVII, Jan Baptist van Helmont. Identificó el dióxido de carbono, el primer gas conocido además del aire. La palabra de Van Helmont parece haber sido simplemente una transcripción fonética de la palabra griega antigua χάος Caos – la g en holandés se pronuncia como ch en "loch" (fricativa velar sorda, / x /) – en cuyo caso Van Helmont simplemente estaba siguiendo la uso alquímico establecido por primera vez atestiguado en las obras de Paracelso. Según la terminología de Paracelso, el caos significaba algo así como "agua ultra-rarificada".
Una historia alternativa es que el término de Van Helmont se derivó de " gahst (o geist), que significa fantasma o espíritu". Los editores del Oxford English Dictionary no dan crédito a esa historia. Por el contrario, el historiador franco-estadounidense Jacques Barzun especuló que Van Helmont había tomado prestada la palabra del alemán Gäscht, que significa la espuma resultante de la fermentación.
Características físicas
Debido a que la mayoría de los gases son difíciles de observar directamente, se describen mediante el uso de cuatro propiedades físicas o características macroscópicas: presión, volumen, número de partículas (los químicos las agrupan por moles) y temperatura. Estas cuatro características fueron repetidamente observadas por científicos como Robert Boyle, Jacques Charles, John Dalton, Joseph Gay-Lussac y Amedeo Avogadro para una variedad de gases en varios entornos. Sus estudios detallados finalmente llevaron a una relación matemática entre estas propiedades expresadas por la ley de los gases ideales (consulte la sección de modelos simplificados a continuación).
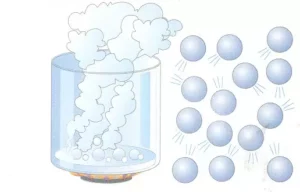
Las partículas de gas están muy separadas entre sí y, en consecuencia, tienen enlaces intermoleculares más débiles que los líquidos o los sólidos. Estas fuerzas intermoleculares resultan de interacciones electrostáticas entre partículas de gas. Las áreas con carga similar de diferentes partículas de gas se repelen, mientras que las regiones con carga opuesta de diferentes partículas de gas se atraen entre sí; Los gases que contienen iones permanentemente cargados se conocen como plasmas. Los compuestos gaseosos con enlaces covalentes polares contienen desequilibrios de carga permanentes y, por lo tanto, experimentan fuerzas intermoleculares relativamente fuertes, aunque la molécula mientras la carga neta del compuesto permanece neutra. Existen cargas transitorias inducidas aleatoriamente a través de enlaces covalentes no polares de moléculas y las interacciones electrostáticas causadas por ellas se denominan fuerzas de Van der Waals.Una comparación de los puntos de ebullición de los compuestos formados por enlaces iónicos y covalentes nos lleva a esta conclusión. Las partículas de humo a la deriva en la imagen brindan una idea del comportamiento del gas a baja presión.
En comparación con los otros estados de la materia, los gases tienen baja densidad y viscosidad. La presión y la temperatura influyen en las partículas dentro de un cierto volumen. Esta variación en la separación y la velocidad de las partículas se conoce como compresibilidad. Esta separación y tamaño de partículas influye en las propiedades ópticas de los gases, como se puede encontrar en la siguiente lista de índices de refracción. Finalmente, las partículas de gas se separan o difunden para distribuirse homogéneamente en cualquier recipiente.
Vista macroscópica de gases
Cuando se observa un gas, es típico especificar un marco de referencia o una escala de longitud. Una escala de mayor longitud corresponde a un punto de vista macroscópico o global del gas. Esta región (denominada volumen) debe tener un tamaño suficiente para contener una gran muestra de partículas de gas. El análisis estadístico resultante de este tamaño de muestra produce el comportamiento "promedio" (es decir, velocidad, temperatura o presión) de todas las partículas de gas dentro de la región. Por el contrario, una escala de menor longitud corresponde a un punto de vista microscópico o de partículas.
Macroscópicamente, las características del gas medidas son en términos de las propias partículas de gas (velocidad, presión o temperatura) o de su entorno (volumen). Por ejemplo, Robert Boyle estudió química neumática durante una pequeña parte de su carrera. Uno de sus experimentos relacionó las propiedades macroscópicas de presión y volumen de un gas. Su experimento usó un manómetro de tubo en J que parece un tubo de ensayo con la forma de la letra J. Boyle atrapó un gas inerte en el extremo cerrado del tubo de ensayo con una columna de mercurio, lo que hizo que el número de partículas y la temperatura constante. Observó que cuando se aumentaba la presión en el gas, al agregar más mercurio a la columna, el volumen del gas atrapado disminuía (esto se conoce como relación inversa). Además, cuando Boyle multiplicó la presión y el volumen de cada observación, el producto era constante. Esta relación se mantuvo para cada gas que Boyle observó que conduce a la ley, (PV=k), nombrado en honor a su trabajo en este campo.
Hay muchas herramientas matemáticas disponibles para analizar las propiedades de los gases. A medida que los gases están sujetos a condiciones extremas, estas herramientas se vuelven más complejas, desde las ecuaciones de Euler para el flujo no viscoso hasta las ecuaciones de Navier-Stokes que explican por completo los efectos viscosos. Estas ecuaciones se adaptan a las condiciones del sistema de gas en cuestión. El equipo de laboratorio de Boyle permitió el uso del álgebra para obtener sus resultados analíticos. Sus resultados fueron posibles porque estaba estudiando gases en situaciones de presión relativamente baja donde se comportaban de una manera "ideal". Estas relaciones ideales se aplican a los cálculos de seguridad para una variedad de condiciones de vuelo sobre los materiales en uso. El equipo de alta tecnología que se usa hoy en día fue diseñado para ayudarnos a explorar con seguridad los entornos operativos más exóticos donde los gases ya no se comportan de manera "
Presión

El símbolo utilizado para representar la presión en las ecuaciones es "p" o "P" con unidades SI de pascales.
Cuando se describe un contenedor de gas, el término presión (o presión absoluta) se refiere a la fuerza promedio por unidad de área que el gas ejerce sobre la superficie del contenedor. Dentro de este volumen, a veces es más fácil visualizar las partículas de gas moviéndose en línea recta hasta que chocan con el contenedor (ver diagrama en la parte superior del artículo). La fuerza impartida por una partícula de gas en el recipiente durante esta colisión es el cambio en el momento de la partícula. Durante una colisión sólo cambia la componente normal de la velocidad. Una partícula que viaja paralela a la pared no cambia su cantidad de movimiento. Por lo tanto, la fuerza promedio sobre una superficie debe ser el cambio promedio en el momento lineal de todas estas colisiones de partículas de gas.
La presión es la suma de todos los componentes normales de la fuerza ejercida por las partículas que chocan contra las paredes del recipiente dividida por el área superficial de la pared.
Temperatura
El símbolo utilizado para representar la temperatura en las ecuaciones es T con unidades SI de kelvins.
La velocidad de una partícula de gas es proporcional a su temperatura absoluta. El volumen del globo en el video se reduce cuando las partículas de gas atrapadas se ralentizan con la adición de nitrógeno extremadamente frío. La temperatura de cualquier sistema físico está relacionada con los movimientos de las partículas (moléculas y átomos) que forman el sistema [de gas].En mecánica estadística, la temperatura es la medida de la energía cinética promedio almacenada en una molécula (también conocida como energía térmica). Los métodos para almacenar esta energía están dictados por los grados de libertad de la propia molécula (modos de energía). La energía térmica (cinética) agregada a un gas o líquido (un proceso endotérmico) produce movimiento de traslación, rotación y vibración. Por el contrario, un sólido solo puede aumentar su energía interna al excitar modos vibratorios adicionales, ya que la estructura de la red cristalina evita el movimiento de traslación y rotación. Estas moléculas de gas calentadas tienen un mayor rango de velocidad (distribución más amplia de velocidades) con un promedio o media más alto .velocidad. La variación de esta distribución se debe a que las velocidades de las partículas individuales varían constantemente, debido a las repetidas colisiones con otras partículas. El rango de velocidad se puede describir mediante la distribución de Maxwell-Boltzmann. El uso de esta distribución implica gases ideales cerca del equilibrio termodinámico para el sistema de partículas que se está considerando.
Volumen específico
El símbolo utilizado para representar el volumen específico en las ecuaciones es "v" con unidades SI de metros cúbicos por kilogramo.
El símbolo utilizado para representar el volumen en las ecuaciones es "V" con unidades SI de metros cúbicos.
Al realizar un análisis termodinámico, es típico hablar de propiedades intensivas y extensivas. Las propiedades que dependen de la cantidad de gas (ya sea en masa o en volumen) se denominan propiedades extensivas, mientras que las propiedades que no dependen de la cantidad de gas se denominan propiedades intensivas. El volumen específico es un ejemplo de una propiedad intensiva porque es la relación del volumen ocupado por una unidad de masa de un gas que es idéntico en todo un sistema en equilibrio. 1000 átomos de un gas ocupan el mismo espacio que cualquier otro 1000 átomos para cualquier temperatura y presión dadas. Este concepto es más fácil de visualizar para sólidos como el hierro, que son incompresibles en comparación con los gases. Sin embargo, el volumen en sí --- no específico --- es una propiedad extensiva.
Densidad
El símbolo utilizado para representar la densidad en las ecuaciones es ρ (rho) con unidades SI de kilogramos por metro cúbico. Este término es el recíproco del volumen específico.
Dado que las moléculas de gas pueden moverse libremente dentro de un recipiente, su masa normalmente se caracteriza por la densidad. La densidad es la cantidad de masa por unidad de volumen de una sustancia, o la inversa del volumen específico. En el caso de los gases, la densidad puede variar en un amplio rango porque las partículas tienen la libertad de moverse más juntas cuando están limitadas por la presión o el volumen. Esta variación de densidad se denomina compresibilidad. Al igual que la presión y la temperatura, la densidad es una variable de estado de un gas y el cambio de densidad durante cualquier proceso se rige por las leyes de la termodinámica. Para un gas estático, la densidad es la misma en todo el contenedor. Por lo tanto, la densidad es una cantidad escalar. Se puede demostrar por teoría cinética que la densidad es inversamente proporcional al tamaño del recipiente en el que está confinada una masa fija de gas. En este caso de una masa fija,
Vista microscópica de gases
Si uno pudiera observar un gas bajo un potente microscopio, vería una colección de partículas sin forma o volumen definidos que están en movimiento más o menos aleatorio. Estas partículas de gas solo cambian de dirección cuando chocan con otra partícula o con los lados del recipiente. Esta vista microscópica del gas está bien descrita por la mecánica estadística, pero puede ser descrita por muchas teorías diferentes. La teoría cinética de los gases, que supone que estas colisiones son perfectamente elásticas, no tiene en cuenta las fuerzas intermoleculares de atracción y repulsión.
Teoría cinética de los gases.
La teoría cinética proporciona información sobre las propiedades macroscópicas de los gases al considerar su composición y movimiento molecular. Comenzando con las definiciones de cantidad de movimiento y energía cinética, uno puede usar la conservación de la cantidad de movimiento y las relaciones geométricas de un cubo para relacionar las propiedades macroscópicas del sistema de temperatura y presión con la propiedad microscópica de la energía cinética por molécula. La teoría proporciona valores promedio para estas dos propiedades.
La teoría cinética de los gases puede ayudar a explicar cómo el sistema (considerando la colección de partículas de gas) responde a los cambios de temperatura, con un cambio correspondiente en la energía cinética.
Por ejemplo: imagine que tiene un recipiente sellado de tamaño fijo (un volumen constante), que contiene un número fijo de partículas de gas; a partir del cero absoluto (la temperatura teórica a la que los átomos o moléculas no tienen energía térmica, es decir, no se mueven ni vibran), se empieza a añadir energía al sistema calentando el recipiente, de modo que la energía se transfiera a las partículas del interior. Una vez que su energía interna está por encima de la energía de punto cero, es decir, su energía cinética (también conocida como energía térmica)energía) es distinto de cero, las partículas de gas comenzarán a moverse alrededor del contenedor. A medida que la caja se calienta más (a medida que se agrega más energía), las partículas individuales aumentan su velocidad promedio a medida que aumenta la energía interna total del sistema. La mayor velocidad promedio de todas las partículas conduce a una mayor tasa de colisiones (es decir, mayor número de colisiones por unidad de tiempo), entre las partículas y el contenedor, así como entre las propias partículas.
La cantidad de presión macroscópica y medible es el resultado directo de estas colisiones de partículas microscópicas con la superficie, sobre las cuales las moléculas individuales ejercen una pequeña fuerza, cada una de las cuales contribuye a la fuerza total aplicada dentro de un área específica. (Lea " Presión " en la sección anterior " Vista macroscópica de los gases ".)
Del mismo modo, la cantidad de temperatura medible macroscópicamente es una cuantificación de la cantidad total de movimiento o energía cinética que exhiben las partículas. (Lea " Temperatura " en la sección anterior " Vista macroscópica de los gases ".)
Movimiento térmico y mecánica estadística.
En la teoría cinética de los gases, se supone que la energía cinética consiste puramente en traslaciones lineales de acuerdo con la distribución de velocidades de las partículas en el sistema. Sin embargo, en gases realesy otras sustancias reales, los movimientos que definen la energía cinética de un sistema (que en conjunto determinan la temperatura), son mucho más complejos que la simple traslación lineal debido a la estructura más compleja de las moléculas, en comparación con los átomos individuales que actúan de manera similar a los puntos. masas. En los sistemas termodinámicos reales, los fenómenos cuánticos juegan un papel importante en la determinación de los movimientos térmicos. Los movimientos térmicos aleatorios (energía cinética) en las moléculas son una combinación de un conjunto finito de posibles movimientos que incluyen traslación, rotación y vibración. Este rango finito de posibles movimientos, junto con el conjunto finito de moléculas en el sistema, conduce a un número finito de microestados dentro del sistema; llamamos conjunto al conjunto de todos los microestados .Específicos de los sistemas atómicos o moleculares, podríamos tener potencialmente tres tipos diferentes de conjuntos, según la situación: conjunto microcanónico, conjunto canónico o conjunto canónico general. Las combinaciones específicas de microestados dentro de un conjunto son cómo definimos verdaderamente el macroestado del sistema (temperatura, presión, energía, etc.). Para hacer eso, primero debemos contar todos los microestados mediante el uso de una función de partición.El uso de la mecánica estadística y la función de partición es una herramienta importante en toda la química física, porque es la clave para la conexión entre los estados microscópicos de un sistema y las variables macroscópicas que podemos medir, como temperatura, presión, capacidad calorífica., energía interna, entalpía y entropía, solo por nombrar algunos. (Leer: Función de partición Significado y significado)
El uso de la función de partición para encontrar la energía de una molécula, o sistema de moléculas, a veces se puede aproximar mediante el teorema de Equipartición, que simplifica enormemente el cálculo. Sin embargo, este método asume que todos los grados de libertad moleculares están poblados por igual y, por lo tanto, se utilizan por igual para almacenar energía dentro de la molécula. Implicaría que la energía interna cambia linealmente con la temperatura, lo cual no es el caso. Esto ignora el hecho de que la capacidad calorífica cambia con la temperatura, debido a que ciertos grados de libertad son inalcanzables (también conocidos como "congelados") a temperaturas más bajas. A medida que aumenta la energía interna de las moléculas, también lo hace la capacidad de almacenar energía dentro de grados de libertad adicionales. A medida que se dispone de más grados de libertad para retener energía, aumenta la capacidad calorífica molar de la sustancia.
Movimiento browniano
El movimiento browniano es el modelo matemático utilizado para describir el movimiento aleatorio de partículas suspendidas en un fluido. La animación de partículas de gas, usando partículas rosas y verdes, ilustra cómo este comportamiento resulta en la dispersión de los gases (entropía). Estos eventos también son descritos por la teoría de partículas.
Dado que está en el límite (o más allá) de la tecnología actual para observar partículas de gas individuales (átomos o moléculas), solo los cálculos teóricos dan sugerencias sobre cómo se mueven, pero su movimiento es diferente del movimiento browniano porque el movimiento browniano implica un arrastre suave debido a la fuerza de fricción de muchas moléculas de gas, interrumpida por colisiones violentas de una (o varias) moléculas de gas individuales con la partícula. La partícula (que generalmente consta de millones o miles de millones de átomos) se mueve en un curso irregular, pero no tan irregular como se esperaría si se examinara una molécula de gas individual.
Fuerzas intermoleculares: la principal diferencia entre los gases reales e ideales
Las fuerzas entre dos o más moléculas o átomos, ya sean de atracción o de repulsión, se denominan fuerzas intermoleculares. Las moléculas experimentan fuerzas intermoleculares cuando están físicamente próximas entre sí. Estas fuerzas son muy importantes para modelar adecuadamente los sistemas moleculares, para predecir con precisión el comportamiento microscópico de las moléculas en cualquier sistema y, por lo tanto, son necesarias para predecir con precisión las propiedades físicas de los gases (y líquidos) a través de amplias variaciones en las condiciones físicas.
Surgidas del estudio de la química física, una de las fuerzas intermoleculares más destacadas en toda la física son las fuerzas de van der Waals. Las fuerzas de Van der Waals desempeñan un papel clave en la determinación de casi todas las propiedades físicas de los fluidos, como la viscosidad, el caudal y la dinámica de los gases (consulte la sección de características físicas). Las interacciones de van der Waals entre moléculas de gas, es la razón por la cual modelar un "gas real" es matemáticamente más difícil que un " gas ideal ". Ignorar estas fuerzas dependientes de la proximidad permite tratar un gas real como un gas ideal, lo que simplifica enormemente el cálculo.
Las atracciones y repulsiones intermoleculares entre dos moléculas de gas dependen de la distancia entre ellas. Las atracciones y repulsiones combinadas están bien modeladas por el potencial de Lennard-Jones, que es uno de los potenciales interatómicos más estudiados que describen la energía potencial de los sistemas moleculares. El potencial de Lennard-Jones entre moléculas se puede dividir en dos componentes separados: una atracción de larga distancia debido a la fuerza de dispersión de London y una repulsión de corto alcance debido a la interacción de intercambio electrón-electrón (que está relacionado con el principio de exclusión de Pauli).
Cuando dos moléculas están relativamente distantes (lo que significa que tienen una energía potencial alta), experimentan una fuerza de atracción débil, lo que hace que se muevan una hacia la otra, lo que reduce su energía potencial. Sin embargo, si las moléculas están demasiado lejos, no experimentarán una fuerza de atracción significativa. Además, si las moléculas se acercan demasiado, chocarán y experimentarán una fuerza de repulsión muy alta (modelada por esferas duras), que es una fuerza mucho más fuerte que las atracciones, por lo que se ignora cualquier atracción debida a la proximidad.
A medida que dos moléculas se acercan, desde una distancia que no es ni demasiado lejana ni demasiado cercana, su atracción aumenta a medida que aumenta la magnitud de su energía potencial (que se vuelve más negativa) y disminuye su energía interna total. La atracción que hace que las moléculas se acerquen solo puede ocurrir si las moléculas permanecen en la proximidad durante el tiempo que lleva acercarse físicamente. Por lo tanto, las fuerzas de atracción son más fuertes cuando las moléculas se mueven a bajas velocidades. Esto significa que la atracción entre moléculas es significativa cuando la temperatura del gas es baja. Sin embargo, si tuviera que comprimir isotérmicamente este gas frío en un volumen pequeño,Al obligar a las moléculas a acercarse mucho y aumentar la presión, las repulsiones comenzarán a dominar sobre las atracciones, ya que la velocidad a la que ocurren las colisiones aumentará significativamente. Por lo tanto, a bajas temperaturas y bajas presiones, la atracción es la interacción intermolecular dominante.
Si dos moléculas se mueven a altas velocidades, en direcciones arbitrarias, a lo largo de caminos que no se cruzan, entonces no pasarán suficiente tiempo en las proximidades para verse afectadas por la fuerza atractiva de dispersión de London. Si las dos moléculas chocan, se están moviendo demasiado rápido y su energía cinética será mucho mayor que cualquier energía potencial atractiva, por lo que solo experimentarán repulsión al chocar. Por lo tanto, las atracciones entre moléculas pueden despreciarse a altas temperaturas debido a las altas velocidades. A altas temperaturas y altas presiones, la repulsión es la interacción intermolecular dominante.
Teniendo en cuenta los efectos mencionados anteriormente que causan estas atracciones y repulsiones, los gases reales se delinean del modelo de gas ideal mediante la siguiente generalización:
- A bajas temperaturas y bajas presiones, el volumen ocupado por un gas real es menor que el volumen predicho por la ley de los gases ideales.
- A altas temperaturas y altas presiones, el volumen ocupado por un gas real es mayor que el volumen predicho por la ley de los gases ideales.
Modelos matemáticos
Una ecuación de estado (para gases) es un modelo matemático que se utiliza para describir o predecir aproximadamente las propiedades de estado de un gas. En la actualidad, no existe una única ecuación de estado que prediga con precisión las propiedades de todos los gases en todas las condiciones. Por lo tanto, se han desarrollado varias ecuaciones de estado mucho más precisas para gases en rangos específicos de temperatura y presión. Los "modelos de gas" que más se discuten son "gas perfecto", "gas ideal" y "gas real". Cada uno de estos modelos tiene su propio conjunto de suposiciones para facilitar el análisis de un sistema termodinámico dado. Cada modelo sucesivo amplía el rango de temperatura de cobertura al que se aplica.
Gas ideal y perfecto
La ecuación de estado para un gas ideal o perfecto es la ley de los gases ideales y se lee 


La ley de los gases ideales no hace una suposición sobre el calor específico de un gas. En el caso más general, el calor específico es una función tanto de la temperatura como de la presión. Si se desprecia la dependencia de la presión (y posiblemente también la dependencia de la temperatura) en una aplicación particular, a veces se dice que el gas es un gas perfecto, aunque las suposiciones exactas pueden variar según el autor y/o el campo de la ciencia.
Para un gas ideal, la ley de los gases ideales se aplica sin restricciones en el calor específico. Un gas ideal es un "gas real" simplificado con el supuesto de que el factor de compresibilidad Z se establece en 1, lo que significa que esta relación neumática permanece constante. Un factor de compresibilidad de uno también requiere que las cuatro variables de estado sigan la ley de los gases ideales.
Esta aproximación es más adecuada para aplicaciones en ingeniería, aunque se pueden usar modelos más simples para producir un rango "aproximado" en cuanto a dónde debería estar la solución real. Un ejemplo en el que la "aproximación del gas ideal" sería adecuada sería el interior de una cámara de combustión de un motor a reacción. También puede ser útil conservar las reacciones elementales y las disociaciones químicas para el cálculo de emisiones.
Gasolina de verdad
Cada uno de los supuestos enumerados a continuación se suma a la complejidad de la solución del problema. A medida que la densidad de un gas aumenta con el aumento de la presión, las fuerzas intermoleculares desempeñan un papel más importante en el comportamiento del gas, lo que hace que la ley de los gases ideales ya no proporcione resultados "razonables". En el extremo superior de los rangos de temperatura del motor (por ejemplo, secciones de la cámara de combustión: 1300 K), las partículas complejas de combustible absorben energía interna por medio de rotaciones y vibraciones que hacen que sus calores específicos varíen de los de las moléculas diatómicas y los gases nobles. A más del doble de esa temperatura, comienza a producirse la excitación electrónica y la disociación de las partículas de gas, lo que hace que la presión se ajuste a un mayor número de partículas (transición de gas a plasma).Finalmente, se supuso que todos los procesos termodinámicos describían gases uniformes cuyas velocidades variaban según una distribución fija. El uso de una situación de no equilibrio implica que el campo de flujo debe caracterizarse de alguna manera para permitir una solución. Uno de los primeros intentos de expandir los límites de la ley de los gases ideales fue incluir cobertura para diferentes procesos termodinámicos ajustando la ecuación para leer pV = constante y luego variando n a través de diferentes valores como la relación de calor específico, γ.
Los efectos reales del gas incluyen los ajustes realizados para tener en cuenta una mayor variedad de comportamientos de los gases:
- Efectos de compresibilidad (se permite que Z varíe de 1.0)
- Capacidad calorífica variable (los calores específicos varían con la temperatura)
- Fuerzas de Van der Waals (relacionadas con la compresibilidad, pueden sustituir otras ecuaciones de estado)
- Efectos termodinámicos de no equilibrio
- Problemas con la disociación molecular y reacciones elementales con composición variable.
Para la mayoría de las aplicaciones, un análisis tan detallado es excesivo. Los ejemplos en los que los efectos de los gases reales tendrían un impacto significativo serían el reingreso del transbordador espacial, donde había temperaturas y presiones extremadamente altas, o los gases producidos durante los eventos geológicos, como en la imagen de la erupción del Monte Redoubt en 1990.
Gas permanente
Gas permanente es un término utilizado para un gas que tiene una temperatura crítica por debajo del rango de temperaturas normales habitables por humanos y, por lo tanto, no puede licuarse por presión dentro de este rango. Históricamente, se pensaba que tales gases eran imposibles de licuar y, por lo tanto, permanecerían permanentemente en estado gaseoso. El término es relevante para el almacenamiento a temperatura ambiente y el transporte de gases a alta presión.
Investigación histórica
Ley de Boyle
La ley de Boyle fue quizás la primera expresión de una ecuación de estado. En 1662, Robert Boyle realizó una serie de experimentos empleando un tubo de vidrio en forma de J, que estaba sellado en un extremo. Se añadió mercurio al tubo, atrapando una cantidad fija de aire en el extremo corto y sellado del tubo. Luego se midió cuidadosamente el volumen de gas a medida que se añadía mercurio adicional al tubo. La presión del gas podría determinarse por la diferencia entre el nivel de mercurio en el extremo corto del tubo y el del extremo largo abierto. La imagen del equipo de Boyle muestra algunas de las exóticas herramientas utilizadas por Boyle durante su estudio de los gases.
A través de estos experimentos, Boyle notó que la presión ejercida por un gas mantenido a temperatura constante varía inversamente con el volumen del gas. Por ejemplo, si el volumen se reduce a la mitad, la presión se duplica; y si el volumen se duplica, la presión se reduce a la mitad. Dada la relación inversa entre presión y volumen, el producto de presión (P) y volumen (V) es una constante (k) para una masa dada de gas confinado siempre que la temperatura sea constante. Expresado como una fórmula, así es:{displaystyle VP=k}
Debido a que los volúmenes y presiones antes y después de la cantidad fija de gas, donde las temperaturas antes y después son iguales, ambas son iguales a la constante k, se pueden relacionar mediante la ecuación:
Ley de charles
En 1787, el físico francés y pionero de los globos, Jacques Charles, descubrió que el oxígeno, el nitrógeno, el hidrógeno, el dióxido de carbono y el aire se expanden en la misma medida en el mismo intervalo de 80 kelvin. Señaló que, para un gas ideal a presión constante, el volumen es directamente proporcional a su temperatura:{displaystyle {frac{V_{1}}{T_{1}}}={frac {V_{2}}{T_{2}}}}
Ley de Gay-Lussac
En 1802, Joseph Louis Gay-Lussac publicó los resultados de experimentos similares, aunque más extensos. Gay-Lussac acreditó el trabajo anterior de Charles al nombrar la ley en su honor. Al propio Gay-Lussac se le atribuye la ley que describe la presión, que encontró en 1809. Establece que la presión ejercida sobre los lados de un recipiente por un gas ideal es proporcional a su temperatura
Ley de avogadro
En 1811, Amedeo Avogadro comprobó que volúmenes iguales de gases puros contienen el mismo número de partículas. Su teoría no fue generalmente aceptada hasta 1858 cuando otro químico italiano, Stanislao Cannizzaro, pudo explicar las excepciones no ideales. Por su trabajo con gases un siglo antes, el número que lleva su nombre, la constante de Avogadro, representa el número de átomos que se encuentran en 12 gramos de carbono-12 elemental (6,022 × 10 mol). Este número específico de partículas de gas, a temperatura y presión estándar (ley de los gases ideales) ocupa 22,40 litros, lo que se denomina volumen molar.
La ley de Avogadro establece que el volumen que ocupa un gas ideal es proporcional al número de moles (o moléculas) presentes en el recipiente. Esto da lugar al volumen molar de un gas, que en STP es de 22,4 dm (o litros). La relación está dada por
donde n es igual al número de moles de gas (el número de moléculas dividido por el número de Avogadro).
Ley de dalton
En 1801, John Dalton publicó la ley de las presiones parciales de su trabajo con la relación de la ley de los gases ideales: La presión de una mezcla de gases no reactivos es igual a la suma de las presiones de todos los gases constituyentes solos. Matemáticamente, esto se puede representar para n especies como:Presión total = Presión 1 + Presión 2 +... + Presión n
La imagen del diario de Dalton muestra la simbología que usó como taquigrafía para registrar el camino que siguió. Entre las observaciones clave de su diario sobre la mezcla de "fluidos elásticos" (gases) no reactivos se encuentran las siguientes:
- A diferencia de los líquidos, los gases más pesados no se desplazaron hacia el fondo al mezclarse.
- La identidad de las partículas de gas no jugó ningún papel en la determinación de la presión final (se comportaron como si su tamaño fuera insignificante).
Temas especiales
Compresibilidad
Los termodinámicos usan este factor (Z) para alterar la ecuación del gas ideal para tener en cuenta los efectos de compresibilidad de los gases reales. Este factor representa la relación entre los volúmenes específicos reales e ideales. A veces se lo denomina "factor de elusión" o corrección para ampliar el rango útil de la ley de los gases ideales con fines de diseño. Por lo general, este valor de Z está muy cerca de la unidad. La imagen del factor de compresibilidad ilustra cómo varía Z en un rango de temperaturas muy frías.
Número de Reynolds
En mecánica de fluidos, el número de Reynolds es la relación entre las fuerzas de inercia (v s ρ) y las fuerzas viscosas (μ/L). Es uno de los números adimensionales más importantes en dinámica de fluidos y se usa, generalmente junto con otros números adimensionales, para proporcionar un criterio para determinar la similitud dinámica. Como tal, el número de Reynolds proporciona el vínculo entre los resultados del modelo (diseño) y las condiciones reales a gran escala. También se puede utilizar para caracterizar el flujo.
Viscosidad
La viscosidad, una propiedad física, es una medida de qué tan bien se adhieren entre sí las moléculas adyacentes. Un sólido puede soportar una fuerza de corte debido a la fuerza de estas fuerzas intermoleculares pegajosas. Un fluido se deformará continuamente cuando se someta a una carga similar. Si bien un gas tiene un valor de viscosidad más bajo que un líquido, sigue siendo una propiedad observable. Si los gases no tuvieran viscosidad, entonces no se pegarían a la superficie de un ala y formarían una capa límite. Un estudio del ala delta en la imagen de Schlieren revela que las partículas de gas se adhieren entre sí (consulte la sección Capa límite).
Turbulencia
En dinámica de fluidos, la turbulencia o el flujo turbulento es un régimen de flujo caracterizado por cambios caóticos y estocásticos en las propiedades. Esto incluye difusión de momento bajo, convección de momento alto y variación rápida de presión y velocidad en el espacio y el tiempo. La vista satelital del clima alrededor de las Islas Robinson Crusoe ilustra un ejemplo.
Capa límite
Las partículas, en efecto, se "pegarán" a la superficie de un objeto que se mueva a través de él. Esta capa de partículas se denomina capa límite. En la superficie del objeto, es esencialmente estático debido a la fricción de la superficie. El objeto, con su capa límite, es efectivamente la nueva forma del objeto que el resto de las moléculas "ven" a medida que el objeto se acerca. Esta capa límite puede separarse de la superficie, esencialmente creando una nueva superficie y cambiando completamente la ruta del flujo. El ejemplo clásico de esto es un perfil aerodinámico estancado. La imagen del ala delta muestra claramente el engrosamiento de la capa límite a medida que el gas fluye de derecha a izquierda a lo largo del borde de ataque.
Principio de máxima entropía
A medida que el número total de grados de libertad se acerque al infinito, el sistema se encontrará en el macroestado que corresponde a la mayor multiplicidad. Para ilustrar este principio, observe la temperatura superficial de una barra de metal congelada. Usando una imagen térmica de la temperatura de la piel, observe la distribución de temperatura en la superficie. Esta observación inicial de la temperatura representa un "microestado". En algún momento futuro, una segunda observación de la temperatura de la piel produce un segundo microestado. Al continuar con este proceso de observación, es posible producir una serie de microestados que ilustran la historia térmica de la superficie de la barra. La caracterización de esta serie histórica de microestados es posible eligiendo el macroestado que los clasifique con éxito en un solo grupo.
Equilibrio termodinámico
Cuando cesa la transferencia de energía de un sistema, esta condición se conoce como equilibrio termodinámico. Por lo general, esta condición implica que el sistema y los alrededores están a la misma temperatura, por lo que ya no se transfiere calor entre ellos. También implica que las fuerzas externas están equilibradas (el volumen no cambia) y todas las reacciones químicas dentro del sistema están completas. La línea de tiempo varía para estos eventos según el sistema en cuestión. Un recipiente de hielo que se derrite a temperatura ambiente lleva horas, mientras que en los semiconductores la transferencia de calor que se produce en la transición del dispositivo de un estado de encendido a apagado podría ser del orden de unos pocos nanosegundos.
Contenido relacionado
Cordita
Ley de Biot-Savart
Polaris UGM-27




