Óxido de sodio (Na₂O)
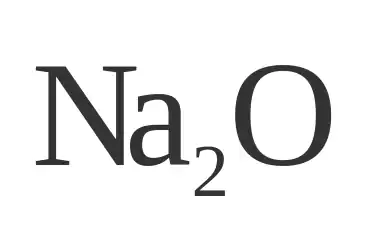
El óxido de sodio, de fórmula química Na2O, es un compuesto químico que se presenta como un sólido blanco y se usa principalmente para la fabricación de cerámica y vidrio. Aunque es raro encontrar el óxido de sodio en su forma pura, el término se emplea para describir diferentes sustancias que contienen sodio en su forma oxidada, y que varían en su composición exacta o se mezclan con otras.
Entre los diversos materiales donde idustrialmente se puede encontrar óxido de sodio se incluyen fertilizantes, vidrios y cerámicas, debido a sus propiedades y características únicas.
Es conocido por su ph alcalino y su capacidad para reaccionar vigorosamente con el agua, formando hidróxido de sodio. Esta reacción libera una considerable cantidad de calor, lo que le clasifica como un compuesto exotérmico. Debido a su naturaleza alcalina, al entrar en contacto con ácidos, reacciona formando sales. Esto produce una reacción ácido-base típica, resultando en la formación de una sal y agua.
Nomenclatura del óxido de sodio
Nomenclatura sistemática:
monóxido de disodio
Nomenclatura stock:
óxido de sodio
Nomenclatura tradicional:
óxido sódico
Denominaciones no estándarizadas:
monóxido de sodio
óxido de disodio
Estructura del óxido de sodio
El óxido de sodio es una sustancia cuya estructura ha sido determinada mediante la cristalografía de rayos X. Este compuesto, al igual que la mayoría de los óxidos de metales alcalinos representados por la fórmula M2O (donde M puede ser Li, Na, K, Rb), cristaliza en la estructura conocida como antifluorita.
En la estructura antifluorita, las posiciones de los aniones y cationes se invierten en comparación con las que tienen en el CaF2. En el caso del óxido de sodio, los iones de sodio están coordinados tetraédricamente, rodeados por 4 iones de óxido. Por otro lado, el óxido se coordina cúbicamente con 8 iones de sodio.
Preparación del óxido de sodio
El óxido de sodio se puede obtener a través de diferentes métodos. Uno de ellos es la reacción del sodio con hidróxido de sodio, peróxido de sodio o nitrito de sodio, representada por la ecuación:
2NaOH + 2Na → 2Na2O + H2
Si el hidróxido de sodio (NaOH) contiene impurezas de agua, se requiere una mayor cantidad de sodio. El sodio sobrante se destila del producto sin refinar.
Otro método para producir óxido de sodio implica calentar una combinación de azida de sodio y nitrato de sodio:
5NaN3 + NaNO3 → 3Na2O + 8N2
Adicionalmente, al quemar sodio en el aire, se obtiene una combinación de Na2O y peróxido de sodio (Na2O2).
Aplicaciones
En la industria del vidrio, el óxido de sodio sirve como fundente, disminuyendo el punto de fusión del material y facilitando su moldeo. Esta propiedad es vital para la producción de diferentes tipos de vidrios y sus aplicaciones. Además, su habilidad para formar sales con ácidos lo hace valioso en la producción de diversos productos químicos y procesos industriales. Su naturaleza alcalina es útil en aplicaciones que buscan neutralizar medios ácidos.
Fabricación de vidrio
El óxido de sodio juega un papel crucial en la fabricación de vidrio. Aunque los vidrios se describen frecuentemente en función de su contenido de óxido de sodio, en realidad no contienen Na2O. En lugar de usar óxido de sodio directamente, se añade su equivalente en forma de "soda" (carbonato de sodio). Este carbonato pierde dióxido de carbono a altas temperaturas siguiendo la reacción:
Na2CO3→Na2O+CO2
Las reacciones subsiguientes con dióxido de silicio son:
Na2O+SiO2→Na2SiO3
Na2CO3+SiO2→Na2SiO3+CO2
Un vidrio típico contiene aproximadamente un 15% de óxido de sodio, un 70% de sílice (dióxido de silicio) y un 9% de cal (óxido de calcio). La "soda" (carbonato de sodio) actúa como fundente, reduciendo la temperatura a la que la sílice se funde. El vidrio resultante de esta mezcla tiene una temperatura de fusión significativamente más baja que la sílice pura y presenta una mayor elasticidad. Esta característica se debe a que el material basado en Na2[SiO2]x[SiO3] es más flexible.
Reacciones
El óxido de sodio reacciona de manera rápida e irreversible con el agua para producir hidróxido de sodio, según la ecuación:
Na2O+H2O→2NaOH
Por esta razón, al óxido de sodio se le conoce en ocasiones como el anhídrido base del hidróxido de sodio. De forma más arcaica, también se le ha llamado "anhídrido de soda cáustica".
Contenido relacionado
Agente reductor
Temperatura y presión estándar
Solución acuosa