Ley de Fick
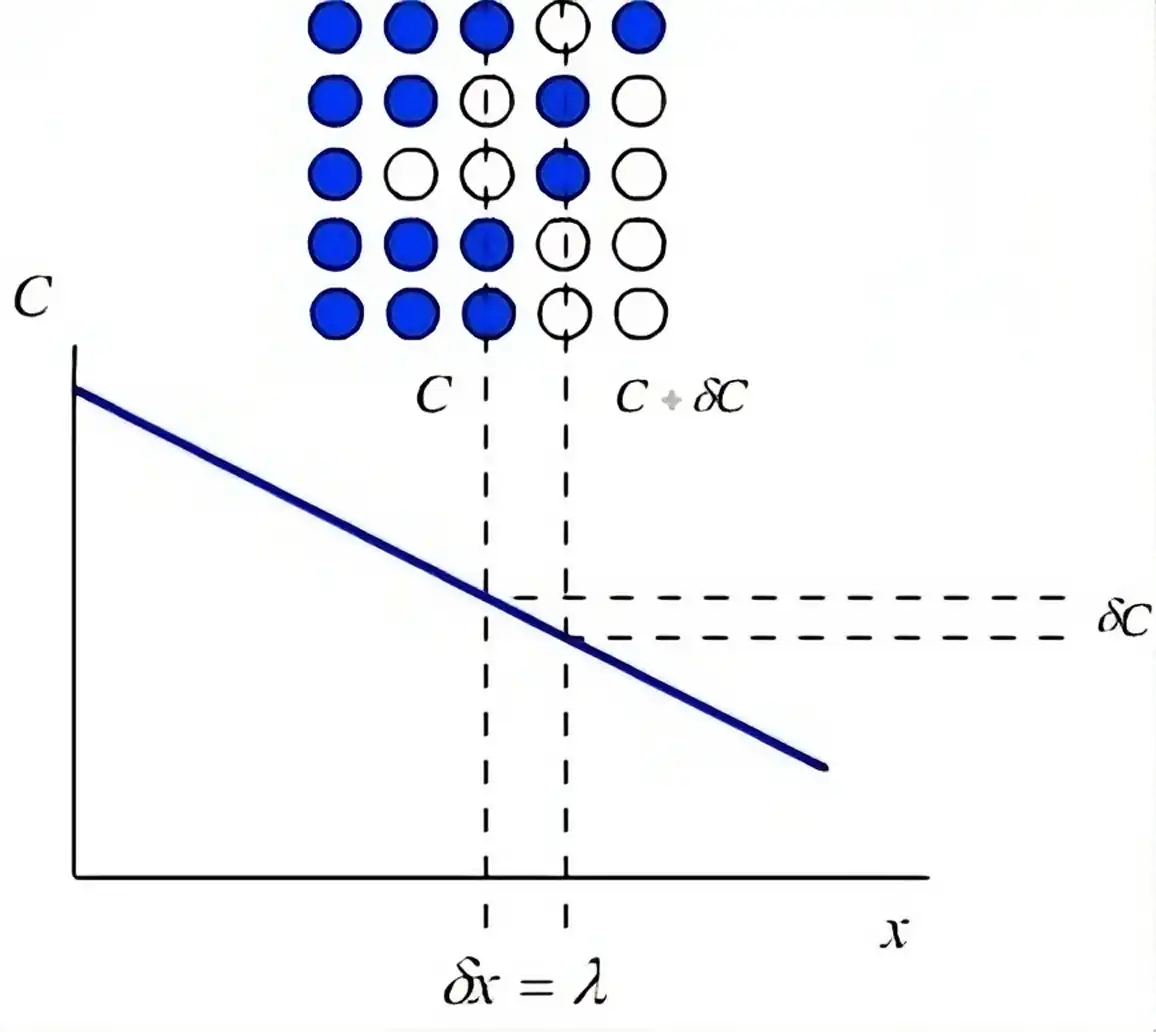
La Ley de Fick es un enunciado que resume la forma en la que operan los principios de difusión. Esta ley cuantifica el movimiento de una sustancia desde una región de alta concentración hacia una de baja concentración, fenómeno conocido como gradiente de concentración. Fue evidenciada por el fisiólogo alemán Adolf Fick en el año de 1855, como parte de sus trabajos sobre sobre la difusión de sustancias. Estos principios son fundamentales en el campo de la fisiología (débito cardíaco) y la física.
La Ley de Fick se divide en dos partes fundamentales: la primera Ley de difusión de Fick y la segunda Ley de difusión de Fick, conocidas en su conjunto como Leyes de difusión de Fick y se usan para resolver el coeficiente de difusión. La primera ley establece que el flujo de partículas a través de una unidad de área en un medio homogéneo es proporcional al gradiente de concentración. Esto significa que las partículas se mueven de regiones de alta concentración a regiones de baja concentración. La segunda ley, por su parte, proporciona una descripción más detallada del cambio de concentración de las partículas con el tiempo.
La velocidad de difusión de una sustancia a través de una membrana es directamente proporcional a la superficie de absorción y al gradiente de concentración de la sustancia a ambos lados de la misma, e inversamente proporcional al grosor de la membrana.
Ley de Fick
La primera Ley de difusión de Fick deriva la segunda Ley de difusión de Fick, que es, en sí misma, la ecuación de difusión. Estas leyes son aplicables en una amplia gama de disciplinas, desde la biología, donde explican el transporte de sustancias a través de las membranas celulares, hasta la ingeniería química, donde son fundamentales para el diseño de procesos y equipos industriales.
No todas las sustancias siguen la Ley de Fick, por lo que se denomina difusión normal o fickiana cuando el movimiento de las partículas sigue los principios establecidos por Fick. En cambio, cuando el proceso de difusión no se ajusta a estos principios, se le conoce como difusión anómala o no fickiana.
HSD
Historia
En 1855, el fisiólogo Adolf Fick informó por primera vez sobre sus ahora conocidas leyes que rigen el transporte de masa a través de medios de difusión. El trabajo de Fick se inspiró en los experimentos anteriores de Thomas Graham, que no llegaron a proponer las leyes fundamentales por las que Fick se haría famoso. La ley de Fick es análoga a las relaciones descubiertas en la misma época por otros científicos eminentes: la ley de Darcy (flujo hidráulico), la ley de Ohm (transporte de carga) y la ley de Fourier. (transporte de calor).
Los experimentos de Fick (inspirados en los de Graham) trataban de medir las concentraciones y flujos de sal, difundiéndose entre dos depósitos a través de tubos de agua. Es de destacar que el trabajo de Fick se refería principalmente a la difusión en fluidos, porque en ese momento, la difusión en sólidos no se consideraba generalmente posible. Hoy en día, las Leyes de Fick forman el núcleo de nuestra comprensión de la difusión en sólidos, líquidos y gases (en ausencia de movimiento de fluidos a granel en los dos últimos casos). Cuando un proceso de difusión no sigue las leyes de Fick (lo que sucede en casos de difusión a través de medios porosos y difusión de penetrantes expansivos, entre otros), se le denomina no- fickiano.
Primera ley de Fick
La primera ley de Fick relaciona el flujo difusivo con el gradiente de concentración. Postula que el flujo va de regiones de alta concentración a regiones de baja concentración, con una magnitud que es proporcional al gradiente de concentración (derivada espacial), o en términos simplistas el concepto de que un soluto se moverá de una región de alta concentración a una región de baja concentración a través de un gradiente de concentración. En una dimensión (espacial), la ley se puede escribir en varias formas, donde la forma más común (ver) es en base molar:
dónde
- J es Flujo de difusión, de los cuales la dimensión es la cantidad de sustancia por área unitaria por tiempo unitario. J mide la cantidad de sustancia que fluirá a través de un área unitaria durante un intervalo de tiempo unitario.
- D es coeficiente de difusión o difusividad. Su dimensión es área por unidad de tiempo.
- φ (para mezclas ideales) es la concentración, de la cual la dimensión es la cantidad de sustancia por volumen de unidad.
- x es posición, cuya dimensión es longitud.
D es proporcional al cuadrado de la velocidad de las partículas que se difunden, que depende de la temperatura, la viscosidad del fluido y la tamaño de las partículas según la relación de Stokes-Einstein. En soluciones acuosas diluidas, los coeficientes de difusión de la mayoría de los iones son similares y tienen valores que a temperatura ambiente están en el rango de (0,6–2)×10−9 m2/ s. Para las moléculas biológicas, los coeficientes de difusión normalmente oscilan entre 10−10 y 10−11 m2/s.
En dos o más dimensiones debemos usar ∇, el operador del o gradiente, que generaliza la primera derivada, obteniendo
donde J indica el vector de flujo de difusión.
La fuerza impulsora de la difusión unidimensional es la cantidad −∂ φ/∂x< /span>, que para mezclas ideales es el gradiente de concentración.
Formulaciones alternativas de la primera ley
Otra forma de la primera ley es escribirla con la variable primaria como fracción de masa (yi< /span>, dado por ejemplo en kg/kg), entonces la ecuación cambia a:
dónde
- el índice i denota los iespecies,
- Ji es vector de flujo de difusión de la iespecies (por ejemplo, en mol/m2- s),
- Mi es la masa molar de la iespecies, y
- *** es la densidad de la mezcla (por ejemplo en kg/m3).
Note que
*** *** {displaystyle rho }
está fuera del operador de gradiente. Esto es porque:
donde ρsi es la densidad parcial de iésima especie.
Más allá de esto, en sistemas químicos que no sean soluciones o mezclas ideales, la fuerza impulsora para la difusión de cada especie es el gradiente de potencial químico de esta especie. Entonces la primera ley de Fick (caso unidimensional) se puede escribir
dónde
- el índice i denota los iespecies.
- c es la concentración (mol/m3).
- R es la constante de gas universal (J/K/mol).
- T es la temperatura absoluta (K).
- μ es el potencial químico (J/mol).
La fuerza motriz de la ley de Fick se puede expresar como una diferencia de fugacidad:
Fugacity
fi{displaystyle F_{i}
tiene unidades Pa.
fi{displaystyle F_{i}
es una presión parcial del componente i en un vapor
fiG{displaystyle F_{i} {G}
o líquido
fiL{displaystyle F_{i} {L}
fase. En el equilibrio líquido de vapor el flujo de evaporación es cero porque
fiG=fiL{displaystyle ¿Qué?
.
Derivación de la primera ley de Fick para gases
A continuación se dan cuatro versiones de la ley de Fick para mezclas binarias de gases. Estos suponen: la difusión térmica es insignificante; la fuerza del cuerpo por unidad de masa es la misma en ambas especies; y la presión es constante o ambas especies tienen la misma masa molar. En estas condiciones, la Ref. muestra en detalle cómo la ecuación de difusión de la teoría cinética de los gases se reduce a esta versión de la ley de Fick:
donde Vi es la velocidad de difusión de las especies i. En términos de flujo de especies esto es
Si, además,
Silencio Silencio *** *** =0{displaystyle nabla rho =0}
, esto reduce a la forma más común de la ley de Fick,
Si (en lugar de
Silencio Silencio *** *** =0{displaystyle nabla rho =0}
) ambas especies tienen la misma masa molar, la ley de Fick se convierte
Donde
xi{displaystyle x_{i}}
es la fracción mole de la especie i.
Segunda ley de Fick
La segunda ley de Fick predice cómo la difusión hace que la concentración cambie con respecto al tiempo. Es una ecuación diferencial parcial que en una dimensión dice:
dónde
- φ es la concentración en dimensiones de [(número de sustancia) longitud−3], ejemplo mol/m3; φ = φ()x,t) es una función que depende de la ubicación x y tiempo t
- t es tiempo, ejemplo s
- D es el coeficiente de difusión en dimensiones de [duración]2 tiempo−1], ejemplo m2/s
- x es la posición [longitud], ejemplo m
En dos o más dimensiones debemos usar el laplaciano Δ = ∇2, que generaliza la segunda derivada, obteniendo la ecuación
La segunda ley de Fick tiene la misma forma matemática que la ecuación del calor y su solución fundamental es la misma que el núcleo del calor, excepto cambiar la conductividad térmica
k{displaystyle k}
con coeficiente de difusión
D{displaystyle D}
:
Derivación de la segunda ley de Fick
La segunda ley de Fick se puede derivar de la primera ley de Fick y la conservación de la masa en ausencia de reacciones químicas:
Asumiendo que el coeficiente de difusión D es una constante, uno puede intercambiar los órdenes de la diferenciación y multiplicar por la constante:
y, por lo tanto, recibir la forma de las ecuaciones de Fick como se indicó anteriormente.
Para el caso de difusión en dos o más dimensiones, la segunda ley de Fick se convierte en
que es análoga a la ecuación del calor.
Si el coeficiente de difusión no es una constante, sino que depende de la coordenada o la concentración, la segunda ley de Fick produce
Un ejemplo importante es el caso en el que φ está en un estado estacionario, es decir, la concentración no cambia con el tiempo, por lo que la parte izquierda de la ecuación anterior es idénticamente cero. En una dimensión con D constante, la solución para la concentración será un cambio lineal de concentraciones a lo largo de x. En dos o más dimensiones obtenemos
que es la ecuación de Laplace, cuyas soluciones los matemáticos denominan funciones armónicas.
Ejemplos de soluciones y generalización
La segunda ley de Fick es un caso especial de la ecuación de convección-difusión en la que no hay flujo advectivo ni fuente volumétrica neta. Se puede derivar de la ecuación de continuidad:
donde j es el flujo total y R< /span> es una fuente volumétrica neta para φ. Se supone que la única fuente de flujo en esta situación es flujo difusivo:
Conectando la definición de flujo difusivo a la ecuación de continuidad y asumiendo que no hay una fuente (R = 0), llegamos a Fick's segunda ley:
Si el flujo fuera el resultado tanto del flujo difusivo como del flujo advectivo, el resultado sería la ecuación de convección-difusión.
Ejemplo de solución 1: fuente de concentración constante y longitud de difusión
Un caso simple de difusión con el tiempo t en una dimensión (tomada como el estilo x-axis) desde un límite ubicado en la posición x = 0, donde la concentración se mantiene en un valor n0 es
donde erfc es la función de error complementaria. Este es el caso cuando los gases corrosivos se difunden a través de la capa oxidativa hacia la superficie del metal (si asumimos que la concentración de gases en el ambiente es constante y el espacio de difusión, es decir, la capa de productos de corrosión, es semi-infinito< /i>, comenzando en 0 en la superficie y extendiéndose infinitamente profundo en el material). Si, a su vez, el espacio de difusión es infinito (durando tanto a través de la capa con n(x, 0) = 0, x > 0 y eso con n</ i>(x, 0) = n0, x</ i> ≤ 0), entonces la solución se modifica solo con el coeficiente 1/2 delante de n0 (ya que la difusión ahora ocurre en ambas direcciones). Este caso es válido cuando alguna solución con concentración n0 se pone en contacto con una capa de disolvente puro. (Bokstein, 2005) La longitud 2√Dt< /i> se denomina longitud de difusión y proporciona una medida de hasta dónde se ha propagado la concentración en el x-dirección por difusión en el tiempo t (Bird, 1976).
Como una aproximación rápida de la función de error, se pueden usar los dos primeros términos de la serie de Taylor:
Si D depende del tiempo, la duración de la difusión se vuelve
Esta idea es útil para estimar la duración de la difusión en un ciclo de calentamiento y enfriamiento, donde D varía con la temperatura.
Ejemplo de solución 2: partícula browniana y desplazamiento cuadrático medio
Otro caso simple de difusión es el movimiento browniano de una partícula. El desplazamiento cuadrático medio de la partícula desde su posición original es:
Donde
n{displaystyle n}
es la dimensión del movimiento Brownian de la partícula. Por ejemplo, la difusión de una molécula a través de una membrana celular 8 nm de espesor es una difusión 1-D debido a la simetría esférica; Sin embargo, la difusión de una molécula de la membrana al centro de una célula eucariota es una difusión 3-D. Para un cactus cilíndrico, la difusión de células fotosintéticas en su superficie a su centro (el eje de su simetría cilíndrica) es una difusión 2-D.
La raíz cuadrada de MSD,
2nDt{displaystyle {sqrt {2nDt}}
, se utiliza a menudo como una caracterización de cuán lejos ha movido la partícula después del tiempo
t{displaystyle t}
ha pasado. El MSD se distribuye simétricamente en el espacio 1D, 2D y 3D. Así, la distribución de probabilidad de la magnitud de MSD en 1D es Gaussian y 3D es una distribución Maxwell-Boltzmann.
Generalizaciones
- In medios no homogéneos, el coeficiente de difusión varía en el espacio, D = D()x). Esta dependencia no afecta a la primera ley de Fick, pero la segunda ley cambia:
- In medios anisotrópicos, el coeficiente de difusión depende de la dirección. Es un tensor simétrico Dji = Dij. La primera ley de Fick cambia
es el producto de un tensor y un vector:
Para la ecuación de difusión esta fórmula da
La matriz simétrica de los coeficientes de difusión Dij debería ser definitivo. Se necesita para que el operador lateral derecho sea elíptico.
- Para inhomogeneous anisotropic media estas dos formas de la ecuación de difusión deben combinarse en
- El enfoque basado en la movilidad de Einstein y la fórmula Teorell da la siguiente generalización de la ecuación de Fick para la Difusión multicomponente de los componentes perfectos:
Donde φi son concentraciones de los componentes y Dij es la matriz de los coeficientes. Aquí, índices i y j están relacionados con los diversos componentes y no con las coordenadas espaciales.
Las fórmulas de Chapman-Enskog para la difusión en gases incluyen exactamente los mismos términos. Estos modelos físicos de difusión son diferentes de los modelos de prueba ∂tφi</i > = Σj Dij Δφj</i > que son válidas para desviaciones muy pequeñas del equilibrio uniforme. Anteriormente, estos términos se introdujeron en la ecuación de difusión de Maxwell-Stefan.
Para los coeficientes de difusión multicomponente anisotrópicos, se necesita un tensor de rango cuatro, por ejemplo Dij,αβ , donde i, j se refieren a los componentes y α, β = 1, 2, 3 corresponden a las coordenadas del espacio.
Aplicaciones
Las ecuaciones basadas en la ley de Fick se han utilizado comúnmente para modelar procesos de transporte en alimentos, neuronas, biopolímeros, productos farmacéuticos, suelos porosos, dinámica de poblaciones, materiales nucleares, física de plasma y procesos de dopaje de semiconductores. La teoría de los métodos voltamétricos se basa en las soluciones de la ecuación de Fick. Por otro lado, en algunos casos un "fickiano (otra aproximación común de la ecuación de transporte es la de la teoría de la difusión)" descripción es inadecuada. Por ejemplo, en la ciencia de los polímeros y la ciencia de los alimentos se requiere un enfoque más general para describir el transporte de componentes en materiales que experimentan una transición vítrea. Un marco general más son las ecuaciones de difusión de Maxwell-Stefan
de transferencia de masa de múltiples componentes, a partir de la cual se puede obtener la ley de Fick como caso límite, cuando la mezcla está extremadamente diluida y cada especie química interactúa solo con la mezcla a granel y no con otras especies. Para tener en cuenta la presencia de múltiples especies en una mezcla no diluida, se utilizan varias variaciones de las ecuaciones de Maxwell-Stefan. Véase también procesos de transporte acoplados no diagonales (relación de Onsager).
Flujo de fick en líquidos
Cuando dos líquidos miscibles se ponen en contacto y se produce la difusión, la concentración macroscópica (o media) evoluciona siguiendo la ley de Fick. A escala mesoscópica, es decir, entre la escala macroscópica descrita por la ley de Fick y la escala molecular, donde tienen lugar los paseos aleatorios moleculares, las fluctuaciones no pueden despreciarse. Tales situaciones se pueden modelar con éxito con la hidrodinámica fluctuante de Landau-Lifshitz. En este marco teórico, la difusión se debe a fluctuaciones cuyas dimensiones van desde la escala molecular hasta la escala macroscópica.
En particular, las ecuaciones hidrodinámicas fluctuantes incluyen un término de flujo de Fick, con un coeficiente de difusión determinado, junto con ecuaciones hidrodinámicas y términos estocásticos que describen las fluctuaciones. Al calcular las fluctuaciones con un enfoque perturbativo, la aproximación de orden cero es la ley de Fick. El primer orden da las fluctuaciones, y resulta que las fluctuaciones contribuyen a la difusión. Esto representa de alguna manera una tautología, ya que el fenómeno descrito por una aproximación de orden inferior es el resultado de una aproximación superior: este problema se resuelve solo volviendo a normalizar las ecuaciones hidrodinámicas fluctuantes.
Tasa de sorción y frecuencia de colisión de soluto diluido
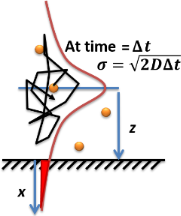
Esquema de difusión molecular en la solución. Los puntos naranjas son moléculas de soluto, las moléculas de disolvente no se dibujan, la flecha negra es un ejemplo de recorrido aleatorio, y la curva roja es la función de probabilidad difusiva Gausiana ampliada de la ley de difusión de la Fick.:Fig. 9
La tasa de adsorción o absorción de un soluto diluido en una superficie o interfaz en una solución (gas o líquido) se puede calcular utilizando las leyes de difusión de Fick. El número acumulado de moléculas adsorbidas en la superficie se expresa mediante la ecuación de Langmuir-Schaefer en el límite de tiempo corto integrando la ecuación del flujo de difusión en el tiempo:
-
es el número de moléculas en unidad # moléculas adsorbidas durante el tiempo
.
- A es la superficie de la unidad
.
- C es la concentración número de las moléculas de adsorber en la solución de vracs en unidad # moléculas/
.
- D es coeficiente de difusión del adsorber en unidad
.
- t es el tiempo transcurrido en la unidad
.
La ecuación lleva el nombre de los químicos estadounidenses Irving Langmuir y Vincent Schaefer.
La ecuación de Langmuir-Schaefer se puede extender a la ecuación de Ward-Tordai para tener en cuenta la "retrodifusión" de moléculas rechazadas de la superficie:
Donde
C{displaystyle C}
es la concentración de vracs,
Cb{displaystyle C_{b}
es la concentración sub-superficie (que es una función del tiempo dependiendo del modelo de reacción de la adsorción), y
τ τ {displaystyle tau }
es una variable muñeca.
Las simulaciones de Monte Carlo muestran que estas dos ecuaciones funcionan para predecir la tasa de adsorción de los sistemas que forman gradientes de concentración predecibles cerca de la superficie, pero tienen problemas para los sistemas sin o con gradientes de concentración impredecibles, como los sistemas típicos de biodetección o cuando el flujo y la convección son importante.
En la figura de la derecha se muestra una breve historia de la adsorción por difusión. Un desafío notable para comprender la adsorción difusiva a nivel de una sola molécula es la naturaleza fractal de la difusión. La mayoría de las simulaciones por computadora eligen un paso de tiempo para la difusión que ignora el hecho de que hay eventos de difusión más finos (fractales) auto-similares dentro de cada paso. La simulación de la difusión fractal muestra que se debe introducir un factor de dos correcciones para el resultado de una simulación de adsorción de paso de tiempo fijo, lo que lo hace consistente con las dos ecuaciones anteriores.
En el límite de tiempo ultracorto, en el orden del tiempo de difusión a2/D, donde a</i > es el radio de la partícula, la difusión se describe mediante la ecuación de Langevin. En un tiempo más largo, la ecuación de Langevin se fusiona con la ecuación de Stokes-Einstein. Este último es apropiado para la condición de la solución diluida, donde se considera la difusión de largo alcance. De acuerdo con el teorema de fluctuación-disipación basado en la ecuación de Langevin en el límite de tiempo largo y cuando la partícula es significativamente más densa que el fluido circundante, la constante de difusión dependiente del tiempo es:
dónde (todo en unidades SI)
- kB Es la constante de Boltzmann.
- T es la temperatura absoluta.
- μ es la movilidad de la partícula en el fluido o gas, que se puede calcular utilizando la relación de Einstein (teoría cinética).
- m es la masa de la partícula.
- t es hora.
Para una sola molécula, como moléculas orgánicas o biomoléculas (por ejemplo, proteínas) en agua, el término exponencial es insignificante debido al pequeño producto de mμ en la región de picosegundos.
Cuando el área de interés es el tamaño de una molécula (específicamente, una molécula cilíndrica larga como el ADN), la ecuación de tasa de adsorción representa la frecuencia de colisión de dos moléculas en una solución diluida, con una molécula un lado específico y la otra sin dependencia estérica, es decir, una molécula (orientación aleatoria) choca de un lado a otro. La constante de difusión debe actualizarse a la constante de difusión relativa entre dos moléculas en difusión. Esta estimación es especialmente útil para estudiar la interacción entre una molécula pequeña y una molécula más grande, como una proteína. La constante de difusión efectiva está dominada por la más pequeña cuya constante de difusión se puede usar en su lugar.
La ecuación de la tasa de aciertos anterior también es útil para predecir la cinética del autoensamblaje molecular en una superficie. Las moléculas se orientan aleatoriamente en la solución a granel. Suponiendo que 1/6 de las moléculas tiene la orientación correcta en los sitios de unión de la superficie, es decir, 1/2 de la dirección z en las tres dimensiones x, y, z, por lo tanto, la concentración de interés es solo 1/6 de la concentración total. Ponga este valor en la ecuación para poder calcular la curva cinética de adsorción teórica utilizando el modelo de adsorción de Langmuir. En una imagen más rígida, 1/6 puede reemplazarse por el factor estérico de la geometría de unión.
Perspectiva biológica
La primera ley da lugar a la siguiente fórmula:
en el que
- P es la permeabilidad, una membrana experimentalmente determinada "conductancia" para un gas dado a una temperatura determinada.
- c2 − c1 es la diferencia en la concentración del gas a través de la membrana para la dirección del flujo (desde c1 a c2).
La primera ley de Fick también es importante en las ecuaciones de transferencia de radiación. Sin embargo, en este contexto, se vuelve impreciso cuando la constante de difusión es baja y la radiación se ve limitada por la velocidad de la luz en lugar de por la resistencia del material a través del cual fluye la radiación. En esta situación, se puede utilizar un limitador de flujo.
La tasa de intercambio de un gas a través de una membrana fluida se puede determinar usando esta ley junto con la ley de Graham.
Bajo la condición de una solución diluida cuando la difusión toma el control, la permeabilidad de la membrana mencionada en la sección anterior puede calcularse teóricamente para el soluto usando la ecuación mencionada en la última sección (usar con especial cuidado porque la ecuación se deriva para densidades solutos, mientras que las moléculas biológicas no son más densas que el agua):
dónde
-
es el área total de los poros en la membrana (unidad m2).
-
eficiencia transmembrana (sin unidad), que se puede calcular a partir de la teoría estocástica de la cromatografía.
- D es la constante de difusión de la unidad de soluto m2s−1.
- t es la unidad de tiempo s.
- c2, c1 concentración debe utilizar la unidad mol m−3, así que la unidad de flujo se convierte en mol s−1.
El flujo se descompone sobre la raíz cuadrada del tiempo porque se acumula un gradiente de concentración cerca de la membrana con el tiempo en condiciones ideales. Cuando hay flujo y convección, el flujo puede ser significativamente diferente de lo que predice la ecuación y mostrar un tiempo efectivo t con un valor fijo, lo que hace que el flujo sea estable en lugar de decaer con el tiempo. Esta estrategia se adopta en biología como la circulación sanguínea.
Aplicaciones de fabricación de semiconductores
El semiconductor es un término colectivo para una serie de dispositivos. Incluye principalmente tres categorías: dispositivos de dos terminales, dispositivos de tres terminales y dispositivos de cuatro terminales. La combinación de los semiconductores se llama circuito integrado.
La relación entre la ley de Fick y los semiconductores: el principio del semiconductor es transferir sustancias químicas o dopantes de una capa a otra. La ley de Fick se puede usar para controlar y predecir la difusión sabiendo cuánto se mueve la concentración de los dopantes o químicos por metro y segundo a través de las matemáticas.
Por lo tanto, se pueden fabricar diferentes tipos y niveles de semiconductores.
Las tecnologías de fabricación de circuitos integrados, procesos modelo como CVD, oxidación térmica, oxidación húmeda, dopaje, etc. utilizan ecuaciones de difusión obtenidas de la ley de Fick.
Método CVD para fabricar semiconductores
La oblea es un tipo de semiconductor cuyo sustrato de silicio está recubierto con una capa de cadenas y películas de polímero creadas por CVD. Esta película contiene dopantes de tipo n y de tipo p y asume la responsabilidad de las conducciones de dopantes. El principio de CVD se basa en la fase gaseosa y la reacción química gas-sólido para crear películas delgadas.
El régimen de flujo viscoso de CVD está impulsado por un gradiente de presión. CVD también incluye un componente de difusión distinto de la difusión superficial de adatoms. En CVD, los reactivos y productos también deben difundirse a través de una capa límite de gas estancado que existe junto al sustrato. El número total de pasos necesarios para el crecimiento de la película de CVD son la difusión en fase gaseosa de los reactivos a través de la capa límite, la adsorción y la difusión superficial de los átomos, las reacciones en el sustrato y la difusión en fase gaseosa de los productos a través de la capa límite.
El perfil de velocidad para el flujo de gas es:
-
es el espesor
-
es el número Reynolds
- x es la longitud del subtrato.
- v = 0 en cualquier superficie
-
es viscosidad
-
es densidad.
Integrado el x de 0 a L, da el grosor promedio:
Para mantener la reacción equilibrada, los reactivos deben difundirse a través de la capa límite estancada para llegar al sustrato. Por lo tanto, es deseable una capa límite delgada. De acuerdo con las ecuaciones, aumentar vo daría como resultado más reactivos desperdiciados. Los reactivos no llegarán uniformemente al sustrato si el flujo se vuelve turbulento. Otra opción es cambiar a un nuevo gas portador con menor viscosidad o densidad.
La primera ley de Fick describe la difusión a través de la capa límite. En función de la presión (P) y la temperatura (T) en un gas, se determina la difusión.
-
es la presión estándar.
-
es la temperatura estándar.
-
es la difusión estándar.
La ecuación dice que aumentar la temperatura o disminuir la presión puede aumentar la difusividad.
La primera ley de Fick predice el flujo de los reactivos al sustrato y el producto alejándose del sustrato:
-
es el espesor
-
es la concentración del primer reaccionario.
En la ley de gas ideal
PV=nRT{displaystyle PV=nRT
, la concentración del gas se expresa por presión parcial.
-
es la constante de gas.
-
es el gradiente de presión parcial.
Como resultado, la primera ley de Fick nos dice que podemos usar un gradiente de presión parcial para controlar la difusividad y controlar el crecimiento de películas delgadas de semiconductores.
En muchas situaciones realistas, la simple ley de Fick no es una formulación adecuada para el problema de los semiconductores. Solo se aplica a ciertas condiciones, por ejemplo, dadas las condiciones límite del semiconductor: difusión de concentración de fuente constante, concentración de fuente limitada o difusión de límite móvil (donde la profundidad de la unión sigue moviéndose hacia el sustrato).
Producción y cocina de alimentos
La formulación de la primera ley de Fick puede explicar una variedad de fenómenos complejos en el contexto de los alimentos y la cocción: la difusión de moléculas como el etileno promueve el crecimiento y la maduración de las plantas, las moléculas de sal y azúcar promueven el salado y el marinado de la carne, y las moléculas de agua promueven la deshidratación. La primera ley de Fick también se puede utilizar para predecir los perfiles de humedad cambiantes en un fideo de espagueti a medida que se hidrata durante la cocción. Estos fenómenos tienen que ver con el movimiento espontáneo de partículas de solutos impulsado por el gradiente de concentración. En diferentes situaciones, hay diferente difusividad que es una constante.
Al controlar el gradiente de concentración, se puede controlar el tiempo de cocción, la forma de los alimentos y la salazón.
Referencias generales y citadas
- Smith, W. F. (2004). Foundations of Materials Science and Engineering (3a edición). McGraw-Hill.
- Berg, H. C. (1977). Paseos aleatorios en Biología. Princeton.
- Bird, R. B.; Stewart, W. E.; Lightfoot, E. N. (1976). Transport Phenomena. John Wiley & Sons.
- Crank, J. (1980). Las Matemáticas de la Difusión. Oxford University Press.
- Bokshtein, B. S.; Mendelev, M. I.; Srolovitz, D. J., eds. (2005). Termodinámica y Kinética en Materiales Ciencia: Un curso corto. Oxford: Oxford University Press. pp. 167–171.
- Fick, A. (1855). "En la difusión líquida". Annalen der Physik und Chemie. 94: 59. – reimpresión en Fick, Adolph (1995). "En la difusión líquida". Journal of Membrane Science. 100: 33–38. doi:10.1016/0376-7388(94)00230-v.
Contenido relacionado
Miscibilidad
Ley de las proporciones múltiples
Agente reductor



 está fuera del operador de gradiente. Esto es porque:
está fuera del operador de gradiente. Esto es porque:


 tiene unidades Pa.
tiene unidades Pa. o líquido
o líquido fase. En el equilibrio líquido de vapor el flujo de evaporación es cero porque
fase. En el equilibrio líquido de vapor el flujo de evaporación es cero porque .
.

 , esto reduce a la forma más común de la ley de Fick,
, esto reduce a la forma más común de la ley de Fick,

 es la fracción mole de la especie
es la fracción mole de la especie 

 con coeficiente de difusión
con coeficiente de difusión :
:









![{displaystyle n(x,t)=n_{0}left[1-2left({frac {x}{2{sqrt {Dtpi }}}}right)right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2cb41fde1bd0ade9d556ce64b8e96299081ce07b)


 es la dimensión del movimiento Brownian de la partícula. Por ejemplo, la difusión de una molécula a través de una membrana celular 8 nm de espesor es una difusión 1-D debido a la simetría esférica; Sin embargo, la difusión de una molécula de la membrana al centro de una célula eucariota es una difusión 3-D. Para un cactus cilíndrico, la difusión de células fotosintéticas en su superficie a su centro (el eje de su simetría cilíndrica) es una difusión 2-D.
es la dimensión del movimiento Brownian de la partícula. Por ejemplo, la difusión de una molécula a través de una membrana celular 8 nm de espesor es una difusión 1-D debido a la simetría esférica; Sin embargo, la difusión de una molécula de la membrana al centro de una célula eucariota es una difusión 3-D. Para un cactus cilíndrico, la difusión de células fotosintéticas en su superficie a su centro (el eje de su simetría cilíndrica) es una difusión 2-D. , se utiliza a menudo como una caracterización de cuán lejos ha movido la partícula después del tiempo
, se utiliza a menudo como una caracterización de cuán lejos ha movido la partícula después del tiempo ha pasado. El MSD se distribuye simétricamente en el espacio 1D, 2D y 3D. Así, la distribución de probabilidad de la magnitud de MSD en 1D es Gaussian y 3D es una distribución Maxwell-Boltzmann.
ha pasado. El MSD se distribuye simétricamente en el espacio 1D, 2D y 3D. Así, la distribución de probabilidad de la magnitud de MSD en 1D es Gaussian y 3D es una distribución Maxwell-Boltzmann.












 es la concentración de vracs,
es la concentración de vracs, es la concentración sub-superficie (que es una función del tiempo dependiendo del modelo de reacción de la adsorción), y
es la concentración sub-superficie (que es una función del tiempo dependiendo del modelo de reacción de la adsorción), y es una variable muñeca.
es una variable muñeca.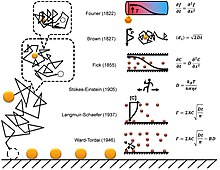

















 , la concentración del gas se expresa por presión parcial.
, la concentración del gas se expresa por presión parcial.

