Ley de las proporciones múltiples
La ley de las proporciones múltiples es un principio fundamental de la química, que establece que cuando dos elementos forman más de un compuesto, las masas variables del segundo elemento que se combinan con una masa fija del primero, mantienen una correlación entre sí de números enteros pequeños. Esta ley fue descubierta y formulada por John Dalton, por lo que también es conocida como la Ley de Dalton.
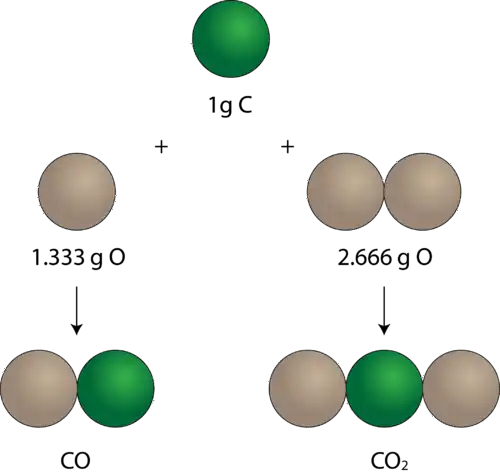
Tomemos como ejemplo el carbono y su capacidad para formar distintos óxidos con el oxígeno. Si combinamos 100 gramos de carbono con oxígeno, encontramos que puede reaccionar con 133 gramos de oxígeno para formar un óxido (monóxido de carbono, CO), o con 266 gramos para formar otro (dióxido de carbono, CO2). La proporción entre las masas de oxígeno que reaccionan con una cantidad fija de carbono es de 266:133, es decir, 2:1, cumpliendo así con la ley de las proporciones múltiples.
Dalton presentó esta ley en 1804, apoyándose en los estudios científicos de los químicos que le precedieron. Joseph Proust había propuesto la ley de las proporciones definidas, que afirmaba que los elementos se combinan en proporciones fijas y no de manera aleatoria. Y Antoine Lavoisier había demostrado la ley de conservación de la masa. Estas investigaciones fueron cruciales para que Dalton propusiera su ley de las proporciones múltiples, y luego su teoría atómica, sentando las bases para las fórmulas químicas de los compuestos y la notación química moderna.
Otro ejemplo de esta ley se observa al comparar los compuestos etano (C2H6) y propano (C3H8). Al analizar la cantidad de hidrógeno que se combina con 1 gramo de carbono, encontramos 0,252 gramos en el etano y 0,224 gramos en el propano. La relación de estas masas es de 1,125, que también se puede expresar como la relación de dos números enteros pequeños 9:8.
La importancia de la ley de las proporciones múltiples radica en que permitió el desarrollo de la actual teoría atómica y la comprensión de cómo los elementos se combinaban para formar compuestos.
HSD
Limitaciones
La ley de las proporciones múltiples se demuestra mejor usando compuestos simples. Por ejemplo, si se intentara demostrarlo utilizando los hidrocarburos decano (fórmula química C10H22) y undecano (C11H24), uno encontraría que 100 gramos de carbono podrían reaccionar con 18,46 gramos de hidrógeno para producir decano o con 18,31 gramos de hidrógeno para producir undecano, para una relación de masas de hidrógeno de 121:120, que es apenas una proporción de "pequeño" números enteros
La ley falla con compuestos no estequiométricos y tampoco funciona bien con polímeros y oligómeros.
Historia
La ley de las proporciones múltiples fue una prueba clave de la teoría atómica, pero no está claro si Dalton descubrió la ley de las proporciones múltiples por accidente y luego usó la teoría atómica para explicarla, o si su ley fue una hipótesis que propuso en para investigar la validez de la teoría atómica.
En 1792, Bertrand Pelletier descubrió que cierta cantidad de estaño se combina con cierta cantidad de oxígeno para formar un óxido de estaño, o el doble de oxígeno para formar un óxido diferente. Joseph Proust confirmó el descubrimiento de Pelletier y proporcionó medidas de la composición: un óxido de estaño tiene 87 partes de estaño y 13 partes de oxígeno, y el otro tiene 78,4 partes de estaño y 21,6 partes de oxígeno. Probablemente se trataba de óxido de estaño (II) (SnO) y dióxido de estaño (SnO2), y sus composiciones reales son 88,1 % de estaño, 11,9 % de oxígeno y 78,7 % de estaño, 21,3 % de oxígeno.
Los académicos que han revisado los escritos de Proust descubrieron que tenía suficientes datos para haber descubierto la ley de las proporciones múltiples por sí mismo, pero de alguna manera no lo hizo. Con respecto a los óxidos de estaño antes mencionados, si Proust hubiera ajustado sus cifras para un contenido de estaño de 100 partes para ambos óxidos, habría notado que 100 partes de estaño se combinarán con 14,9 o 27,6 partes de oxígeno. 14,9 y 27,6 forman una relación de 1:1,85, que es 1:2 si se perdona el error experimental. Parece que esto no se le ocurrió a Proust, pero se le ocurrió a Dalton.