Euglena
Euglena es un género de eucariotas flagelados unicelulares. Es el miembro más conocido y estudiado de la clase Euglenoidea, un grupo diverso que contiene... (leer más)
La electroforesis en gel de agarosa es un método de electroforesis en gel utilizado en bioquímica, biología molecular, genética y química clínica para separar una población mixta de macromoléculas como ADN o proteínas en una matriz de agarosa, una de los dos componentes principales del agar. Las proteínas pueden separarse por carga y/o tamaño (la electroforesis en agarosa con enfoque isoeléctrico es esencialmente independiente del tamaño) y los fragmentos de ADN y ARN por longitud. Las biomoléculas se separan aplicando un campo eléctrico para mover las moléculas cargadas a través de una matriz de agarosa, y las biomoléculas se separan por tamaño en la matriz de gel de agarosa.
El gel de agarosa es fácil de moldear, tiene relativamente menos grupos cargados y es particularmente adecuado para separar el ADN del rango de tamaño que se encuentra con mayor frecuencia en los laboratorios, lo que explica la popularidad de su uso. El ADN separado se puede ver con tinción, más comúnmente bajo luz ultravioleta, y los fragmentos de ADN se pueden extraer del gel con relativa facilidad. La mayoría de los geles de agarosa utilizados se disuelven entre un 0,7 y un 2 % en un tampón de electroforesis adecuado.
El gel de agarosa es una matriz tridimensional formada por moléculas de agarosa helicoidales en haces superenrollados que se agregan en estructuras tridimensionales con canales y poros a través de los cuales pueden pasar las biomoléculas. La estructura tridimensional se mantiene unida con enlaces de hidrógeno y, por lo tanto, puede romperse calentándola de nuevo a un estado líquido. La temperatura de fusión es diferente de la temperatura de gelificación, dependiendo de las fuentes, el gel de agarosa tiene una temperatura de gelificación de 35 a 42 °C y una temperatura de fusión de 85 a 95 °C. También están disponibles agarosas de bajo punto de fusión y baja gelificación fabricadas mediante modificaciones químicas.
El gel de agarosa tiene un gran tamaño de poro y una buena fuerza de gel, lo que lo hace adecuado como medio anticonvección para la electroforesis de ADN y moléculas de proteínas grandes. El tamaño de poro de un gel al 1 % se ha estimado entre 100 nm y 200–500 nm, y su fuerza de gel permite que los geles diluidos hasta al 0,15 % formen una losa para la electroforesis en gel. Sin embargo, los geles de baja concentración (0,1–0,2 %) son frágiles y, por lo tanto, difíciles de manipular. El gel de agarosa tiene un poder de resolución más bajo que el gel de poliacrilamida para el ADN, pero tiene un mayor rango de separación y, por lo tanto, se usa para fragmentos de ADN de un tamaño generalmente de 50 a 20 000 pb. El límite de resolución para la electroforesis en gel de agarosa estándar es de alrededor de 750 kb, pero es posible una resolución de más de 6 Mb con electroforesis en gel de campo pulsado (PFGE). También se puede utilizar para separar proteínas grandes y es la matriz preferida para la electroforesis en gel de partículas con radios efectivos superiores a 5-10 nm. Un gel de agarosa al 0,9% tiene poros lo suficientemente grandes para la entrada del bacteriófago T4.
El polímero de agarosa contiene grupos cargados, en particular piruvato y sulfato. Estos grupos cargados negativamente crean un flujo de agua en la dirección opuesta al movimiento del ADN en un proceso llamado electroendosmosis (EEO) y, por lo tanto, pueden retardar el movimiento del ADN y hacer que las bandas se vuelvan borrosas. Los geles de mayor concentración tendrían un mayor flujo electroendosmótico. Por lo tanto, generalmente se prefiere la agarosa con bajo contenido de EEO para su uso en la electroforesis de ácidos nucleicos en gel de agarosa, pero la agarosa con alto contenido de EEO puede usarse para otros fines. El menor contenido de sulfato de la agarosa de bajo EEO, particularmente la agarosa de bajo punto de fusión (LMP), también es beneficioso en los casos en que el ADN extraído del gel se va a utilizar para una manipulación posterior, ya que la presencia de sulfatos contaminantes puede afectar algunos procedimientos posteriores, como como ligadura y PCR. Sin embargo, las agarosas con cero EEO no son deseables para algunas aplicaciones, ya que pueden fabricarse agregando grupos cargados positivamente y dichos grupos pueden afectar las reacciones enzimáticas posteriores. La electroendosmosis es una de las razones por las que se usa la agarosa con preferencia al agar, ya que el componente de agaropectina en el agar contiene una cantidad significativa de grupos sulfato y carboxilo cargados negativamente. La eliminación de agaropectina en agarosa reduce sustancialmente la EEO, así como también reduce la adsorción no específica de biomoléculas a la matriz del gel. Sin embargo, para algunas aplicaciones, como la electroforesis de proteínas séricas, puede ser deseable un EEO alto y se puede agregar agaropectina en el gel utilizado.
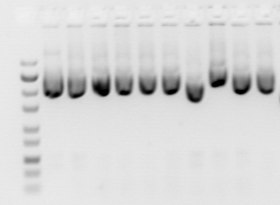
Varios factores pueden afectar la migración de los ácidos nucleicos: la dimensión de los poros del gel (concentración del gel), el tamaño del ADN sometido a electroforesis, el voltaje utilizado, la fuerza iónica del tampón y la concentración del colorante intercalado como como bromuro de etidio si se usa durante la electroforesis.
Las moléculas más pequeñas viajan más rápido que las moléculas más grandes en el gel, y el ADN de doble cadena se mueve a una velocidad inversamente proporcional al logaritmo del número de pares de bases. Sin embargo, esta relación se rompe con fragmentos de ADN muy grandes, y la separación de fragmentos de ADN muy grandes requiere el uso de electroforesis en gel de campo pulsado (PFGE), que aplica corriente alterna desde diferentes direcciones y los fragmentos de ADN grandes se separan a medida que se reorientan con el cambiando de campo.
Para la electroforesis en gel de agarosa estándar, las moléculas más grandes se resuelven mejor con un gel de baja concentración, mientras que las moléculas más pequeñas se separan mejor con un gel de alta concentración. Sin embargo, los geles de mayor concentración requieren tiempos de ejecución más prolongados (a veces días).
El movimiento del ADN puede verse afectado por la conformación de la molécula de ADN, por ejemplo, el ADN superenrollado generalmente se mueve más rápido que el ADN relajado porque está muy enrollado y, por lo tanto, es más compacto. En una preparación de ADN plasmídico normal, pueden estar presentes múltiples formas de ADN. La electroforesis en gel de los plásmidos normalmente mostraría la forma superenrollada negativamente como la banda principal, mientras que el ADN cortado (forma circular abierta) y la forma circular cerrada relajada aparecen como bandas secundarias. Sin embargo, la velocidad a la que se mueven las diversas formas puede cambiar usando diferentes condiciones de electroforesis, y la movilidad del ADN circular más grande puede verse más afectada que el ADN lineal por el tamaño de los poros del gel.
El bromuro de etidio que se intercala en el ADN circular puede cambiar la carga, la longitud y la superhelicidad de la molécula de ADN, por lo que su presencia en el gel durante la electroforesis puede afectar su movimiento. Por ejemplo, la carga positiva del bromuro de etidio puede reducir el movimiento del ADN en un 15 %. La electroforesis en gel de agarosa se puede utilizar para resolver el ADN circular con una topología de superenrollamiento diferente.
El daño al ADN debido al aumento de la reticulación también reducirá la migración electroforética del ADN de forma dependiente de la dosis.
La velocidad de migración del ADN es proporcional al voltaje aplicado, es decir, cuanto mayor sea el voltaje, más rápido se mueve el ADN. Sin embargo, la resolución de grandes fragmentos de ADN es menor a alto voltaje. La movilidad del ADN también puede cambiar en un campo inestable: en un campo que se invierte periódicamente, la movilidad del ADN de un tamaño particular puede disminuir significativamente en una frecuencia de ciclo particular. Este fenómeno puede dar como resultado una inversión de banda en la electroforesis en gel de inversión de campo (FIGE), en la que los fragmentos de ADN más grandes se mueven más rápido que los más pequeños.
La carga negativa de su columna vertebral de fosfato mueve el ADN hacia el ánodo cargado positivamente durante la electroforesis. Sin embargo, la migración de moléculas de ADN en solución, en ausencia de una matriz de gel, es independiente del peso molecular durante la electroforesis. Por lo tanto, la matriz de gel es responsable de la separación del ADN por tamaño durante la electroforesis, y existen varios modelos para explicar el mecanismo de separación de biomoléculas en la matriz de gel. Uno ampliamente aceptado es el modelo de Ogston que trata la matriz polimérica como un tamiz. Una proteína globular o un ADN en espiral aleatoria se mueve a través de los poros interconectados, y es más probable que el movimiento de moléculas más grandes se vea obstaculizado y ralentizado por las colisiones con la matriz del gel y, por lo tanto, las moléculas de diferentes tamaños pueden separarse en este proceso de tamizado..
Sin embargo, el modelo de Ogston se descompone para moléculas grandes en las que los poros son significativamente más pequeños que el tamaño de la molécula. Para moléculas de ADN de tamaño superior a 1 kb, se usa más comúnmente un modelo de reptación (o sus variantes). Este modelo asume que el ADN puede arrastrarse en forma de "serpiente" forma (de ahí "reptación") a través de los poros como una molécula alargada. Un modelo de repetición sesgado se aplica a una intensidad de campo eléctrico más alta, por lo que el extremo delantero de la molécula se sesga fuertemente en la dirección de avance y tira del resto de la molécula. Sin embargo, la microscopía de fluorescencia en tiempo real de las moléculas teñidas mostró una dinámica más sutil durante la electroforesis, con el ADN mostrando una elasticidad considerable a medida que se estira alternativamente en la dirección del campo aplicado y luego se contrae en una bola o se engancha en forma de U. cuando queda atrapado en las fibras de polímero.
Los detalles de un experimento de electroforesis en gel de agarosa pueden variar según los métodos, pero la mayoría sigue un procedimiento general.
El gel se prepara disolviendo el polvo de agarosa en un tampón apropiado, como TAE o TBE, para usar en electroforesis. La agarosa se dispersa en el tampón antes de calentarla hasta casi el punto de ebullición, pero evite que hierva. Se permite que la agarosa derretida se enfríe lo suficiente antes de verter la solución en un molde, ya que el molde puede deformarse o agrietarse si la solución de agarosa está demasiado caliente. Se coloca un peine en el modelo para crear pozos para cargar la muestra y el gel debe estar completamente fraguado antes de su uso.
La concentración de gel afecta la resolución de la separación de ADN. El gel de agarosa está compuesto de poros microscópicos a través de los cuales viajan las moléculas, y existe una relación inversa entre el tamaño del poro del gel de agarosa y la concentración: el tamaño del poro disminuye a medida que aumenta la densidad de las fibras de agarosa. Una alta concentración de gel mejora la separación de moléculas de ADN más pequeñas, mientras que una concentración de gel más baja permite separar moléculas de ADN grandes. El proceso permite separar fragmentos que van desde 50 pares de bases hasta varias megabases dependiendo de la concentración de gel utilizada. La concentración se mide en peso de agarosa sobre el volumen de tampón utilizado (g/ml). Para una electroforesis en gel de agarosa estándar, un gel al 0,8 % brinda una buena separación o resolución de fragmentos grandes de ADN de 5 a 10 kb, mientras que un gel al 2 % brinda una buena resolución para fragmentos pequeños de 0,2 a 1 kb. Los geles al 1% se utilizan a menudo para una electroforesis estándar. Los geles de alto porcentaje suelen ser quebradizos y es posible que no fragüen uniformemente, mientras que los geles de bajo porcentaje (0,1-0,2 %) son frágiles y difíciles de manipular. Los geles de agarosa de bajo punto de fusión (LMP) también son más frágiles que los geles de agarosa normales. La agarosa de bajo punto de fusión puede usarse sola o simultáneamente con agarosa estándar para la separación y el aislamiento del ADN. PFGE y FIGE a menudo se realizan con geles de agarosa de alto porcentaje.
Una vez que el gel ha fraguado, se retira el peine, dejando pocillos donde se pueden cargar las muestras de ADN. El tampón de carga se mezcla con la muestra de ADN antes de cargar la mezcla en los pocillos. El tampón de carga contiene un compuesto denso, que puede ser glicerol, sacarosa o Ficoll, que aumenta la densidad de la muestra para que la muestra de ADN pueda hundirse hasta el fondo del pozo. Si la muestra de ADN contiene etanol residual después de su preparación, puede flotar fuera del pocillo. El tampón de carga también incluye colorantes de colores como cianol de xileno y azul de bromofenol que se utilizan para controlar el progreso de la electroforesis. Las muestras de ADN se cargan con una pipeta.
La electroforesis en gel de agarosa se realiza normalmente de forma horizontal en un modo subacuático en el que el gel de placa se sumerge completamente en el tampón durante la electroforesis. También es posible, pero menos común, realizar la electroforesis verticalmente, así como horizontalmente con el gel levantado sobre patas de agarosa usando un aparato apropiado. El tampón utilizado en el gel es el mismo que el tampón de funcionamiento en el tanque de electroforesis, por lo que la electroforesis en modo subacuático es posible con gel de agarosa.
Para una resolución óptima de ADN superior a 2 kb de tamaño en electroforesis en gel estándar, se recomienda de 5 a 8 V/cm (la distancia en cm se refiere a la distancia entre electrodos, por lo tanto este voltaje recomendado sería de 5 a 8 multiplicado por la distancia entre los electrodos en cm). El voltaje también puede estar limitado por el hecho de que calienta el gel y puede hacer que el gel se derrita si se ejecuta a alto voltaje durante un período prolongado, especialmente si el gel utilizado es gel de agarosa LMP. Un voltaje demasiado alto también puede reducir la resolución, además de causar rayas en las bandas de las moléculas de ADN grandes. Un voltaje demasiado bajo puede conducir a la ampliación de la banda para pequeños fragmentos de ADN debido a la dispersión y difusión.
Dado que el ADN no es visible a la luz natural, el progreso de la electroforesis se controla mediante colorantes de colores. El cianol de xileno (color azul claro) comigra fragmentos grandes de ADN, mientras que el azul de bromofenol (azul oscuro) comigra con los fragmentos más pequeños. Los tintes que se usan con menos frecuencia incluyen Cresol Red y Orange G, que migran antes que el azul de bromofenol. También se ejecuta un marcador de ADN para la estimación del peso molecular de los fragmentos de ADN. Tenga en cuenta, sin embargo, que el tamaño de un ADN circular como los plásmidos no se puede medir con precisión utilizando marcadores estándar a menos que se haya linealizado mediante digestión de restricción; alternativamente, se puede utilizar un marcador de ADN superenrollado.
El ADN y el ARN normalmente se visualizan mediante tinción con bromuro de etidio, que se intercala en los surcos principales del ADN y emite fluorescencia bajo la luz ultravioleta. La intercalación depende de la concentración de ADN, por lo que una banda de alta intensidad indicará una mayor cantidad de ADN en comparación con una banda de menor intensidad. El bromuro de etidio se puede agregar a la solución de agarosa antes de que gelifique, o el gel de ADN se puede teñir más tarde después de la electroforesis. No es necesario decolorar el gel, pero puede producir mejores imágenes. Hay otros métodos de tinción disponibles; algunos ejemplos son SYBR Green, GelRed, azul de metileno, azul de cresilo brillante, sulfato de azul del Nilo y violeta cristal. SYBR Green, GelRed y otros productos comerciales similares se venden como alternativas más seguras al bromuro de etidio, ya que se ha demostrado que es mutagénico en la prueba de Ames, aunque en realidad no se ha establecido la carcinogenicidad del bromuro de etidio. SYBR Green requiere el uso de un transiluminador de luz azul. El ADN teñido con cristal violeta se puede ver bajo luz natural sin el uso de un transiluminador UV, lo cual es una ventaja, sin embargo, es posible que no produzca una banda fuerte.
Cuando se tiñe con bromuro de etidio, el gel se observa con un transiluminador ultravioleta (UV). La luz ultravioleta excita los electrones dentro del anillo aromático del bromuro de etidio y, una vez que regresan al estado fundamental, se libera luz, lo que hace que el ADN y el complejo de bromuro de etidio muestren fluorescencia. Los transiluminadores estándar usan longitudes de onda de 302/312 nm (UV-B); sin embargo, la exposición del ADN a la radiación UV durante tan solo 45 segundos puede dañar el ADN y afectar los procedimientos posteriores, por ejemplo, reduciendo la eficiencia de la transformación, transcripción in vitro y PCR. Por lo tanto, la exposición del ADN a la radiación ultravioleta debe limitarse. El uso de una longitud de onda más alta de 365 nm (rango UV-A) causa menos daño al ADN pero también produce una fluorescencia mucho más débil con el bromuro de etidio. Cuando se pueden seleccionar múltiples longitudes de onda en el transiluminador, se puede usar una longitud de onda más corta para capturar imágenes, mientras que se debe usar una longitud de onda más larga si es necesario trabajar en el gel durante un período de tiempo prolongado.
El aparato transiluminador también puede contener dispositivos de captura de imágenes, como una cámara digital o polaroid, que permiten tomar o imprimir una imagen del gel.
Para la electroforesis en gel de proteínas, las bandas se pueden visualizar con tinciones de Coomassie o de plata.
Las bandas de ADN separadas se utilizan a menudo para otros procedimientos, y una banda de ADN puede cortarse del gel como una rebanada, disolverse y purificarse. Sin embargo, los contaminantes pueden afectar algunos procedimientos posteriores, como la PCR, y en algunos casos se puede preferir la agarosa de bajo punto de fusión, ya que contiene menos sulfatos que pueden afectar algunas reacciones enzimáticas. Los geles también se pueden usar para técnicas de transferencia.
En general, el amortiguador ideal debe tener buena conductividad, producir menos calor y tener una larga vida. Hay una serie de tampones que se utilizan para la electroforesis en agarosa; los comunes para ácidos nucleicos incluyen Tris/Acetato/EDTA (TAE) y Tris/Borato/EDTA (TBE). Los tampones utilizados contienen EDTA para inactivar muchas nucleasas que requieren un catión divalente para su función. El borato en el tampón TBE puede ser problemático ya que el borato puede polimerizar y/o interactuar con cis dioles como los que se encuentran en el ARN. TAE tiene la capacidad de amortiguamiento más baja, pero proporciona la mejor resolución para ADN más grande. Esto significa un voltaje más bajo y más tiempo, pero un mejor producto.
Se han propuesto muchos otros amortiguadores, p. borato de litio (LB), histidina isoeléctrica, tampones de productos combinados pK, etc.; en la mayoría de los casos, la supuesta justificación es una corriente más baja (menos calor) o movilidades de iones coincidentes, lo que conduce a una vida útil más prolongada. El tampón tris-fosfato tiene una alta capacidad de amortiguación, pero no se puede usar si el ADN extraído se va a usar en una reacción sensible al fosfato. LB es relativamente nuevo y no es eficaz para resolver fragmentos de más de 5 kpb; Sin embargo, con su baja conductividad, podría usarse un voltaje mucho más alto (hasta 35 V/cm), lo que significa un tiempo de análisis más corto para la electroforesis de rutina. Se pudo resolver una diferencia de tamaño de un par de bases tan pequeña como en gel de agarosa al 3 % con un medio de conductividad extremadamente baja (borato de litio 1 mM).
Se puede usar otro sistema tampón en aplicaciones específicas, por ejemplo, se pueden usar tampones de ácido barbitúrico-barbitúrico sódico o Tris-barbitúrico para electroforesis de proteínas en gel de agarosa, por ejemplo, en la detección de distribución anormal de proteínas.
Los geles de agarosa se moldean y manipulan fácilmente en comparación con otras matrices y los ácidos nucleicos no se alteran químicamente durante la electroforesis. Las muestras también se recuperan fácilmente. Una vez finalizado el experimento, el gel resultante se puede almacenar en una bolsa de plástico en un refrigerador.
La electroforesis se realiza en soluciones tampón para reducir los cambios de pH debido al campo eléctrico, lo cual es importante porque la carga del ADN y el ARN depende del pH, pero un funcionamiento prolongado puede agotar la capacidad tampón de la solución. Además, diferentes preparaciones de material genético pueden no migrar consistentemente entre sí, por motivos morfológicos o de otro tipo.
A mediados y finales de la década de 1960, se descubrió por primera vez que la agarosa y los geles relacionados eran matrices eficaces para la electroforesis de ADN y ARN.