Cerveza
La cerveza es una de las bebidas alcohólicas más antiguas y más consumidas del mundo, y la tercera bebida más consumida en general después del agua y el... (leer más)
El colesterol es cualquiera de una clase de ciertas moléculas orgánicas. Un colesterol es un esterol (o esteroide modificado), un tipo de lípido. El colesterol es biosintetizado por todas las células animales y es un componente estructural esencial de las membranas de las células animales. Cuando se aísla químicamente, es un sólido cristalino amarillento.
El colesterol también sirve como precursor para la biosíntesis de hormonas esteroides, ácidos biliares y vitamina D. El colesterol es el principal esterol sintetizado por todos los animales. En los vertebrados, las células hepáticas suelen producir las mayores cantidades. Está ausente entre los procariotas (bacterias y arqueas), aunque hay algunas excepciones, como Mycoplasma, que requieren colesterol para crecer.
François Poulletier de la Salle identificó por primera vez el colesterol en forma sólida en los cálculos biliares en 1769. Sin embargo, no fue hasta 1815 que el químico Michel Eugène Chevreul nombró al compuesto "colesterina".
La palabra "colesterol" proviene del griego antiguo chole- (bilis) y stereos (sólido), seguido del sufijo químico -ol para un alcohol.
El colesterol es esencial para toda la vida animal, y cada célula es capaz de sintetizarlo mediante un complejo proceso de 37 pasos. Esto comienza con la vía del mevalonato o HMG-CoA reductasa, el objetivo de las estatinas, que abarca los primeros 18 pasos. A esto le siguen 19 pasos adicionales para convertir el lanosterol resultante en colesterol.
Un varón humano que pesa 68 kg (150 lb) normalmente sintetiza alrededor de 1 gramo (1000 mg) de colesterol por día, y su cuerpo contiene alrededor de 35 g, en su mayoría contenidos dentro de las membranas celulares. La ingesta dietética diaria típica de colesterol para un hombre en los Estados Unidos es de 307 mg.
La mayor parte del colesterol ingerido está esterificado, lo que hace que el intestino no lo absorba bien. El cuerpo también compensa la absorción del colesterol ingerido al reducir su propia síntesis de colesterol. Por estas razones, el colesterol en los alimentos, de siete a diez horas después de la ingestión, tiene poco o ningún efecto sobre las concentraciones de colesterol en la sangre. Sin embargo, durante las primeras siete horas después de la ingestión de colesterol, a medida que las grasas absorbidas se distribuyen por el cuerpo dentro del agua extracelular por las diversas lipoproteínas (que transportan todas las grasas en el agua fuera de las células), las concentraciones aumentan.
Las plantas producen colesterol en cantidades muy pequeñas. En grandes cantidades producen fitoesteroles, sustancias químicamente similares que pueden competir con el colesterol por la reabsorción en el tracto intestinal, reduciendo así potencialmente la reabsorción de colesterol. Cuando las células del revestimiento intestinal absorben fitoesteroles, en lugar de colesterol, por lo general excretan las moléculas de fitoesteroles de regreso al tracto GI, un importante mecanismo de protección. La ingesta de fitoesteroles naturales, que incluyen esteroles y estanoles vegetales, oscila entre ≈200-300 mg/día según los hábitos alimenticios. Se han producido dietas experimentales vegetarianas especialmente diseñadas que producen más de 700 mg/día.
El colesterol compone alrededor del 30% de todas las membranas de las células animales. Se requiere para construir y mantener las membranas y modula la fluidez de la membrana en el rango de temperaturas fisiológicas. El grupo hidroxilo de cada molécula de colesterol interactúa con las moléculas de agua que rodean la membrana, al igual que las cabezas polares de los fosfolípidos y esfingolípidos de la membrana, mientras que el esteroide voluminoso y la cadena hidrocarbonada están incrustados en la membrana, junto con la cadena de ácidos grasos no polares de la membrana. otros lípidos. A través de la interacción con las cadenas de ácidos grasos de fosfolípidos, el colesterol aumenta el empaquetamiento de la membrana, lo que altera la fluidez de la membranay mantiene la integridad de la membrana para que las células animales no necesiten construir paredes celulares (como las plantas y la mayoría de las bacterias). La membrana permanece estable y duradera sin ser rígida, lo que permite que las células animales cambien de forma y que los animales se muevan.
La estructura del anillo tetracíclico del colesterol contribuye a la fluidez de la membrana celular, ya que la molécula está en una conformación trans que hace que todo excepto la cadena lateral del colesterol sea rígido y plano. En esta función estructural, el colesterol también reduce la permeabilidad de la membrana plasmática a solutos neutros, iones de hidrógeno e iones de sodio.
El colesterol regula el proceso biológico de presentación de sustrato y las enzimas que utilizan la presentación de sustrato como mecanismo de su activación. (PLD2) es un ejemplo bien definido de una enzima activada por presentación de sustrato.La enzima está palmitoilada, lo que hace que la enzima se traslade a dominios lipídicos dependientes del colesterol, a veces denominados "balsas lipídicas". El sustrato de la fosfolipasa D es la fosfatidilcolina (PC), que es insaturada y poco abundante en las balsas lipídicas. PC se localiza en la región desordenada de la célula junto con el lípido poliinsaturado fosfatidilinositol 4,5-bisfosfato (PIP2). PLD2 tiene un dominio de enlace PIP2. Cuando aumenta la concentración de PIP2 en la membrana, PLD2 abandona los dominios dependientes del colesterol y se une a PIP2, donde luego obtiene acceso a su sustrato PC y comienza la catálisis basada en la presentación del sustrato.
El colesterol también está implicado en los procesos de señalización celular, ayudando en la formación de balsas de lípidos en la membrana plasmática, lo que acerca a las proteínas receptoras a altas concentraciones de moléculas de segundo mensajero. En múltiples capas, el colesterol y los fosfolípidos, ambos aislantes eléctricos, pueden facilitar la velocidad de transmisión de los impulsos eléctricos a lo largo del tejido nervioso. Para muchas fibras neuronales, una vaina de mielina, rica en colesterol ya que se deriva de capas compactadas de la membrana celular de Schwann, proporciona aislamiento para una conducción más eficiente de los impulsos. Se cree que la desmielinización (pérdida de algunas de estas células de Schwann) es parte de la base de la esclerosis múltiple.
El colesterol se une y afecta la activación de varios canales iónicos, como el receptor de acetilcolina nicotínico, el receptor GABA A y el canal de potasio rectificador de entrada. El colesterol también activa el receptor alfa relacionado con el estrógeno (ERRα) y puede ser el ligando endógeno del receptor. La naturaleza constitutivamente activa del receptor puede explicarse por el hecho de que el colesterol es ubicuo en el cuerpo. La inhibición de la señalización de ERRα mediante la reducción de la producción de colesterol se ha identificado como un mediador clave de los efectos de las estatinas y los bisfosfonatos en los huesos, músculos y macrófagos. Sobre la base de estos hallazgos, se ha sugerido que el ERRα debería dejarse huérfano y clasificarse como un receptor para el colesterol.
Dentro de las células, el colesterol también es una molécula precursora de varias vías bioquímicas. Por ejemplo, es la molécula precursora de la síntesis de la vitamina D en el metabolismo del calcio y de todas las hormonas esteroides, incluidas las hormonas de la glándula suprarrenal cortisol y la aldosterona, así como las hormonas sexuales progesterona, estrógenos y testosterona, y sus derivados.
El colesterol se recicla en el cuerpo. El hígado excreta colesterol en los fluidos biliares, que luego se almacenan en la vesícula biliar, que luego los excreta en forma no esterificada (a través de la bilis) en el tracto digestivo. Por lo general, alrededor del 50% del colesterol excretado es reabsorbido por el intestino delgado y regresa al torrente sanguíneo.
Todas las células animales fabrican colesterol, tanto para la estructura de la membrana como para otros usos, con tasas de producción relativas que varían según el tipo de célula y la función del órgano. Alrededor del 80% de la producción diaria total de colesterol se produce en el hígado y los intestinos; otros sitios de tasas de síntesis más altas incluyen el cerebro, las glándulas suprarrenales y los órganos reproductivos.
La síntesis dentro del cuerpo comienza con la vía del mevalonato, donde dos moléculas de acetil CoA se condensan para formar acetoacetil-CoA. A esto le sigue una segunda condensación entre acetil CoA y acetoacetil-CoA para formar 3-hidroxi-3-metilglutaril CoA (HMG-CoA).

Esta molécula luego se reduce a mevalonato por la enzima HMG-CoA reductasa. La producción de mevalonato es el paso irreversible y limitante de la velocidad en la síntesis de colesterol y es el sitio de acción de las estatinas (una clase de medicamentos para reducir el colesterol).
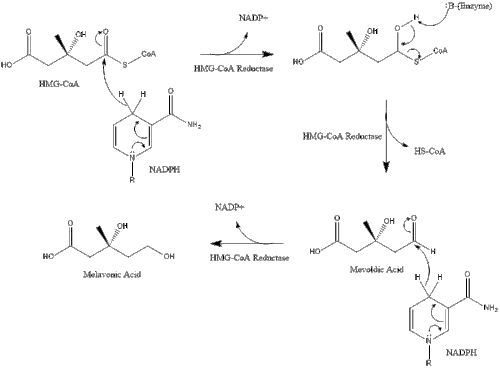
El mevalonato finalmente se convierte en pirofosfato de isopentenilo (IPP) a través de dos pasos de fosforilación y un paso de descarboxilación que requiere ATP.
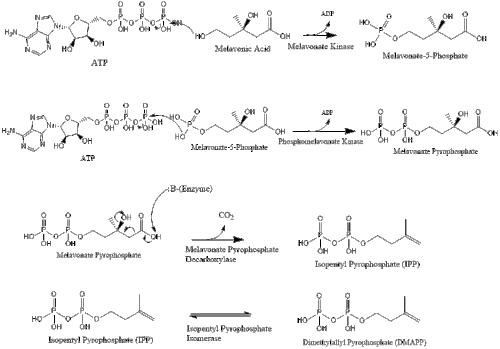
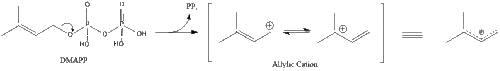
Tres moléculas de isopentenil pirofosfato se condensan para formar farnesil pirofosfato a través de la acción de la geranil transferasa.

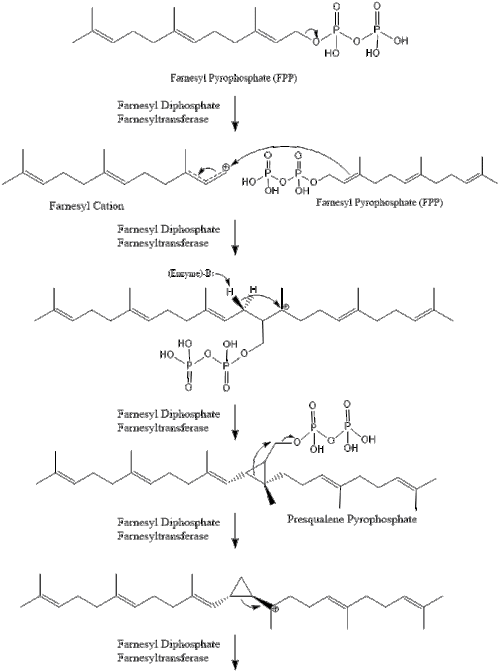
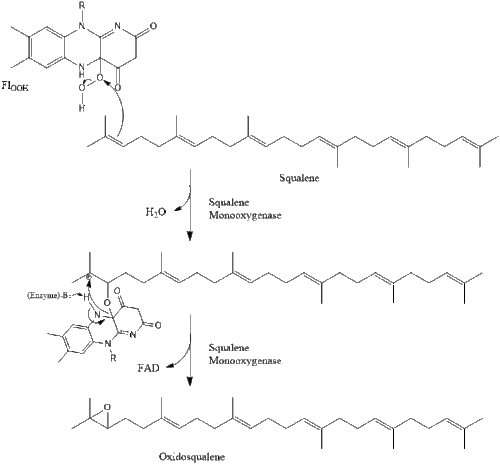
Luego, dos moléculas de pirofosfato de farnesilo se condensan para formar escualeno por la acción de la escualeno sintasa en el retículo endoplásmico.
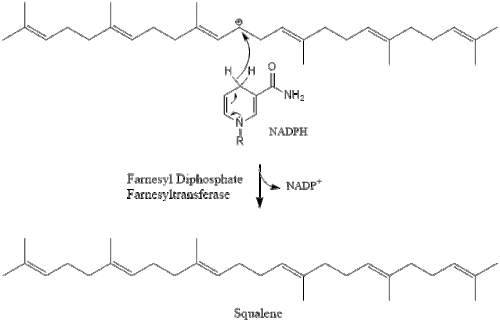
La oxidoescualeno ciclasa luego cicla el escualeno para formar lanosterol.
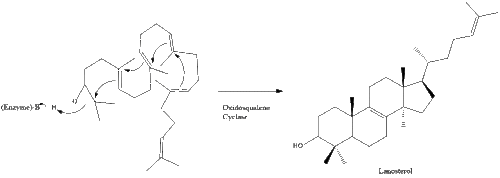
Finalmente, el lanosterol se convierte en colesterol a través de dos vías, la vía de Bloch o la vía de Kandutsch-Russell. Los 19 pasos finales para el colesterol contienen NADPH y oxígeno para ayudar a oxidar los grupos metilo para eliminar los carbonos, mutasas para mover los grupos alqueno y NADH para ayudar a reducir las cetonas.
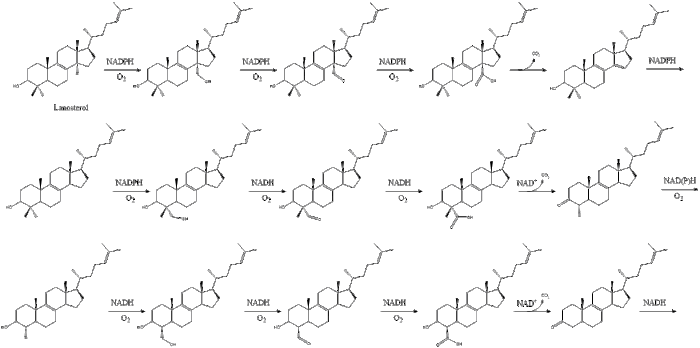

Konrad Bloch y Feodor Lynen compartieron el Premio Nobel de Fisiología o Medicina en 1964 por sus descubrimientos sobre algunos de los mecanismos y métodos de regulación del metabolismo del colesterol y los ácidos grasos.
La biosíntesis del colesterol está directamente regulada por los niveles de colesterol presentes, aunque los mecanismos homeostáticos implicados sólo se conocen en parte. Una mayor ingesta de los alimentos conduce a una disminución neta de la producción endógena, mientras que una menor ingesta de los alimentos tiene el efecto contrario. El principal mecanismo regulador es la detección del colesterol intracelular en el retículo endoplásmico por la proteína SREBP (proteína de unión a elementos reguladores de esteroles 1 y 2).En presencia de colesterol, SREBP se une a otras dos proteínas: SCAP (proteína activadora de escisión de SREBP) e INSIG-1. Cuando los niveles de colesterol caen, INSIG-1 se disocia del complejo SREBP-SCAP, lo que permite que el complejo migre al aparato de Golgi. Aquí SREBP es escindido por S1P y S2P (proteasa del sitio 1 y proteasa del sitio 2), dos enzimas que son activadas por SCAP cuando los niveles de colesterol son bajos.
El SREBP escindido luego migra al núcleo y actúa como un factor de transcripción para unirse al elemento regulador de esteroles (SRE), que estimula la transcripción de muchos genes. Entre estos se encuentran el receptor de lipoproteínas de baja densidad (LDL) y la HMG-CoA reductasa. El receptor de LDL elimina las LDL circulantes del torrente sanguíneo, mientras que la HMG-CoA reductasa conduce a un aumento de la producción endógena de colesterol. Una gran parte de esta vía de señalización fue aclarada por el Dr. Michael S. Brown y el Dr. Joseph L. Goldstein en la década de 1970. En 1985 recibieron el Premio Nobel de Fisiología o Medicina por su trabajo. Su trabajo posterior muestra cómo la vía SREBP regula la expresión de muchos genes que controlan la formación de lípidos y el metabolismo y la asignación de combustible corporal.
La síntesis de colesterol también se puede desactivar cuando los niveles de colesterol son altos. La HMG-CoA reductasa contiene un dominio citosólico (responsable de su función catalítica) y un dominio de membrana. El dominio de la membrana detecta señales para su degradación. Las concentraciones crecientes de colesterol (y otros esteroles) provocan un cambio en el estado de oligomerización de este dominio, lo que lo hace más susceptible a la destrucción por parte del proteasoma. La actividad de esta enzima también se puede reducir mediante la fosforilación por una proteína quinasa activada por AMP. Debido a que esta cinasa es activada por AMP, que se produce cuando se hidroliza ATP, se deduce que la síntesis de colesterol se detiene cuando los niveles de ATP son bajos.
Como molécula aislada, el colesterol es mínimamente soluble en agua o hidrofílico. Debido a esto, se disuelve en la sangre en concentraciones extremadamente pequeñas. Para ser transportado de manera efectiva, el colesterol se empaqueta en lipoproteínas, partículas discoidales complejas con proteínas y lípidos anfifílicos exteriores, cuyas superficies exteriores son solubles en agua y las superficies interiores son solubles en lípidos. Esto le permite viajar a través de la sangre a través de la emulsificación. El colesterol libre, al ser anfipático, se transporta en la superficie de la monocapa de la partícula de lipoproteína junto con fosfolípidos y proteínas. Los ésteres de colesterol unidos a ácidos grasos, por otro lado, se transportan dentro del núcleo hidrofóbico graso de la lipoproteína, junto con los triglicéridos.
Hay varios tipos de lipoproteínas en la sangre. En orden de densidad creciente, son quilomicrones, lipoproteínas de muy baja densidad (VLDL), lipoproteínas de densidad intermedia (IDL), lipoproteínas de baja densidad (LDL) y lipoproteínas de alta densidad (HDL). Las proporciones más bajas de proteínas/lípidos hacen que las lipoproteínas sean menos densas. El colesterol dentro de diferentes lipoproteínas es idéntico, aunque algunos se transportan en su forma de alcohol "libre" nativo (el grupo colesterol-OH frente al agua que rodea las partículas), mientras que otros como ésteres de acilo graso, conocidos también como ésteres de colesterol, dentro de las partículas.
Las partículas de lipoproteínas están organizadas por apolipoproteínas complejas, típicamente de 80 a 100 proteínas diferentes por partícula, que pueden ser reconocidas y unidas por receptores específicos en las membranas celulares, dirigiendo su carga útil de lípidos hacia células y tejidos específicos que actualmente ingieren estas partículas de transporte de grasa. Estos receptores de superficie sirven como firmas moleculares únicas, que luego ayudan a determinar la distribución de grasa en todo el cuerpo.
Los quilomicrones, las moléculas transportadoras de colesterol menos densas, contienen apolipoproteína B-48, apolipoproteína C y apolipoproteína E (el principal transportador de colesterol en el cerebro) en sus cubiertas. Los quilomicrones transportan grasas desde el intestino hasta los músculos y otros tejidos que necesitan ácidos grasos para la producción de energía o grasa. El colesterol no utilizado permanece en más restos de quilomicrones ricos en colesterol, y el hígado lo absorbe desde aquí hasta el torrente sanguíneo.
Las moléculas de VLDL son producidas por el hígado a partir de triacilglicerol y colesterol que no se utilizó en la síntesis de ácidos biliares. Estas moléculas contienen apolipoproteína B100 y apolipoproteína E en sus cubiertas, y pueden ser degradadas por la lipoproteína lipasa en la pared arterial a IDL. Esta escisión de la pared arterial permite la absorción de triacilglicerol y aumenta la concentración de colesterol circulante. Las moléculas de IDL luego se consumen en dos procesos: la mitad es metabolizada por HTGL y absorbida por el receptor de LDL en las superficies de las células hepáticas, mientras que la otra mitad continúa perdiendo triacilgliceroles en el torrente sanguíneo hasta que se convierten en partículas de LDL cargadas de colesterol.
Las partículas de LDL son los principales portadores de colesterol en la sangre. Cada uno contiene aproximadamente 1.500 moléculas de éster de colesterol. Las cubiertas de las moléculas de LDL contienen solo una molécula de apolipoproteína B100, reconocida por los receptores de LDL en los tejidos periféricos. Tras la unión de la apolipoproteína B100, muchos receptores de LDL se concentran en fosas recubiertas de clatrina. Tanto la LDL como su receptor forman vesículas dentro de una célula por endocitosis. Estas vesículas luego se fusionan con un lisosoma, donde la enzima lipasa ácida lisosomal hidroliza los ésteres de colesterol. A continuación, el colesterol se puede utilizar para la biosíntesis de membranas o esterificarse y almacenarse dentro de la célula, para que no interfiera con las membranas celulares.
Los receptores de LDL se agotan durante la absorción del colesterol, y su síntesis está regulada por SREBP, la misma proteína que controla la síntesis de colesterol de novo, según su presencia en el interior de la célula. Una célula con abundante colesterol tendrá bloqueada la síntesis de su receptor de LDL, para evitar que se absorba el nuevo colesterol en las moléculas de LDL. Por el contrario, la síntesis del receptor de LDL procede cuando una célula tiene deficiencia de colesterol.
Cuando este proceso se desregula, las moléculas de LDL sin receptores comienzan a aparecer en la sangre. Estas moléculas de LDL son oxidadas y absorbidas por los macrófagos, que se hinchan y forman células espumosas. Estas células espumosas a menudo quedan atrapadas en las paredes de los vasos sanguíneos y contribuyen a la formación de placas ateroscleróticas. Las diferencias en la homeostasis del colesterol afectan el desarrollo de la aterosclerosis temprana (grosor de la íntima-media carotídea). Estas placas son las principales causas de ataques cardíacos, derrames cerebrales y otros problemas médicos graves, lo que lleva a la asociación del llamado colesterol LDL (en realidad, una lipoproteína) con el colesterol "malo".
Se cree que las partículas de HDL transportan el colesterol de regreso al hígado, ya sea para su excreción o para otros tejidos que sintetizan hormonas, en un proceso conocido como transporte inverso de colesterol (RCT). Un gran número de partículas de HDL se correlaciona con mejores resultados de salud, mientras que un bajo número de partículas de HDL se asocia con la progresión de la enfermedad ateromatosa en las arterias.
El colesterol es susceptible a la oxidación y forma fácilmente derivados oxigenados llamados oxiesteroles. Tres mecanismos diferentes pueden formarlos: autooxidación, oxidación secundaria a la peroxidación de lípidos y oxidación de enzimas metabolizadoras de colesterol. Surgió un gran interés en los oxiesteroles cuando se demostró que ejercían acciones inhibitorias sobre la biosíntesis del colesterol. Este hallazgo se conoció como la "hipótesis del oxisterol". Las funciones adicionales de los oxiesteroles en la fisiología humana incluyen su participación en la biosíntesis de ácidos biliares, su función como formas de transporte de colesterol y la regulación de la transcripción de genes.
En experimentos bioquímicos se utilizan formas de colesterol radiomarcadas, como el colesterol tritiado. Estos derivados sufren degradación durante el almacenamiento y es fundamental depurar el colesterol antes de su uso. El colesterol se puede purificar utilizando columnas pequeñas Sephadex LH-20.
El hígado oxida el colesterol en una variedad de ácidos biliares. Estos, a su vez, se conjugan con glicina, taurina, ácido glucurónico o sulfato. Una mezcla de ácidos biliares conjugados y no conjugados, junto con el propio colesterol, se excreta del hígado a la bilis. Aproximadamente el 95% de los ácidos biliares se reabsorben en los intestinos y el resto se pierde en las heces. La excreción y reabsorción de ácidos biliares forma la base de la circulación enterohepática, que es esencial para la digestión y absorción de las grasas de la dieta. En determinadas circunstancias, cuando está más concentrado, como en la vesícula biliar, el colesterol cristaliza y es el componente principal de la mayoría de los cálculos biliares (también se producen cálculos biliares de lecitina y bilirrubina, pero con menor frecuencia).Todos los días, hasta 1 g de colesterol ingresa al colon. Este colesterol se origina en la dieta, la bilis y las células intestinales descamadas, y puede ser metabolizado por las bacterias colónicas. El colesterol se convierte principalmente en coprostanol, un esterol no absorbible que se excreta en las heces.
Aunque el colesterol es un esteroide generalmente asociado a los mamíferos, el patógeno humano Mycobacterium tuberculosis es capaz de degradar completamente esta molécula y contiene una gran cantidad de genes que son regulados por su presencia. Muchos de estos genes regulados por el colesterol son homólogos de los genes de oxidación β de ácidos grasos, pero han evolucionado de tal manera que se unen a grandes sustratos de esteroides como el colesterol.
Las grasas animales son mezclas complejas de triglicéridos, con cantidades menores de fosfolípidos y moléculas de colesterol a partir de las cuales se construyen todas las membranas celulares animales (y humanas). Dado que todas las células animales fabrican colesterol, todos los alimentos de origen animal contienen colesterol en cantidades variables. Las principales fuentes dietéticas de colesterol incluyen la carne roja, las yemas de huevo y los huevos enteros, el hígado, los riñones, las menudencias, el aceite de pescado y la mantequilla. La leche materna humana también contiene cantidades significativas de colesterol.
Las células vegetales sintetizan el colesterol como precursor de otros compuestos, como los fitoesteroles y los glicoalcaloides esteroideos, y el colesterol permanece en los alimentos vegetales solo en cantidades menores o ausente. Algunos alimentos vegetales, como el aguacate, las semillas de lino y los cacahuetes, contienen fitoesteroles, que compiten con el colesterol por la absorción en los intestinos y reducen la absorción del colesterol alimentario y biliar. Una dieta típica aporta del orden de 0,2 gramos de fitoesteroles, que no es suficiente para tener un impacto significativo en el bloqueo de la absorción de colesterol. La ingesta de fitoesteroles se puede complementar mediante el uso de alimentos funcionales que contengan fitoesteroles o suplementos dietéticos que se reconozca que tienen potencial para reducir los niveles de colesterol LDL.
En 2015, el Comité Asesor de Pautas Alimentarias del Departamento de Agricultura de los Estados Unidos (DGAC, por sus siglas en inglés) recomendó que los estadounidenses comieran la menor cantidad posible de colesterol en la dieta, porque la mayoría de los alimentos ricos en colesterol también tienen un alto contenido de grasas saturadas y, por lo tanto, pueden aumentar el riesgo de enfermedad cardiovascular..
Un informe de 2013 de la American Heart Association y el American College of Cardiology recomendó centrarse en patrones dietéticos saludables en lugar de límites específicos de colesterol, ya que son difíciles de implementar para los médicos y los consumidores. Recomiendan la dieta DASH y Mediterránea, que son bajas en colesterol. Una revisión de 2017 de la American Heart Association recomienda cambiar las grasas saturadas por grasas poliinsaturadas para reducir el riesgo de enfermedades cardiovasculares.
Algunas pautas complementarias han recomendado dosis de fitoesteroles en el rango de 1,6 a 3,0 gramos por día (Health Canada, EFSA, ATP III, FDA). Un metanálisis reciente demuestra una reducción del 12 % en el colesterol LDL con una dosis media de 2,1 gramos al día. Sin embargo, también se han cuestionado los beneficios de una dieta suplementada con fitoesteroles.
De acuerdo con la hipótesis de los lípidos, los niveles elevados de colesterol en la sangre conducen a la aterosclerosis, lo que puede aumentar el riesgo de ataque cardíaco, accidente cerebrovascular y enfermedad arterial periférica. Dado que el LDL en sangre más alto, especialmente las concentraciones de LDL más altas y el tamaño de partícula de LDL más pequeño, contribuye a este proceso más que el contenido de colesterol de las partículas de HDL, las partículas de LDL a menudo se denominan "colesterol malo". Las altas concentraciones de HDL funcional, que pueden eliminar el colesterol de las células y los ateromas, ofrecen protección y se conocen comúnmente como "colesterol bueno". Estos equilibrios están mayormente determinados genéticamente, pero pueden cambiar por la composición corporal, los medicamentos, la dieta y otros factores.Un estudio de 2007 demostró que los niveles de colesterol total en sangre tienen un efecto exponencial sobre la mortalidad cardiovascular y total, con una asociación más pronunciada en sujetos más jóvenes. Debido a que la enfermedad cardiovascular es relativamente rara en la población más joven, el impacto del colesterol alto en la salud es mayor en las personas mayores.
Los niveles elevados de las fracciones de lipoproteínas, LDL, IDL y VLDL, más que el nivel de colesterol total, se correlacionan con la extensión y el progreso de la aterosclerosis. Por el contrario, el colesterol total puede estar dentro de los límites normales, pero estar formado principalmente por partículas pequeñas de LDL y HDL, en cuyas condiciones las tasas de crecimiento del ateroma son altas. Un análisis post hoc de los estudios prospectivos IDEAL y EPIC encontró una asociación entre niveles elevados de colesterol HDL (ajustado por apolipoproteína AI y apolipoproteína B) y un mayor riesgo de enfermedad cardiovascular, lo que pone en duda el papel cardioprotector del "colesterol bueno".
Aproximadamente una de cada 250 personas puede tener una mutación genética para el receptor de colesterol LDL que les provoca hipercolerolemia familiar. El colesterol alto heredado también puede incluir mutaciones genéticas en el gen PCSK9 y el gen de la apolipoproteína B.
Los niveles elevados de colesterol se tratan con una dieta estricta que consiste en alimentos bajos en grasas saturadas, libres de grasas trans y bajos en colesterol, a menudo seguidos de uno de varios agentes hipolipidémicos, como estatinas, fibratos, inhibidores de la absorción de colesterol, terapia con anticuerpos monoclonales (inhibidores de PCSK9), derivados del ácido nicotínico o secuestrantes de ácidos biliares. Existen varias guías internacionales sobre el tratamiento de la hipercolesterolemia.
Los ensayos en humanos que utilizan inhibidores de la HMG-CoA reductasa, conocidos como estatinas, han confirmado repetidamente que cambiar los patrones de transporte de lipoproteínas de patrones no saludables a patrones más saludables reduce significativamente las tasas de eventos de enfermedades cardiovasculares, incluso para personas con valores de colesterol actualmente considerados bajos para adultos. Los estudios han demostrado que la reducción de los niveles de colesterol LDL en alrededor de 38,7 mg/dl con el uso de estatinas puede reducir el riesgo de enfermedad cardiovascular y accidente cerebrovascular en aproximadamente un 21 %. Los estudios también han encontrado que las estatinas reducen la progresión del ateroma. Como resultado, las personas con antecedentes de enfermedad cardiovascular pueden beneficiarse de las estatinas independientemente de sus niveles de colesterol (colesterol total por debajo de 5,0 mmol/L [193 mg/dL]),y en los hombres sin enfermedades cardiovasculares, la reducción de los niveles anormalmente altos de colesterol es beneficiosa ("prevención primaria"). La prevención primaria en mujeres se practicó originalmente solo por extensión de los hallazgos en estudios en hombres, ya que, en mujeres, ninguno de los grandes ensayos con estatinas realizados antes de 2007 demostró una reducción significativa en la mortalidad general o en los puntos finales cardiovasculares. Los metanálisis han demostrado reducciones significativas en la mortalidad cardiovascular y por todas las causas, sin heterogeneidad significativa por sexo.
| Nivel | Interpretación | |
|---|---|---|
| mg/dL | milimoles por litro | |
| < 200 | <5,2 | Nivel deseable(menor riesgo) |
| 200–240 | 5.2–6.2 | Alto riesgo limítrofe |
| > 240 | > 6.2 | Alto riesgo |
El informe de 1987 del Programa Nacional de Educación sobre el Colesterol, Paneles de Tratamiento para Adultos, sugiere que el nivel de colesterol total en sangre debe ser: < 200 mg/dL de colesterol normal en sangre, 200–239 mg/dL en el límite alto, > 240 mg/dL de colesterol alto. La American Heart Association proporciona un conjunto similar de pautas para los niveles de colesterol total (en ayunas) en la sangre y el riesgo de enfermedad cardíaca: Las estatinas son efectivas para reducir el colesterol LDL y se usan ampliamente para la prevención primaria en personas con alto riesgo de enfermedad cardiovascular, así como en prevención secundaria para aquellos que han desarrollado una enfermedad cardiovascular.
Los métodos de prueba más actuales determinan el colesterol LDL ("malo") y HDL ("bueno") por separado, lo que permite que el análisis del colesterol sea más matizado. Se considera que el nivel deseable de LDL es inferior a 100 mg/dL (2,6 mmol/L), aunque se puede considerar un límite superior más nuevo de 70 mg/dL (1,8 mmol/L) en personas de mayor riesgo en función de algunos de los juicios antes mencionados. Se cree que una proporción de colesterol total a HDL (otra medida útil) de mucho menos de 5:1 es más saludable.
 Los rangos de referencia para los análisis de sangre, que muestran los niveles habituales y óptimos de HDL, LDL y colesterol total en concentraciones másicas y molares, se encuentran en color naranja a la derecha, es decir, entre los constituyentes de la sangre con la concentración más alta.
Los rangos de referencia para los análisis de sangre, que muestran los niveles habituales y óptimos de HDL, LDL y colesterol total en concentraciones másicas y molares, se encuentran en color naranja a la derecha, es decir, entre los constituyentes de la sangre con la concentración más alta.
El colesterol total se define como la suma de HDL, LDL y VLDL. Por lo general, solo se miden el total, HDL y triglicéridos. Por razones de costo, el VLDL generalmente se estima como una quinta parte de los triglicéridos y el LDL se estima utilizando la fórmula de Friedewald (o una variante): LDL estimado = [colesterol total] - [HDL total] - [VLDL estimado]. Las medidas directas de LDL se utilizan cuando los triglicéridos superan los 400 mg/dL. Las VLDL y LDL estimadas tienen más error cuando los triglicéridos están por encima de 400 mg/dL.
En el Framingham Heart Study, cada aumento de 10 mg/dL (0,6 mmol/L) en los niveles de colesterol total aumentó la mortalidad general a 30 años en un 5 % y la mortalidad por ECV en un 9 %. Mientras que los sujetos mayores de 50 años tuvieron un aumento del 11 % en la mortalidad general y un aumento del 14 % en la mortalidad por enfermedades cardiovasculares por cada 1 mg/dl (0,06 mmol/l) de disminución anual en los niveles de colesterol total. Los investigadores atribuyeron este fenómeno a la causalidad inversa, por lo que la enfermedad en sí misma aumenta el riesgo de muerte, así como cambia una miríada de factores, como la pérdida de peso y la incapacidad para comer, que reducen el colesterol sérico.Este efecto también se mostró en hombres de todas las edades y mujeres mayores de 50 años en el Programa de Promoción y Vigilancia de la Salud de Vorarlberg. Estos grupos eran más propensos a morir de cáncer, enfermedades del hígado y enfermedades mentales con un colesterol total muy bajo, de 186 mg/dL (10,3 mmol/L) y menos. Este resultado indica que el efecto del colesterol bajo ocurre incluso entre los encuestados más jóvenes, lo que contradice la evaluación previa entre cohortes de personas mayores de que este es un marcador de fragilidad que ocurre con la edad.
Los niveles anormalmente bajos de colesterol se denominan hipocolesterolemia. La investigación sobre las causas de este estado es relativamente limitada, pero algunos estudios sugieren un vínculo con la depresión, el cáncer y la hemorragia cerebral. En general, los niveles bajos de colesterol parecen ser una consecuencia, más que una causa, de una enfermedad subyacente. Un defecto genético en la síntesis de colesterol causa el síndrome de Smith-Lemli-Opitz, que a menudo se asocia con niveles bajos de colesterol en plasma. El hipertiroidismo, o cualquier otro trastorno endocrino que provoque una regulación positiva del receptor de LDL, puede provocar hipocolesterolemia.
La American Heart Association recomienda medir el colesterol cada 4 a 6 años para personas de 20 años o más. Un conjunto separado de pautas de la American Heart Association emitidas en 2013 indica que las personas que toman medicamentos con estatinas deben hacerse una prueba de colesterol de 4 a 12 semanas después de su primera dosis y luego cada 3 a 12 meses a partir de entonces. Para hombres de 45 a 65 años y mujeres de 55 a 65 años, se debe realizar una prueba de colesterol cada 1 o 2 años, y para personas mayores de 65 años, se debe realizar una prueba anual.
Un profesional de la salud toma una muestra de sangre después de 12 horas de ayuno de una vena del brazo para medir un perfil de lípidos para a) colesterol total, b) colesterol HDL, c) colesterol LDL y d) triglicéridos. Los resultados pueden expresarse como "calculados", lo que indica un cálculo del colesterol total, HDL y triglicéridos.
El colesterol se analiza para determinar los niveles "normales" o "deseables" si una persona tiene un colesterol total de 5,2 mmol/L o más (200+ mg/dL), un valor de HDL de más de 1 mmol/L (40 mg/l). dL, "cuanto más alto, mejor"), un valor de LDL inferior a 2,6 mmol/L (100 mg/dL) y un nivel de triglicéridos inferior a 1,7 mmol/L (150 mg/dL). El colesterol en sangre en personas con estilo de vida, envejecimiento o factores de riesgo cardiovascular, como diabetes mellitus, hipertensión, antecedentes familiares de enfermedad arterial coronaria o angina, se evalúa en diferentes niveles.
Haga clic en genes, proteínas y metabolitos a continuación para vincular a los artículos respectivos.
Se sabe que algunos derivados del colesterol (entre otros lípidos colestéricos simples) generan la "fase colestérica" líquida cristalina. La fase colestérica es, de hecho, una fase nemática quiral, y cambia de color cuando cambia su temperatura. Esto hace que los derivados del colesterol sean útiles para indicar la temperatura en termómetros de pantalla de cristal líquido y en pinturas sensibles a la temperatura.
El colesterol tiene 256 estereoisómeros que surgen de sus ocho estereocentros, aunque solo dos de los estereoisómeros tienen importancia bioquímica (nat -colesterol y ent -colesterol, por natural y enantiómero, respectivamente), y solo uno se presenta de forma natural (nat -colesterol).

 Conversión de unidades de colesterol
Conversión de unidades de colesterol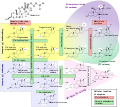 Esteroidogénesis, utilizando el colesterol como material de construcción.
Esteroidogénesis, utilizando el colesterol como material de construcción. Modelo de relleno de espacio de la molécula de colesterol
Modelo de relleno de espacio de la molécula de colesterol Numeración de los núcleos de esteroides
Numeración de los núcleos de esteroidesLa cerveza es una de las bebidas alcohólicas más antiguas y más consumidas del mundo, y la tercera bebida más consumida en general después del agua y el... (leer más)
Una Sustancia psicoactiva, psicofármaco, agente psicoactivo o una droga psicotrópica, es una sustancia química que cambia la función del sistema nervioso... (leer más)
El término sistema alimentario o sistema dietario describe los sistemas y procesos interconectados que influyen en la nutrición, los alimentos, la salud... (leer más)