Solvente
Un solvente o disolvente (del latín solvō, "aflojar, desatar, resolver") es una sustancia que disuelve un soluto, dando como resultado una solución. Un disolvente suele ser un líquido, pero también puede ser un sólido, un gas o un fluido supercrítico. El agua es un solvente para las moléculas polares y el solvente más común utilizado por los seres vivos; todos los iones y proteínas en una célula se disuelven en agua dentro de la célula.
La cantidad de soluto que se puede disolver en un volumen específico de solvente varía con la temperatura. Los principales usos de los solventes se encuentran en pinturas, removedores de pintura, tintas y limpieza en seco. Los usos específicos de los disolventes orgánicos son la limpieza en seco (p. ej., tetracloroetileno); como diluyentes de pintura (tolueno, trementina); como quitaesmaltes y disolventes de pegamento (acetona, acetato de metilo, acetato de etilo); en quitamanchas (hexano, éter de petróleo); en detergentes (terpenos cítricos); y en perfumes (etanol). Los solventes encuentran diversas aplicaciones en las industrias química, farmacéutica, del petróleo y del gas, incluidas las síntesis químicas y los procesos de purificación.
Soluciones y solvatación
Cuando una sustancia se disuelve en otra, se forma una solución. Esto se opone a la situación en la que los compuestos son insolubles como la arena en el agua. En una solución, todos los ingredientes se distribuyen uniformemente a nivel molecular y no quedan residuos. Una mezcla solvente-soluto consta de una sola fase con todas las moléculas de soluto que se presentan como solvatos (complejos solvente-soluto), a diferencia de las fases continuas separadas como en suspensiones, emulsiones y otros tipos de mezclas sin solución. La capacidad de un compuesto para disolverse en otro se conoce como solubilidad; si esto ocurre en todas las proporciones, se llama miscible.
Además de mezclarse, las sustancias en una solución interactúan entre sí a nivel molecular. Cuando algo se disuelve, las moléculas del solvente se organizan alrededor de las moléculas del soluto. La transferencia de calor está involucrada y la entropía aumenta, lo que hace que la solución sea más termodinámicamente estable que el soluto y el solvente por separado. Esta disposición está mediada por las propiedades químicas respectivas del solvente y el soluto, como los enlaces de hidrógeno, el momento dipolar y la polarizabilidad. La solvatación no provoca una reacción química ni cambios en la configuración química del soluto. Sin embargo, la solvatación se parece a una reacción de formación de un complejo de coordinación, a menudo con una energía considerable (calor de solvatación y entropía de solvatación) y, por lo tanto, está lejos de ser un proceso neutral.
Cuando una sustancia se disuelve en otra, se forma una solución. Una solución es una mezcla homogénea que consiste en un soluto disuelto en un solvente. El soluto es la sustancia que se disuelve, mientras que el solvente es el medio de disolución. Las soluciones se pueden formar con muchos tipos y formas diferentes de solutos y solventes.
Clasificaciones de disolventes
Los solventes se pueden clasificar ampliamente en dos categorías: polares y no polares. Un caso especial es el mercurio, cuyas soluciones se conocen como amalgamas; además, existen otras soluciones metálicas que son líquidas a temperatura ambiente.
Generalmente, la constante dieléctrica del solvente proporciona una medida aproximada de la polaridad de un solvente. La fuerte polaridad del agua está indicada por su alta constante dieléctrica de 88 (a 0 °C). Los solventes con una constante dieléctrica de menos de 15 generalmente se consideran no polares.
La constante dieléctrica mide la tendencia del solvente a cancelar parcialmente la fuerza de campo del campo eléctrico de una partícula cargada sumergida en él. Esta reducción se compara luego con la intensidad de campo de la partícula cargada en el vacío. Heurísticamente, la constante dieléctrica de un solvente puede considerarse como su capacidad para reducir la carga interna efectiva del soluto. En general, la constante dieléctrica de un solvente es un predictor aceptable de la capacidad del solvente para disolver compuestos iónicos comunes, como las sales.
Otras escalas de polaridad
Las constantes dieléctricas no son la única medida de polaridad. Debido a que los químicos utilizan solventes para llevar a cabo reacciones químicas u observar fenómenos químicos y biológicos, se requieren medidas de polaridad más específicas. La mayoría de estas medidas son sensibles a la estructura química.
La escala m Y de Grunwald-Winstein mide la polaridad en términos de la influencia del solvente en la acumulación de carga positiva de un soluto durante una reacción química.
La escala Z de Kosower mide la polaridad en términos de la influencia del solvente en los máximos de absorción UV de una sal, generalmente yoduro de piridinio o el zwitterión de piridinio.
El número de donante y la escala de aceptor de donante miden la polaridad en términos de cómo un solvente interactúa con sustancias específicas, como un ácido de Lewis fuerte o una base de Lewis fuerte.
El parámetro de Hildebrand es la raíz cuadrada de la densidad de energía cohesiva. Se puede usar con compuestos no polares, pero no puede adaptarse a la química compleja.
El tinte de Reichardt, un tinte solvatocrómico que cambia de color en respuesta a la polaridad, da una escala de valores ET ( 30). E T es la energía de transición entre el estado fundamental y el estado excitado más bajo en kcal/mol, y (30) identifica el tinte. Otra escala, más o menos correlacionada (E T (33)) se puede definir con el rojo Nilo.
La polaridad, el momento dipolar, la polarizabilidad y los enlaces de hidrógeno de un solvente determinan qué tipo de compuestos puede disolver y con qué otros solventes o compuestos líquidos es miscible. En general, los solventes polares disuelven mejor los compuestos polares y los solventes no polares disuelven mejor los compuestos no polares: "lo similar disuelve lo similar". Los compuestos fuertemente polares como azúcares (p. ej., sacarosa) o compuestos iónicos, como sales inorgánicas (p. ej., sal de mesa) se disuelven solo en solventes muy polares como el agua, mientras que los compuestos fuertemente no polares como aceites o ceras se disuelven solo en solventes orgánicos muy no polares como hexano. Del mismo modo, el agua y el hexano (o el vinagre y el aceite vegetal) no son miscibles entre sí y se separarán rápidamente en dos capas incluso después de agitarlos bien.
La polaridad se puede separar en diferentes contribuciones. Por ejemplo, los parámetros de Kamlet-Taft son dipolaridad/polarizabilidad (π*), acidez de enlace de hidrógeno (α) y basicidad de enlace de hidrógeno (β). Estos se pueden calcular a partir de los cambios de longitud de onda de 3 a 6 colorantes solvatocrómicos diferentes en el solvente, que generalmente incluyen el colorante de Reichardt, la nitroanilina y la dietilnitroanilina. Otra opción, los parámetros de Hansen, separan la densidad de energía cohesiva en contribuciones de dispersión, polares y de enlaces de hidrógeno.
Polar prótico y polar aprótico
Los disolventes con una constante dieléctrica (más exactamente, permitividad estática relativa) superior a 15 (es decir, polares o polarizables) se pueden dividir en próticos y apróticos. Los disolventes próticos solvatan aniones (solutos cargados negativamente) fuertemente a través de enlaces de hidrógeno. El agua es un disolvente prótico. Los disolventes apróticos como la acetona o el diclorometano tienden a tener grandes momentos dipolares (separación de cargas parcialmente positivas y parcialmente negativas dentro de la misma molécula) y solvatan especies cargadas positivamente a través de su dipolo negativo. En las reacciones químicas el uso de solventes polares próticos favorece el mecanismo de reacción S N 1, mientras que los solventes polares apróticos favorecen el S N2 mecanismo de reacción. Estos disolventes polares son capaces de formar enlaces de hidrógeno con agua para disolverse en agua, mientras que los disolventes no polares no son capaces de formar enlaces de hidrógeno fuertes.
Disolventes multicomponentes
Los solventes multicomponentes aparecieron después de la Segunda Guerra Mundial en la URSS y continúan usándose y produciéndose en los estados postsoviéticos. Estos solventes pueden tener una o más aplicaciones, pero no son preparaciones universales.
Disolventes
| Nombre | Composición |
|---|---|
| Disolvente 645 | tolueno 50%, acetato de butilo 18%, acetato de etilo 12%, butanol 10%, etanol 10%. |
| Disolvente 646 | tolueno 50 %, etanol 15 %, butanol 10 %, acetato de butilo o amilo 10 %, celosolve de etilo 8 %, acetona 7 % |
| Disolvente 647 | acetato de butilo o amilo 29,8 %, acetato de etilo 21,2 %, butanol 7,7 %, tolueno o pirobenceno 41,3 % |
| Disolvente 648 | acetato de butilo 50%, etanol 10%, butanol 20%, tolueno 20% |
| Disolvente 649 | celosolve de etilo 30%, butanol 20%, xileno 50% |
| Disolvente 650 | celosolve de etilo 20%, butanol 30%, xileno 50% |
| Disolvente 651 | aguarrás 90%, butanol 10% |
| Disolvente KR-36 | acetato de butilo 20%, butanol 80% |
| Disolvente R-4 | tolueno 62%, acetona 26%, acetato de butilo 12%. |
| Disolvente R-10 | xileno 85%, acetona 15%. |
| Disolvente R-12 | tolueno 60%, acetato de butilo 30%, xileno 10%. |
| Disolvente R-14 | ciclohexanona 50%, tolueno 50%. |
| Disolvente R-24 | disolvente 50%, xileno 35%, acetona 15%. |
| Disolvente R-40 | tolueno 50%, celosolve de etilo 30%, acetona 20%. |
| Disolvente R-219 | tolueno 34%, ciclohexanona 33%, acetona 33%. |
| Disolvente R-3160 | butanol 60%, etanol 40%. |
| RCC solvente | xileno 90%, acetato de butilo 10%. |
| Solvente RML | etanol 64%, etilcelosolve 16%, tolueno 10%, butanol 10%. |
| Disolvente PML-315 | tolueno 25%, xileno 25%, acetato de butilo 18%, celosolve de etilo 17%, butanol 15%. |
| Disolvente PC-1 | tolueno 60%, acetato de butilo 30%, xileno 10%. |
| Disolvente PC-2 | aguarrás 70%, xileno 30%. |
| Solvente RFG | etanol 75%, butanol 25%. |
| Disolvente RE-1 | xileno 50%, acetona 20%, butanol 15%, etanol 15%. |
| Disolvente RE-2 | Disolvente 70%, etanol 20%, acetona 10%. |
| Disolvente RE-3 | solvente 50%, etanol 20%, acetona 20%, celosolve de etilo 10%. |
| Disolvente RE-4 | disolvente 50%, acetona 30%, etanol 20%. |
| Disolvente FK-1 (?) | alcohol absoluto (99,8%) 95%, acetato de etilo 5% |
Diluyentes
| Nombre | Composición |
|---|---|
| Diluyente RKB-1 | butanol 50%, xileno 50% |
| Diluyente RKB-2 | butanol 95%, xileno 5% |
| Diluyente RKB-3 | xileno 90%, butanol 10% |
| Más delgado M | etanol 65%, acetato de butilo 30%, acetato de etilo 5%. |
| Diluyente P-7 | ciclohexanona 50%, etanol 50%. |
| Diluyente R-197 | xileno 60%, acetato de butilo 20%, celosolve de etilo 20%. |
| Diluyente de WFD | tolueno 50%, acetato de butilo (o acetato de amilo) 18%, butanol 10%, etanol 10%, acetato de etilo 9%, acetona 3%. |
Propiedades físicas
Tabla de propiedades de disolventes comunes
Los solventes se agrupan en solventes no polares, apróticos polares y próticos polares, con cada grupo ordenado por polaridad creciente. Las propiedades de los disolventes que superan las del agua están en negrita.
| Solvente | Fórmula química | Punto de ebullición (°C) | Constante dieléctrica | Densidad (g/mL) | Momento dipolar (D) |
|---|---|---|---|---|---|
| Disolventes de hidrocarburos no polares | |||||
| pentano |  CH 3 CH 2 CH 2 CH 2 CH 3 CH 3 CH 2 CH 2 CH 2 CH 3 | 36.1 | 1.84 | 0.626 | 0.00 |
| Hexano | 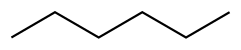 CH 3 CH 2 CH 2 CH 2 CH 2 CH 3 CH 3 CH 2 CH 2 CH 2 CH 2 CH 3 | 69 | 1.88 | 0.655 | 0.00 |
| Benceno | 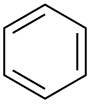 C 6 H 6 | 80.1 | 2.3 | 0.879 | 0.00 |
| tolueno | C 6 H 5 -CH 3 | 111 | 2.38 | 0.867 | 0.36 |
| Disolventes de éter no polar | |||||
| 1,4-dioxano |  C 4 H 8 O 2 | 101.1 | 2.3 | 1.033 | 0,45 |
| Éter dietílico |  CH 3 CH 2 -O-CH 2 CH 3 CH 3 CH 2 -O-CH 2 CH 3 | 34.6 | 4.3 | 0.713 | 1.15 |
| Tetrahidrofurano (THF) | 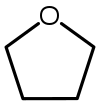 C 4 H 8 O | 66 | 7.5 | 0.886 | 1.75 |
| Disolventes de clorocarbono no polares | |||||
| Cloroformo |  CHCl 3 CHCl 3 | 61.2 | 4.81 | 1.498 | 1.04 |
| Disolventes apróticos polares | |||||
| Diclorometano (DCM) |  CH 2 Cl 2 CH 2 Cl 2 | 39.6 | 9.1 | 1.3266 | 1.60 |
| Acetato de etilo |  CH 3 -C(=O)-O-CH 2 -CH 3 | 77.1 | 6.02 | 0.894 | 1.78 |
| Acetona |  CH3 - C(=O) -CH3 | 56.1 | 21 | 0.786 | 2.88 |
| Dimetilformamida (DMF) | 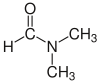 HC(=O)N(CH3) 2 | 153 | 38 | 0.944 | 3.82 |
| Acetonitrilo (MeCN) | 82 | 37.5 | 0.786 | 3.92 | |
| Dimetilsulfóxido (DMSO) |  CH3 - S(=O) -CH3 | 189 | 46.7 | 1.092 | 3.96 |
| nitrometano | 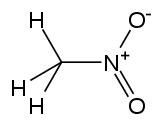 CH 3- NO 2 CH 3- NO 2 | 100–103 | 35.87 | 1.1371 | 3.56 |
| Carbonato de propileno |  C 4 H 6 O 3 C 4 H 6 O 3 | 240 | 64.0 | 1.205 | 4.9 |
| Disolventes próticos polares | |||||
| Amoníaco | 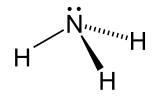 NH 3 NH 3 | -33.3 | 17 | 0.674(a -33,3 °C) | 1.42 |
| Ácido fórmico |  HC(=O)OH | 100.8 | 58 | 1.21 | 1.41 |
| n -butanol | 117.7 | 18 | 0.810 | 1.63 | |
| Alcohol isopropílico (IPA) | 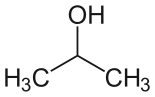 CH3 - CH(-OH)-CH3 | 82.6 | 18 | 0.785 | 1.66 |
| n -Propanol |  CH 3 CH 2 CH 2 OH CH 3 CH 2 CH 2 OH | 97 | 20 | 0.803 | 1.68 |
| Etanol | 78.2 | 24.55 | 0.789 | 1.69 | |
| metanol | 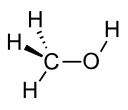 CH 3 OH CH 3 OH | 64.7 | 33 | 0.791 | 1.70 |
| Ácido acético |  CH3 - C(=O)OH | 118 | 6.2 | 1.049 | 1.74 |
| Agua |  HOH | 100 | 80 | 1.000 | 1.85 |
El Instituto de Química Verde de ACS mantiene una herramienta para la selección de solventes basada en un análisis de componentes principales de las propiedades del solvente.
Valores de los parámetros de solubilidad de Hansen
Los valores del parámetro de solubilidad de Hansense basan en enlaces de dispersión (δD), enlaces polares (δP) y enlaces de hidrógeno (δH). Estos contienen información sobre las interacciones intermoleculares con otros solventes y también con polímeros, pigmentos, nanopartículas, etc. Esto permite formulaciones racionales sabiendo, por ejemplo, que existe una buena coincidencia de HSP entre un solvente y un polímero. También se pueden hacer sustituciones racionales de solventes "buenos" (eficaces para disolver el soluto) que son "malos" (caros o peligrosos para la salud o el medio ambiente). La siguiente tabla muestra que las intuiciones de "no polar", "aprótico polar" y "prótico polar" se expresan numéricamente: las moléculas "polares" tienen niveles más altos de δP y los disolventes próticos tienen niveles más altos de δH. Debido a que se utilizan valores numéricos, las comparaciones se pueden hacer racionalmente comparando números. Por ejemplo, el acetonitrilo es mucho más polar que la acetona pero muestra un poco menos de enlaces de hidrógeno.
| Solvente | Fórmula química | Dispersión δD | δP Polar | δH Enlace de hidrógeno |
|---|---|---|---|---|
| Disolventes no polares | ||||
| n-hexano | CH 3 CH 2 CH 2 CH 2 CH 2 CH 3 | 14.9 | 0.0 | 0.0 |
| Benceno | C 6 H 6 | 18.4 | 0.0 | 2.0 |
| tolueno | C 6 H 5 -CH 3 | 18.0 | 1.4 | 2.0 |
| Éter dietílico | CH 3 CH 2 -O-CH 2 CH 3 | 14.5 | 2.9 | 4.6 |
| Cloroformo | CHCl 3 | 17.8 | 3.1 | 5.7 |
| 1,4-dioxano | /-CH 2 -CH 2 -O-CH 2 -CH 2 -O- | 17.5 | 1.8 | 9.0 |
| Disolventes apróticos polares | ||||
| Acetato de etilo | CH 3 -C(=O)-O-CH 2 -CH 3 | 15.8 | 5.3 | 7.2 |
| Tetrahidrofurano (THF) | /-CH 2 -CH 2 -O-CH 2 -CH 2 - | 16.8 | 5.7 | 8.0 |
| diclorometano | CH 2 Cl 2 | 17.0 | 7.3 | 7.1 |
| Acetona | CH3 - C(=O) -CH3 | 15.5 | 10.4 | 7.0 |
| Acetonitrilo (MeCN) | CH 3 -C≡N | 15.3 | 18.0 | 6.1 |
| Dimetilformamida (DMF) | HC(=O)N(CH3) 2 | 17.4 | 13.7 | 11.3 |
| Dimetilsulfóxido (DMSO) | CH3 - S(=O) -CH3 | 18.4 | 16.4 | 10.2 |
| Disolventes próticos polares | ||||
| Ácido acético | CH3 - C(=O)OH | 14.5 | 8.0 | 13.5 |
| n -butanol | CH 3 CH 2 CH 2 CH 2 OH | 16.0 | 5.7 | 15.8 |
| isopropanol | CH3 - CH(-OH)-CH3 | 15.8 | 6.1 | 16.4 |
| n -Propanol | CH 3 CH 2 CH 2 OH | 16.0 | 6.8 | 17.4 |
| Etanol | CH 3 CH 2 OH | 15.8 | 8.8 | 19.4 |
| metanol | CH 3 OH | 14.7 | 12.3 | 22.3 |
| Ácido fórmico | HC(=O)OH | 14.6 | 10.0 | 14.0 |
| Agua | HOH | 15.5 | 16.0 | 42.3 |
Si, por razones ambientales o de otro tipo, se requiere que un solvente o una mezcla de solventes reemplace a otro de solvencia equivalente, la sustitución puede hacerse sobre la base de los parámetros de solubilidad de Hansen de cada uno. Los valores de las mezclas se toman como promedios ponderados de los valores de los disolventes puros. Esto se puede calcular mediante prueba y error, una hoja de cálculo de valores o el software HSP. Una mezcla 1:1 de tolueno y 1,4 dioxano tiene valores de δD, δP y δH de 17,8, 1,6 y 5,5, comparables a los del cloroformo en 17,8, 3,1 y 5,7 respectivamente. Debido a los peligros para la salud asociados con el tolueno en sí mismo, se pueden encontrar otras mezclas de solventes utilizando un conjunto completo de datos de HSP.
Punto de ebullición
| Solvente | Punto de ebullición (°C) |
|---|---|
| dicloruro de etileno | 83.48 |
| piridina | 115.25 |
| metil isobutil cetona | 116.5 |
| cloruro de metileno | 39.75 |
| isooctano | 99.24 |
| disulfuro de carbono | 46.3 |
| tetracloruro de carbono | 76.75 |
| o-xileno | 144.42 |
El punto de ebullición es una propiedad importante porque determina la velocidad de evaporación. Pequeñas cantidades de disolventes con un punto de ebullición bajo, como el éter dietílico, el diclorometano o la acetona, se evaporarán en segundos a temperatura ambiente, mientras que los disolventes con un punto de ebullición elevado, como el agua o el sulfóxido de dimetilo, necesitan temperaturas más altas, un flujo de aire o la aplicación de vacío. para una evaporación rápida.
- Punto de ebullición bajo: punto de ebullición por debajo de 100 °C (punto de ebullición del agua)
- Calderas medianas: entre 100 °C y 150 °C
- Puntos de ebullición altos: por encima de 150 °C
Densidad
La mayoría de los solventes orgánicos tienen una densidad más baja que el agua, lo que significa que son más livianos y formarán una capa sobre el agua. Las excepciones importantes son que la mayoría de los solventes halogenados como el diclorometano o el cloroformo se hundirán hasta el fondo de un recipiente, dejando el agua como capa superior. Es crucial recordar esto cuando se reparten compuestos entre solventes y agua en un embudo de decantación durante la síntesis química.
A menudo, se cita la gravedad específica en lugar de la densidad. La gravedad específica se define como la densidad del solvente dividida por la densidad del agua a la misma temperatura. Como tal, la gravedad específica es un valor sin unidades. Comunica fácilmente si un solvente insoluble en agua flotará (SG < 1.0) o se hundirá (SG > 1.0) cuando se mezcle con agua.
| Solvente | showGravedad específica |
|---|
La seguridad
Fuego
La mayoría de los disolventes orgánicos son inflamables o muy inflamables, según su volatilidad. Las excepciones son algunos solventes clorados como el diclorometano y el cloroformo. Las mezclas de vapores de solventes y aire pueden explotar. Los vapores de solventes son más pesados que el aire; se hundirán hasta el fondo y pueden viajar grandes distancias casi sin diluir. Los vapores de solventes también se pueden encontrar en bidones y latas supuestamente vacíos, lo que representa un peligro de incendio repentino; por lo tanto, los contenedores vacíos de solventes volátiles deben almacenarse abiertos y boca abajo.
Tanto el éter dietílico como el disulfuro de carbono tienen temperaturas de autoignición excepcionalmente bajas que aumentan en gran medida el riesgo de incendio asociado con estos solventes. La temperatura de autoignición del disulfuro de carbono es inferior a 100 °C (212 °F), por lo que objetos como tuberías de vapor, bombillas, hornillos y mecheros Bunsen recientemente apagados pueden encender sus vapores.
Además, algunos solventes, como el metanol, pueden arder con una llama muy caliente que puede ser casi invisible bajo ciertas condiciones de iluminación. Esto puede retrasar o impedir el reconocimiento oportuno de un incendio peligroso, hasta que las llamas se propaguen a otros materiales.
Formación de peróxido explosivo
Los éteres como el éter dietílico y el tetrahidrofurano (THF) pueden formar peróxidos orgánicos altamente explosivos al exponerse al oxígeno y la luz. Normalmente, es más probable que el THF forme tales peróxidos que el éter dietílico. Uno de los solventes más susceptibles es el éter diisopropílico, pero todos los éteres se consideran fuentes potenciales de peróxido.
El heteroátomo (oxígeno) estabiliza la formación de un radical libre que se forma por la abstracción de un átomo de hidrógeno por otro radical libre. El radical libre centrado en el carbono así formado puede reaccionar con una molécula de oxígeno para formar un compuesto de peróxido. El proceso de formación de peróxido se acelera en gran medida por la exposición incluso a niveles bajos de luz, pero puede avanzar lentamente incluso en condiciones de oscuridad.
A menos que se utilice un desecante que pueda destruir los peróxidos, estos se concentrarán durante la destilación debido a su punto de ebullición más alto. Cuando se han formado suficientes peróxidos, pueden formar un precipitado sólido cristalino sensible a los golpes en la boca de un recipiente o botella. Las perturbaciones mecánicas menores, como raspar el interior de un recipiente o el desalojo de un depósito, simplemente girando la tapa pueden proporcionar suficiente energía para que el peróxido explote o detone. La formación de peróxido no es un problema significativo cuando los solventes nuevos se agotan rápidamente; son más un problema en los laboratorios que pueden tardar años en terminar una sola botella. Los usuarios de bajo volumen deben adquirir solo pequeñas cantidades de solventes propensos al peróxido y desechar los solventes viejos en un programa periódico regular.
Para evitar la formación explosiva de peróxido, los éteres deben almacenarse en un recipiente hermético, lejos de la luz, ya que tanto la luz como el aire pueden fomentar la formación de peróxido.
Se pueden usar varias pruebas para detectar la presencia de un peróxido en un éter; una es usar una combinación de sulfato de hierro (II) y tiocianato de potasio. El peróxido puede oxidar el ion Fe a un ion Fe, que luego forma un complejo de coordinación de color rojo oscuro con el tiocianato.
Los peróxidos se pueden eliminar lavando con sulfato de hierro (II) ácido, filtrando a través de alúmina o destilando de sodio/benzofenona. La alúmina degrada los peróxidos pero algunos pueden permanecer intactos en ella, por lo que debe desecharse adecuadamente. La ventaja de usar sodio/benzofenona es que también se eliminan la humedad y el oxígeno.
Efectos en la salud
Los peligros generales para la salud asociados con la exposición a solventes incluyen toxicidad para el sistema nervioso, daño reproductivo, daño hepático y renal, insuficiencia respiratoria, cáncer y dermatitis.
Exposición aguda
Muchos disolventes pueden provocar una pérdida repentina del conocimiento si se inhalan en grandes cantidades. Los disolventes como el éter dietílico y el cloroformo se han utilizado en medicina como anestésicos, sedantes e hipnóticos durante mucho tiempo. El etanol (alcohol de grano) es una droga psicoactiva ampliamente utilizada y abusada. El éter dietílico, el cloroformo y muchos otros solventes, por ejemplo, de la gasolina o los pegamentos, se abusan recreativamente al inhalar pegamento, a menudo con efectos nocivos para la salud a largo plazo, como neurotoxicidad o cáncer. La sustitución fraudulenta del 1,5-pentanodiol por el psicoactivo 1,4-butanodiol por parte de un subcontratista provocó el retiro del producto de Bindeez. Si se ingieren, los llamados alcoholes tóxicos (distintos del etanol) como el metanol, el propanol y el etilenglicol se metabolizan en aldehídos y ácidos tóxicos, que provocan una acidosis metabólica potencialmente letal.El metanol disolvente de alcohol comúnmente disponible puede causar ceguera permanente o la muerte si se ingiere. El solvente 2-butoxietanol, usado en fluidos de fracking, puede causar hipotensión y acidosis metabólica.
Exposición crónica
Se sabe que algunos solventes, incluidos el cloroformo y el benceno, un ingrediente común en la gasolina, son cancerígenos, mientras que la Organización Mundial de la Salud considera que muchos otros son probablemente cancerígenos. Los solventes pueden dañar órganos internos como el hígado, los riñones, el sistema nervioso o el cerebro. Los efectos acumulativos de la exposición prolongada o repetida a los solventes se denominan encefalopatía crónica inducida por solventes (CSE).
La exposición crónica a disolventes orgánicos en el entorno laboral puede producir una serie de efectos neuropsiquiátricos adversos. Por ejemplo, la exposición ocupacional a solventes orgánicos se ha asociado con un mayor número de pintores que sufren de alcoholismo. El etanol tiene un efecto sinérgico cuando se toma en combinación con muchos solventes; por ejemplo, una combinación de tolueno/benceno y etanol provoca más náuseas/vómitos que cualquiera de las dos sustancias solas.
Se sabe o se sospecha que muchos disolventes son cataratogénicos, lo que aumenta en gran medida el riesgo de desarrollar cataratas en el cristalino del ojo. La exposición a solventes también se ha asociado con daños neurotóxicos que causan pérdida de la audición y pérdida de la visión del color.
Contaminación ambiental
Una vía importante para inducir efectos en la salud surge de los derrames o fugas de solventes que alcanzan el suelo subyacente. Dado que los solventes migran fácilmente distancias considerables, la creación de una contaminación generalizada del suelo no es infrecuente; esto es particularmente un riesgo para la salud si los acuíferos se ven afectados. La intrusión de vapor puede ocurrir desde sitios con una extensa contaminación por solventes en el subsuelo.
Contenido relacionado
Lawrencio
Galio
Metal alcalino