Grupo acilo
En química, un grupo acilo es un resto derivado de la eliminación de uno o más grupos hidroxilo de un oxoácido, incluidos los ácidos inorgánicos.... (leer más)
Los metales alcalinos están formados por los elementos químicos litio (Li), sodio (Na), potasio (K), rubidio (Rb), cesio (Cs) y francio (Fr). Junto con el hidrógeno constituyen el grupo 1, que se encuentra en el bloque s de la tabla periódica. Todos los metales alcalinos tienen su electrón más externo en un orbital s: esta configuración electrónica compartida hace que tengan propiedades características muy similares. De hecho, los metales alcalinos proporcionan el mejor ejemplo de tendencias grupales en las propiedades de la tabla periódica, con elementos que exhiben un comportamiento homólogo bien caracterizado. Esta familia de elementos también se conoce como la familia del litio por su elemento principal.
Los metales alcalinos son todos metales brillantes, suaves y altamente reactivos a temperatura y presión estándar y pierden fácilmente su electrón más externo para formar cationes con carga +1. Todos se pueden cortar fácilmente con un cuchillo debido a su suavidad, dejando al descubierto una superficie brillante que se empaña rápidamente en el aire debido a la oxidación por la humedad atmosférica y el oxígeno (y en el caso del litio, el nitrógeno). Debido a su alta reactividad, deben almacenarse bajo aceite para evitar la reacción con el aire, y se encuentran naturalmente solo en sales y nunca como elementos libres. El cesio, el quinto metal alcalino, es el más reactivo de todos los metales. Todos los metales alcalinos reaccionan con el agua, y los metales alcalinos más pesados reaccionan más vigorosamente que los más ligeros.
Todos los metales alcalinos descubiertos se encuentran en la naturaleza como sus compuestos: en orden de abundancia, el sodio es el más abundante, seguido por el potasio, el litio, el rubidio, el cesio y finalmente el francio, que es muy raro debido a su contenido extremadamente alto. radioactividad; el francio se presenta solo en trazas diminutas en la naturaleza como un paso intermedio en algunas ramas laterales oscuras de las cadenas de descomposición natural. Se han realizado experimentos para intentar la síntesis de ununennium (Uue), que probablemente sea el próximo miembro del grupo; ninguno tuvo éxito. Sin embargo, es posible que el ununenio no sea un metal alcalino debido a los efectos relativistas, que se prevé que tengan una gran influencia en las propiedades químicas de los elementos superpesados; incluso si resulta ser un metal alcalino, se prevé que tenga algunas diferencias en las propiedades físicas y químicas de sus homólogos más ligeros.
La mayoría de los metales alcalinos tienen muchas aplicaciones diferentes. Una de las aplicaciones más conocidas de los elementos puros es el uso de rubidio y cesio en relojes atómicos, de los cuales los relojes atómicos de cesio forman la base del segundo. Una aplicación común de los compuestos de sodio es la lámpara de vapor de sodio, que emite luz de manera muy eficiente. La sal de mesa, o cloruro de sodio, se ha utilizado desde la antigüedad. El litio encuentra uso como medicamento psiquiátrico y como ánodo en las baterías de litio. El sodio, el potasio y el litio son elementos esenciales, con funciones biológicas importantes como electrolitos, y aunque los otros metales alcalinos no son esenciales, también tienen varios efectos en el cuerpo, tanto beneficiosos como perjudiciales.
Los compuestos de sodio se conocen desde la antigüedad; la sal (cloruro de sodio) ha sido un producto básico importante en las actividades humanas, como lo atestigua la palabra inglesa salary, en referencia a salarium, dinero pagado a los soldados romanos por la compra de sal. Si bien la potasa se ha utilizado desde la antigüedad, durante la mayor parte de su historia no se entendió que fuera una sustancia fundamentalmente diferente de las sales minerales de sodio. Georg Ernst Stahl obtuvo evidencia experimental que lo llevó a sugerir la diferencia fundamental de las sales de sodio y potasio en 1702, y Henri-Louis Duhamel du Monceau pudo probar esta diferencia en 1736. La composición química exacta de los compuestos de potasio y sodio, y la entonces no se conocía el estado como elemento químico del potasio y el sodio, por lo que Antoine Lavoisier no incluyó ninguno de los álcalis en su lista de elementos químicos en 1789.
El potasio puro fue aislado por primera vez en 1807 en Inglaterra por Humphry Davy, quien lo derivó de la potasa cáustica (KOH, hidróxido de potasio) mediante el uso de la electrólisis de la sal fundida con la pila voltaica recién inventada. Los intentos anteriores de electrólisis de la sal acuosa no tuvieron éxito debido a la extrema reactividad del potasio. El potasio fue el primer metal que se aisló por electrólisis. Más tarde ese mismo año, Davy informó sobre la extracción de sodio de una sustancia similar soda cáustica (NaOH, lejía) mediante una técnica similar, demostrando que los elementos y, por lo tanto, las sales, eran diferentes.
La petalita (Li Al Si4O10) fue descubierta en 1800 por el químico brasileño José Bonifácio de Andrada en una mina en la isla de Utö, Suecia. Sin embargo, no fue hasta 1817 que Johan August Arfwedson, entonces trabajando en el laboratorio del químico Jöns Jacob Berzelius, detectó la presencia de un nuevo elemento mientras analizaba el mineral de petalita. Él observó que este nuevo elemento formaba compuestos similares a los del sodio y el potasio, aunque su carbonato e hidróxido eran menos solubles en agua y más alcalinos que los otros metales alcalinos. Berzelius le dio al material desconocido el nombre "lithion/lithina", de la palabra griega λιθoς (transcrito como lithos, que significa "piedra"), para reflejar su descubrimiento en un mineral sólido, a diferencia del potasio, que se había descubierto en cenizas de plantas, y el sodio, que era conocido en parte por su alto abundancia en sangre animal. Llamó al metal dentro del material "litio". El litio, el sodio y el potasio fueron parte del descubrimiento de la periodicidad, ya que se encuentran entre una serie de tríadas de elementos en el mismo grupo que Johann Wolfgang Döbereiner señaló en 1850 por tener propiedades similares.
El rubidio y el cesio fueron los primeros elementos descubiertos mediante el espectroscopio, inventado en 1859 por Robert Bunsen y Gustav Kirchhoff. Al año siguiente, descubrieron cesio en el agua mineral de Bad Dürkheim, Alemania. Su descubrimiento de rubidio se produjo al año siguiente en Heidelberg, Alemania, encontrándolo en el mineral lepidolita. Los nombres de rubidio y cesio provienen de las líneas más prominentes en sus espectros de emisión: una línea roja brillante para el rubidio (de la palabra latina rubidus, que significa rojo oscuro o rojo brillante), y una línea azul cielo línea para cesio (derivado de la palabra latina caesius, que significa azul cielo).
Alrededor de 1865, John Newlands produjo una serie de artículos en los que enumeraba los elementos en orden creciente de peso atómico y propiedades físicas y químicas similares que se repetían en intervalos de ocho; comparó tal periodicidad con las octavas de la música, donde las notas separadas por una octava tienen funciones musicales similares. Su versión agrupaba todos los metales alcalinos entonces conocidos (de litio a cesio), así como cobre, plata y talio (que muestran el estado de oxidación +1 característico de los metales alcalinos). Su mesa colocó hidrógeno con los halógenos.
Después de 1869, Dmitri Mendeleev propuso su tabla periódica colocando el litio en la parte superior de un grupo con sodio, potasio, rubidio, cesio y talio. Dos años más tarde, Mendeleev revisó su tabla, colocando el hidrógeno en el grupo 1 por encima del litio y también moviendo el talio al grupo del boro. En esta versión de 1871, el cobre, la plata y el oro se colocaron dos veces, una como parte del grupo IB y otra como parte de un "grupo VIII" que abarca los grupos actuales del 8 al 11. Después de la introducción de la tabla de 18 columnas, los elementos del grupo IB se movieron a su posición actual en el bloque d, mientras que los metales alcalinos quedaron en el grupo IA. Posteriormente, el nombre del grupo se cambió a grupo 1 en 1988. El nombre trivial "metales alcalinos" proviene del hecho de que los hidróxidos de los elementos del grupo 1 son todos álcalis fuertes cuando se disuelven en agua.
Hubo al menos cuatro descubrimientos erróneos e incompletos antes de que Marguerite Perey, del Instituto Curie de París, Francia, descubriera el francio en 1939 al purificar una muestra de actinio-227, que se había informado que tenía una energía de descomposición de 220 keV. Sin embargo, Perey notó partículas de descomposición con un nivel de energía por debajo de 80 keV. Perey pensó que esta actividad de descomposición podría haber sido causada por un producto de descomposición no identificado previamente, uno que se separó durante la purificación, pero emergió nuevamente del actinio-227 puro. Varias pruebas eliminaron la posibilidad de que el elemento desconocido fuera torio, radio, plomo, bismuto o talio. El nuevo producto exhibió propiedades químicas de un metal alcalino (como la coprecipitación con sales de cesio), lo que llevó a Perey a creer que era el elemento 87, causado por la desintegración alfa del actinio-227. Perey luego intentó determinar la proporción de desintegración beta a desintegración alfa en el actinio-227. Su primera prueba puso la ramificación alfa en 0,6 %, una cifra que luego revisó a 1 %.
El siguiente elemento debajo del francio (eka-francio) en la tabla periódica sería el ununenio (Uue), elemento 119. La síntesis de ununenio se intentó por primera vez en 1985 bombardeando un objetivo de einstenio-254 con iones de calcio-48 en el acelerador superHILAC en Berkeley, California. No se identificaron átomos, lo que llevó a un rendimiento límite de 300 nb.
Es muy poco probable que esta reacción sea capaz de crear átomos de ununenio en un futuro próximo, dada la tarea extremadamente difícil de producir cantidades suficientes de einstenio-254, que se favorece para la producción de elementos ultrapesados debido a su gran masa, vida media relativamente larga de 270 días y disponibilidad en cantidades significativas de varios microgramos, para hacer un objetivo lo suficientemente grande para aumentar la sensibilidad del experimento al nivel requerido; El einstenio no se ha encontrado en la naturaleza y solo se ha producido en laboratorios, y en cantidades menores que las necesarias para la síntesis efectiva de elementos superpesados. Sin embargo, dado que el ununenio es solo el primer elemento del período 8 en la tabla periódica extendida, es posible que se descubra en un futuro cercano a través de otras reacciones y, de hecho, actualmente se está intentando sintetizarlo en Japón. Actualmente, ninguno de los elementos del período 8 ha sido descubierto todavía, y también es posible, debido a inestabilidades por goteo, que solo los elementos inferiores del período 8, hasta alrededor del elemento 128, sean físicamente posibles. No se han realizado intentos de síntesis de metales alcalinos más pesados: debido a su número atómico extremadamente alto, se necesitarían métodos y tecnología nuevos y más potentes para fabricarlos.

La regla de Oddo-Harkins sostiene que los elementos con números atómicos pares son más comunes que aquellos con números atómicos impares, con la excepción del hidrógeno. Esta regla argumenta que los elementos con números atómicos impares tienen un protón desapareado y es más probable que capturen otro, aumentando así su número atómico. En elementos con números atómicos pares, los protones están emparejados, con cada miembro del par compensando el espín del otro, mejorando la estabilidad. Todos los metales alcalinos tienen números atómicos impares y no son tan comunes como los elementos con números atómicos pares adyacentes a ellos (los gases nobles y los metales alcalinotérreos) en el Sistema Solar. Los metales alcalinos más pesados también son menos abundantes que los más livianos, ya que los metales alcalinos desde el rubidio en adelante solo pueden sintetizarse en supernovas y no en nucleosíntesis estelar. El litio también es mucho menos abundante que el sodio y el potasio, ya que se sintetiza de manera deficiente tanto en la nucleosíntesis del Big Bang como en las estrellas: el Big Bang solo pudo producir pequeñas cantidades de litio, berilio y boro debido a la ausencia de un núcleo estable con 5 u 8 Los nucleones y la nucleosíntesis estelar solo podrían superar este cuello de botella mediante el proceso triple alfa, fusionando tres núcleos de helio para formar carbono y saltándose esos tres elementos.
La Tierra se formó a partir de la misma nube de materia que formó el Sol, pero los planetas adquirieron diferentes composiciones durante la formación y evolución del sistema solar. A su vez, la historia natural de la Tierra hizo que partes de este planeta tuvieran diferentes concentraciones de los elementos. La masa de la Tierra es de aproximadamente 5,98×1024 kg. Se compone principalmente de hierro (32,1 %), oxígeno (30,1 %), silicio (15,1 %), magnesio (13,9 %), azufre (2,9 %), níquel (1,8 %), calcio (1,5 %) y aluminio (1,4%); y el 1,2% restante consiste en trazas de otros elementos. Debido a la diferenciación planetaria, se cree que la región central está compuesta principalmente de hierro (88,8 %), con cantidades más pequeñas de níquel (5,8 %), azufre (4,5 %) y menos del 1 % de oligoelementos.
Los metales alcalinos, debido a su alta reactividad, no se encuentran naturalmente en forma pura en la naturaleza. Son litófilos y, por lo tanto, permanecen cerca de la superficie de la Tierra porque se combinan fácilmente con el oxígeno y, por lo tanto, se asocian fuertemente con la sílice, formando minerales de densidad relativamente baja que no se hunden en el núcleo de la Tierra. El potasio, el rubidio y el cesio también son elementos incompatibles debido a sus grandes radios iónicos.
El sodio y el potasio son muy abundantes en la tierra, estando ambos entre los diez elementos más comunes en la corteza terrestre; El sodio constituye aproximadamente el 2,6 % de la corteza terrestre medida en peso, lo que lo convierte en el sexto elemento más abundante en general y el metal alcalino más abundante. El potasio constituye aproximadamente el 1,5% de la corteza terrestre y es el séptimo elemento más abundante. El sodio se encuentra en muchos minerales diferentes, de los cuales el más común es la sal común (cloruro de sodio), que se encuentra disuelto en grandes cantidades en el agua de mar. Otros depósitos sólidos incluyen halita, anfíbol, criolita, nitratina y zeolita. Muchos de estos depósitos sólidos se producen como resultado de la evaporación de mares antiguos, lo que todavía ocurre ahora en lugares como el Gran Lago Salado de Utah y el Mar Muerto. A pesar de su abundancia casi igual en la corteza terrestre, el sodio es mucho más común que el potasio en el océano, tanto porque el tamaño más grande del potasio hace que sus sales sean menos solubles, como porque el potasio se une a los silicatos en el suelo y lo que el potasio lixivia es absorbido mucho más fácilmente por la vida vegetal que el sodio.
A pesar de su similitud química, el litio normalmente no se presenta junto con el sodio o el potasio debido a su tamaño más pequeño. Debido a su reactividad relativamente baja, se puede encontrar en agua de mar en grandes cantidades; se estima que el agua de mar es de aproximadamente 0,14 a 0,25 partes por millón (ppm) o 25 micromolar. Su relación diagonal con el magnesio a menudo le permite reemplazar al magnesio en los minerales de ferromagnesio, donde su concentración en la corteza es de aproximadamente 18 ppm, comparable a la del galio y el niobio. Comercialmente, el mineral de litio más importante es la espodumena, que se encuentra en grandes depósitos en todo el mundo.
El rubidio es aproximadamente tan abundante como el zinc y más abundante que el cobre. Ocurre naturalmente en los minerales leucita, polucita, carnalita, zinnwaldita y lepidolita, aunque ninguno de estos contiene solo rubidio y ningún otro metal alcalino. El cesio es más abundante que algunos elementos comúnmente conocidos, como el antimonio, el cadmio, el estaño y el tungsteno, pero es mucho menos abundante que el rubidio.
El francio-223, el único isótopo de francio que se encuentra de forma natural, es el producto de la desintegración alfa del actinio-227 y se puede encontrar en pequeñas cantidades en los minerales de uranio. En una muestra dada de uranio, se estima que hay solo un átomo de francio por cada 1018 átomos de uranio. Se ha calculado que hay como máximo 30 gramos de francio en la corteza terrestre en cualquier momento, debido a su vida media extremadamente corta de 22 minutos.
Las propiedades físicas y químicas de los metales alcalinos pueden explicarse fácilmente porque tienen una configuración electrónica de valencia ns1, lo que da como resultado un enlace metálico débil. Por lo tanto, todos los metales alcalinos son blandos y tienen bajas densidades, puntos de fusión y ebullición, así como calores de sublimación, vaporización y disociación. Todos ellos cristalizan en la estructura cristalina cúbica centrada en el cuerpo y tienen colores de llama distintivos porque su electrón externo se excita muy fácilmente. La configuración ns1 también da como resultado que los metales alcalinos tengan radios atómicos e iónicos muy grandes, así como una conductividad térmica y eléctrica muy alta. Su química está dominada por la pérdida de su único electrón de valencia en el orbital s más externo para formar el estado de oxidación +1, debido a la facilidad de ionizar este electrón y la muy alta segunda energía de ionización. La mayor parte de la química se ha observado solo para los primeros cinco miembros del grupo. La química del francio no está bien establecida debido a su extrema radiactividad; por lo tanto, la presentación de sus propiedades aquí es limitada. Lo poco que se sabe sobre el francio muestra que tiene un comportamiento muy parecido al del cesio, como se esperaba. Las propiedades físicas del francio son aún más incompletas porque nunca se ha observado el elemento a granel; por lo tanto, los datos que se pueden encontrar en la literatura son ciertamente extrapolaciones especulativas.
| Nombre | Litio | Sodium | Potasio | Rubidium | Caesio | Francio |
|---|---|---|---|---|---|---|
| Número | 3 | 11 | 19 | 37 | 55 | 87 |
| Peso atómico estándar | 6.94(1) | 22.98976928 2) | 39.0983(1) | 85.4678(3) | 132.9054519(2) | [223] |
| Configuración electrónica | [Él] 2s1 | [Ne] 3s1 | [Ar] 4s1 | [Kr] 5s1 | [Xe] 6s1 | [Rn] 7s1 |
| Punto de fusión (°C) | 180.54 | 97.72 | 63.38 | 39.31 | 28.44 | ? |
| Punto de bobinado (°C) | 1342 | 883 | 759 | 688 | 671 | ? |
| Densidad (g·cm−3) | 0.534 | 0.968 | 0.89 | 1.532 | 1.93 | ? |
| Calor de fusión (kJ·mol−1) | 3.00 | 2.60 | 2.321 | 2.19 | 2.09 | ? |
| Calor de vaporización (kJ·mol−1) | 136 | 97.42 | 79.1 | 69 | 66.1 | ? |
| Calor de formación de gas monatómico (kJ·mol−1) | 162 | 108 | 89.6 | 82.0 | 78.2 | ? |
| Resistencia eléctrica a 25 °C (nΩ·cm) | 94,7 | 48.8 | 73,9 | 131 | 208 | ? |
| Radio atómico (pm) | 152 | 186 | 227 | 248 | 265 | ? |
| Radio iónico de hexacoordinado M+ iones (pm) | 76 | 102 | 138 | 152 | 167 | ? |
| First ionisation energy (kJ·mol−1) | 520.2 | 495,8 | 418.8 | 403.0 | 375,7 | 392.8 |
| Afinidad de electrones (kJ·mol−1) | 59.62 | 52.87 | 48.38 | 46.89 | 45.51 | ? |
| Enthalpy of dissociation of M2(kJ·mol−1) | 106,5 | 73.6 | 57.3 | 45,6 | 44.77 | ? |
| Electronegatividad paulatina | 0.98 | 0.93 | 0,82 | 0,82 | 0,79 | ? |
| Electronegatividad Allen | 0.91 | 0.87 | 0,73 | 0.71 | 0.66 | 0,677 |
| Potencial de electrodo estándar (E°(M+→M0); V) | −3.04 | −2.71 | −2.93 | −2.98 | −3.03 | ? |
| Color de prueba de llamas Principales emisiones/absorción longitud de onda (nm) | Crimson 670,8 | Amarillo 589.2 | Violet 766,5 | Red-violeta 780.0 | Azul 455,5 | ? |
Los metales alcalinos son más similares entre sí que los elementos de cualquier otro grupo entre sí. De hecho, la similitud es tan grande que es bastante difícil separar el potasio, el rubidio y el cesio, debido a sus radios iónicos similares; el litio y el sodio son más distintos. Por ejemplo, al moverse hacia abajo en la tabla, todos los metales alcalinos conocidos muestran un radio atómico creciente, electronegatividad decreciente, reactividad creciente y puntos de fusión y ebullición decrecientes, así como calores de fusión y vaporización. En general, sus densidades aumentan al descender en la tabla, con la excepción de que el potasio es menos denso que el sodio. Una de las pocas propiedades de los metales alcalinos que no muestra una tendencia muy suave es su potencial de reducción: el valor del litio es anómalo, siendo más negativo que los demás. Esto se debe a que el ion Li+ tiene una energía de hidratación muy alta en la fase gaseosa: aunque el ion de litio altera significativamente la estructura del agua, provocando un mayor cambio en la entropía, esta alta energía de hidratación es suficiente para hacen que los potenciales de reducción lo indiquen como el metal alcalino más electropositivo, a pesar de la dificultad de ionizarlo en fase gaseosa.
Los metales alcalinos estables son todos de color plateado excepto el cesio, que tiene un tono dorado pálido: es uno de los tres únicos metales que tienen un color claro (los otros dos son el cobre y el oro). Además, los metales alcalinotérreos pesados calcio, estroncio y bario, así como los lantánidos divalentes europio e iterbio, son de color amarillo pálido, aunque el color es mucho menos prominente que el del cesio. Su brillo se empaña rápidamente en el aire debido a la oxidación. Todos ellos cristalizan en la estructura cristalina cúbica centrada en el cuerpo y tienen colores de llama distintivos porque su electrón externo se excita muy fácilmente. De hecho, estos colores de prueba de llama son la forma más común de identificarlos, ya que todas sus sales con iones comunes son solubles.
Todos los metales alcalinos son altamente reactivos y nunca se encuentran en formas elementales en la naturaleza. Debido a esto, generalmente se almacenan en aceite mineral o queroseno (aceite de parafina). Reaccionan agresivamente con los halógenos para formar los haluros de metales alcalinos, que son compuestos cristalinos iónicos blancos que son todos solubles en agua excepto el fluoruro de litio (Li F). Los metales alcalinos también reaccionan con el agua para formar hidróxidos fuertemente alcalinos y, por lo tanto, deben manipularse con mucho cuidado. Los metales alcalinos más pesados reaccionan más vigorosamente que los más livianos; por ejemplo, cuando se deja caer en el agua, el cesio produce una explosión mayor que el potasio si se usa el mismo número de moles de cada metal. Los metales alcalinos tienen las energías de primera ionización más bajas en sus respectivos períodos de la tabla periódica debido a su baja carga nuclear efectiva y la capacidad de alcanzar una configuración de gas noble perdiendo solo un electrón. Los metales alcalinos no solo reaccionan con el agua, sino también con donantes de protones como alcoholes y fenoles, amoníaco gaseoso y alquinos, demostrando estos últimos el fenomenal grado de su reactividad. Su gran poder como agentes reductores los hace muy útiles para liberar otros metales de sus óxidos o haluros.
La segunda energía de ionización de todos los metales alcalinos es muy alta ya que se encuentra en una capa completa que también está más cerca del núcleo; por lo tanto, casi siempre pierden un solo electrón, formando cationes. Los alcalinos son una excepción: son compuestos inestables que contienen metales alcalinos en un estado de oxidación -1, lo cual es muy inusual ya que antes del descubrimiento de los alcaluros, no se esperaba que los metales alcalinos pudieran formar aniones y se pensaba que eran capaz de aparecer en sales sólo como cationes. Los aniones alcalinos tienen subcapas s llenas, lo que les da suficiente estabilidad para existir. Se sabe que todos los metales alcalinos estables, excepto el litio, pueden formar alcaluros, y los alcaluros tienen mucho interés teórico debido a su estequiometría inusual y bajos potenciales de ionización. Los alcaluros son químicamente similares a los electruros, que son sales con electrones atrapados que actúan como aniones. Un ejemplo particularmente llamativo de un alcaluro es el "hidruro de sodio inverso", H+Na− (ambos iones forman un complejo), a diferencia del sodio habitual hidruro, Na+H−: es inestable en forma aislada, debido a su alta energía resultante del desplazamiento de dos electrones del hidrógeno al sodio, aunque se prevé que varios derivados ser metaestable o estable.
En solución acuosa, los iones de metales alcalinos forman iones acuosos de fórmula [M(H2O)n] +, donde n es el número de solución. Sus números de coordinación y formas concuerdan bien con los esperados de sus radios iónicos. En solución acuosa, se dice que las moléculas de agua unidas directamente al ion metálico pertenecen a la primera esfera de coordinación, también conocida como capa de solvatación primera o primaria. El enlace entre una molécula de agua y el ion metálico es un enlace covalente dativo, con el átomo de oxígeno donando ambos electrones al enlace. Cada molécula de agua coordinada puede estar unida por enlaces de hidrógeno a otras moléculas de agua. Se dice que estos últimos residen en la segunda esfera de coordinación. Sin embargo, para los cationes de metales alcalinos, la segunda esfera de coordinación no está bien definida ya que la carga +1 en el catión no es lo suficientemente alta como para polarizar las moléculas de agua en la capa de solvatación primaria lo suficiente como para que formen enlaces de hidrógeno fuertes con las de la capa de solvatación primaria. la segunda esfera de coordinación, produciendo una entidad más estable. Se ha determinado experimentalmente que el número de solvatación de Li+ es 4, formando el tetraédrico [Li(H2O)4] +: si bien se han encontrado números de solvatación de 3 a 6 para los iones de agua de litio, los números de solvatación inferiores a 4 pueden ser el resultado de la formación de pares de iones de contacto, y los números de solvatación más altos pueden interpretarse en términos de agua moléculas que se acercan a [Li(H2O)4]+ a través de una cara del tetraedro, aunque las simulaciones de dinámica molecular pueden indicar la existencia de un ion hexaaqua octaédrico. También hay probablemente seis moléculas de agua en la esfera de solvatación primaria del ion de sodio, formando el octaédrico [Na(H2O)6]+ ión. Si bien anteriormente se pensaba que los metales alcalinos más pesados también formaban iones hexaaqua octaédricos, desde entonces se descubrió que el potasio y el rubidio probablemente forman el [K(H2O)8 ]+ y [Rb(H2O)8]+ iones, que tienen la estructura cuadrada antiprismática, y que el cesio forma el ion de coordenadas 12 [Cs(H2O)12]+.
La química del litio muestra varias diferencias con respecto al resto del grupo, ya que el pequeño catión Li+ polariza los aniones y otorga a sus compuestos un carácter más covalente. El litio y el magnesio tienen una relación diagonal debido a sus radios atómicos similares, por lo que muestran algunas similitudes. Por ejemplo, el litio forma un nitruro estable, una propiedad común entre todos los metales alcalinotérreos (grupo del magnesio) pero única entre los metales alcalinos. Además, entre sus respectivos grupos, solo el litio y el magnesio forman compuestos organometálicos con un carácter covalente significativo (por ejemplo, LiMe y MgMe2).
El fluoruro de litio es el único haluro de metal alcalino que es poco soluble en agua, y el hidróxido de litio es el único hidróxido de metal alcalino que no es delicuescente. Por el contrario, el perclorato de litio y otras sales de litio con aniones grandes que no se pueden polarizar son mucho más estables que los compuestos análogos de otros metales alcalinos, probablemente porque el Li+ tiene una alta energía de solvatación. Este efecto también significa que la mayoría de las sales de litio simples se encuentran comúnmente en forma hidratada, porque las formas anhidras son extremadamente higroscópicas: esto permite que sales como el cloruro de litio y el bromuro de litio se usen en deshumidificadores y acondicionadores de aire.
También se prevé que el francio muestre algunas diferencias debido a su alto peso atómico, lo que hace que sus electrones viajen a fracciones considerables de la velocidad de la luz y, por lo tanto, hace que los efectos relativistas sean más prominentes. En contraste con la tendencia de electronegatividades y energías de ionización decrecientes de los metales alcalinos, se prevé que la electronegatividad y la energía de ionización del francio sean más altas que las del cesio debido a la estabilización relativista de los electrones 7s; además, se espera que su radio atómico sea anormalmente bajo. Así, contrariamente a lo esperado, el cesio es el más reactivo de los metales alcalinos, no el francio. Todas las propiedades físicas conocidas del francio también se desvían de las tendencias claras que van del litio al cesio, como la primera energía de ionización, la afinidad electrónica y la polarizabilidad del anión, aunque debido a la escasez de datos conocidos sobre el francio, muchas fuentes dan valores extrapolados, ignorando que los efectos relativistas hacen que la tendencia del litio al cesio se vuelva inaplicable en el francio. Algunas de las pocas propiedades del francio que se han predicho teniendo en cuenta la relatividad son la afinidad electrónica (47,2 kJ/mol) y la entalpía de disociación de la molécula Fr2 (42,1 kJ/mol). La molécula de CsFr está polarizada como Cs+Fr−, lo que demuestra que la subcapa 7s del francio se ve mucho más afectada por los efectos relativistas que la subcapa 6s del cesio. Además, se espera que el superóxido de francio (FrO2) tenga un carácter covalente significativo, a diferencia de otros superóxidos de metales alcalinos, debido a las contribuciones de enlace de los electrones 6p del francio.
| Z | Alkali metal | Stable | Decays | inestable: cursiva isótopos de color rosa | ||
|---|---|---|---|---|---|---|
| 3 | litio | 2 | — | 7 Li | 6 Li | |
| 11 | sodio | 1 | — | 23 Na | ||
| 19 | potasio | 2 | 1 | 39 K | 41 K | 40 K |
| 37 | rubidium | 1 | 1 | 85 Rb | 87 Rb | |
| 55 | cesio | 1 | — | 133 Cs | ||
| 87 | francio | — | — | No hay isótopos primordiales ()223 Fr. es un nuclido radiogénico) | ||
| Radioactivo: 40K, t1/2 1.25 × 109 años; 87Rb, t1/2 4.9 × 1010 años; 223Fr. t1/2 22.0 min. | ||||||
Todos los metales alcalinos tienen números atómicos impares; por lo tanto, sus isótopos deben ser impares impares (tanto el número de protones como el de neutrones son impares) o impares pares (el número de protones es impar, pero el número de neutrones es par). Los núcleos impares tienen números de masa pares, mientras que los núcleos pares e impares tienen números de masa impares. Los nucleidos primordiales impares son raros porque la mayoría de los núcleos impares son muy inestables con respecto a la desintegración beta, porque los productos de desintegración son pares-pares y, por lo tanto, están más fuertemente unidos debido a los efectos de emparejamiento nuclear.
Debido a la gran rareza de los núcleos impares, casi todos los isótopos primordiales de los metales alcalinos son pares o impares (las excepciones son el isótopo estable a la luz litio-6 y el radioisótopo de larga vida potasio-40). Para un número de masa impar dado, solo puede haber un único nucleido estable beta, ya que no hay una diferencia en la energía de enlace entre par-impar e impar-par comparable a la que existe entre par-par e impar-impar, dejando otros nucleidos del mismo número de masa (isobaras) libres de desintegración beta hacia el nucleido de menor masa. Un efecto de la inestabilidad de un número impar de cualquier tipo de nucleones es que los elementos impares, como los metales alcalinos, tienden a tener menos isótopos estables que los elementos pares. De los 26 elementos monoisotópicos que tienen un solo isótopo estable, todos menos uno tienen un número atómico impar y todos menos uno también tienen un número par de neutrones. El berilio es la única excepción a ambas reglas, debido a su bajo número atómico.
Todos los metales alcalinos excepto el litio y el cesio tienen al menos un radioisótopo natural: el sodio-22 y el sodio-24 son trazas de radioisótopos producidos cosmogénicamente, el potasio-40 y el rubidio-87 tienen vidas medias muy largas y, por lo tanto, ocurren naturalmente, y todos los isótopos de francio son radiactivos. También se pensó que el cesio era radiactivo a principios del siglo XX, aunque no tiene radioisótopos naturales. (El francio aún no se había descubierto en ese momento). El radioisótopo natural de vida prolongada del potasio, el potasio-40, constituye aproximadamente el 0,012% del potasio natural y, por lo tanto, el potasio natural es débilmente radiactivo. Esta radiactividad natural se convirtió en la base de una afirmación errónea del descubrimiento del elemento 87 (el siguiente metal alcalino después del cesio) en 1925. El rubidio natural es igualmente ligeramente radiactivo, con un 27,83 % del radioisótopo rubidio-87 de vida prolongada.
El cesio-137, con una vida media de 30,17 años, es uno de los dos principales productos de fisión de vida media, junto con el estroncio-90, que son responsables de la mayor parte de la radiactividad del combustible nuclear gastado después de varios años de enfriamiento, hasta varios cientos de años después de su uso. Constituye la mayor parte de la radiactividad que aún queda del accidente de Chernóbil. El cesio-137 sufre una desintegración beta de alta energía y finalmente se convierte en bario-137 estable. Es un fuerte emisor de radiación gamma. El cesio-137 tiene una tasa muy baja de captura de neutrones y no se puede eliminar de esta manera, pero se debe permitir que se desintegre. El cesio-137 se ha utilizado como marcador en estudios hidrológicos, de manera análoga al uso de tritio. Se liberaron pequeñas cantidades de cesio-134 y cesio-137 en el medio ambiente durante casi todas las pruebas de armas nucleares y algunos accidentes nucleares, en particular el accidente de Goiânia y el desastre de Chernobyl. A partir de 2005, el cesio-137 es la principal fuente de radiación en la zona de alienación alrededor de la central nuclear de Chernóbil. Sus propiedades químicas como uno de los metales alcalinos lo convierten en uno de los productos de fisión de vida corta a mediana más problemáticos porque se mueve y se propaga fácilmente en la naturaleza debido a la alta solubilidad en agua de sus sales, y es absorbido por el cuerpo, que lo confunde con sus congéneres esenciales sodio y potasio.
Los metales alcalinos son más similares entre sí que los elementos de cualquier otro grupo entre sí. Por ejemplo, al moverse hacia abajo en la tabla, todos los metales alcalinos conocidos muestran un radio atómico creciente, electronegatividad decreciente, reactividad creciente y puntos de fusión y ebullición decrecientes, así como calores de fusión y vaporización. En general, sus densidades aumentan al descender en la tabla, con la excepción de que el potasio es menos denso que el sodio.
Los radios atómicos de los metales alcalinos aumentan al descender en el grupo. Debido al efecto de protección, cuando un átomo tiene más de una capa de electrones, cada electrón siente la repulsión eléctrica de los otros electrones, así como la atracción eléctrica del núcleo. En los metales alcalinos, el electrón más externo solo siente una carga neta de +1, ya que parte de la carga nuclear (que es igual al número atómico) es cancelada por los electrones internos; el número de electrones internos de un metal alcalino es siempre uno menos que la carga nuclear. Por lo tanto, el único factor que afecta el radio atómico de los metales alcalinos es el número de capas de electrones. Dado que este número aumenta hacia abajo en el grupo, el radio atómico también debe aumentar hacia abajo en el grupo.
Los radios iónicos de los metales alcalinos son mucho más pequeños que sus radios atómicos. Esto se debe a que el electrón más externo de los metales alcalinos está en una capa de electrones diferente a la de los electrones internos y, por lo tanto, cuando se elimina, el átomo resultante tiene una capa de electrones menos y es más pequeño. Además, la carga nuclear efectiva ha aumentado, por lo que los electrones son atraídos con más fuerza hacia el núcleo y el radio iónico disminuye.
La primera energía de ionización de un elemento o molécula es la energía requerida para mover el electrón más suelto de un mol de átomos gaseosos del elemento o moléculas para formar un mol de iones gaseosos con carga eléctrica +1. Los factores que afectan la primera energía de ionización son la carga nuclear, la cantidad de blindaje de los electrones internos y la distancia del núcleo al electrón más suelto, que siempre es un electrón externo en los elementos del grupo principal. Los primeros dos factores cambian la carga nuclear efectiva que siente el electrón más suelto. Dado que el electrón más externo de los metales alcalinos siempre siente la misma carga nuclear efectiva (+1), el único factor que afecta la primera energía de ionización es la distancia desde el electrón más externo al núcleo. Dado que esta distancia aumenta hacia abajo en el grupo, el electrón más externo siente menos atracción por parte del núcleo y, por lo tanto, la primera energía de ionización disminuye. (Esta tendencia se rompe en el francio debido a la estabilización relativista y la contracción del orbital 7s, acercando el electrón de valencia del francio al núcleo de lo que se esperaría de los cálculos no relativistas. Esto hace que el electrón más externo del francio siente más atracción del núcleo, aumentando su primera energía de ionización ligeramente más allá de la del cesio).
La segunda energía de ionización de los metales alcalinos es mucho más alta que la primera, ya que el segundo electrón más suelto es parte de una capa de electrones completamente llena y, por lo tanto, es difícil de eliminar.
Las reactividades de los metales alcalinos aumentan al descender en el grupo. Este es el resultado de una combinación de dos factores: las primeras energías de ionización y las energías de atomización de los metales alcalinos. Debido a que la primera energía de ionización de los metales alcalinos disminuye en el grupo, es más fácil que el electrón más externo se elimine del átomo y participe en reacciones químicas, aumentando así la reactividad en el grupo. La energía de atomización mide la fuerza del enlace metálico de un elemento, que cae en el grupo a medida que los átomos aumentan de radio y, por lo tanto, el enlace metálico debe aumentar en longitud, haciendo que los electrones deslocalizados se alejen más de la atracción de los núcleos de los más pesados. Metales alcalinos. Sumando las energías de atomización y primera ionización se obtiene una cantidad estrechamente relacionada (pero no igual) a la energía de activación de la reacción de un metal alcalino con otra sustancia. Esta cantidad disminuye al descender en el grupo, al igual que la energía de activación; por lo tanto, las reacciones químicas pueden ocurrir más rápido y la reactividad aumenta en el grupo.
La electronegatividad es una propiedad química que describe la tendencia de un átomo o un grupo funcional a atraer electrones (o densidad electrónica) hacia sí mismo. Si el enlace entre el sodio y el cloro en el cloruro de sodio fuera covalente, el par de electrones compartidos se sentirían atraídos por el cloro porque la carga nuclear efectiva de los electrones externos es +7 en el cloro pero es solo +1 en el sodio. El par de electrones es atraído tan cerca del átomo de cloro que prácticamente se transfieren al átomo de cloro (un enlace iónico). Sin embargo, si el átomo de sodio fue reemplazado por un átomo de litio, los electrones no serán atraídos tan cerca del átomo de cloro como antes porque el átomo de litio es más pequeño, lo que hace que el par de electrones sea más atraído por la carga nuclear efectiva más cercana del litio. Por lo tanto, los átomos de metal alcalino más grandes (más abajo en el grupo) serán menos electronegativos ya que el par de enlace se siente menos atraído hacia ellos. Como se mencionó anteriormente, se espera que el francio sea una excepción.
Debido a la mayor electronegatividad del litio, algunos de sus compuestos tienen un carácter más covalente. Por ejemplo, el yoduro de litio (Li I) se disolverá en solventes orgánicos, una propiedad de la mayoría de los compuestos covalentes. El fluoruro de litio (LiF) es el único haluro alcalino que no es soluble en agua, y el hidróxido de litio (LiOH) es el único hidróxido de metal alcalino que no es delicuescente.
El punto de fusión de una sustancia es el punto donde cambia de estado sólido a líquido, mientras que el punto de ebullición de una sustancia (en estado líquido) es el punto donde la presión de vapor del líquido es igual a la presión ambiental que rodea al líquido y todo el líquido cambia de estado a gas. A medida que un metal se calienta hasta su punto de fusión, los enlaces metálicos que mantienen a los átomos en su lugar se debilitan para que los átomos puedan moverse, y los enlaces metálicos finalmente se rompen por completo en el punto de ebullición del metal. Por lo tanto, los puntos de fusión y ebullición decrecientes de los metales alcalinos indican que la fuerza de los enlaces metálicos de los metales alcalinos disminuye hacia abajo en el grupo. Esto se debe a que los átomos de metal se mantienen unidos por la atracción electromagnética de los iones positivos a los electrones deslocalizados. A medida que los átomos aumentan de tamaño al descender en el grupo (porque su radio atómico aumenta), los núcleos de los iones se alejan más de los electrones deslocalizados y, por lo tanto, el enlace metálico se vuelve más débil para que el metal pueda fundirse y hervir más fácilmente, lo que reduce los puntos de fusión y ebullición. (El aumento de la carga nuclear no es un factor relevante debido al efecto de protección).
Todos los metales alcalinos tienen la misma estructura cristalina (cúbica centrada en el cuerpo) y, por lo tanto, los únicos factores relevantes son la cantidad de átomos que pueden caber en un volumen determinado y la masa de uno de los átomos, ya que la densidad se define como masa por unidad de volumen. El primer factor depende del volumen del átomo y por tanto del radio atómico, que aumenta al descender en el grupo; así, el volumen de un átomo de metal alcalino aumenta al descender en el grupo. La masa de un átomo de metal alcalino también aumenta al descender en el grupo. Así, la tendencia de las densidades de los metales alcalinos depende de sus pesos atómicos y radios atómicos; si se conocen las cifras de estos dos factores, se pueden calcular las relaciones entre las densidades de los metales alcalinos. La tendencia resultante es que las densidades de los metales alcalinos aumentan en la tabla, con excepción del potasio. Debido a que tienen el peso atómico más bajo y el radio atómico más grande de todos los elementos en sus períodos, los metales alcalinos son los metales menos densos en la tabla periódica. El litio, el sodio y el potasio son los únicos tres metales de la tabla periódica que son menos densos que el agua: de hecho, el litio es el sólido conocido menos denso a temperatura ambiente.
Los metales alcalinos forman una serie completa de compuestos con todos los aniones que se encuentran habitualmente, que ilustran bien las tendencias de los grupos. Estos compuestos pueden describirse como compuestos en los que los metales alcalinos pierden electrones hacia las especies aceptoras y forman iones monopositivos. Esta descripción es más precisa para los haluros alcalinos y se vuelve cada vez menos precisa a medida que aumenta la carga catiónica y aniónica, y a medida que el anión se vuelve más grande y más polarizable. Por ejemplo, el enlace iónico da paso al enlace metálico a lo largo de la serie NaCl, Na2O, Na2S, Na3P, Na3As, Na3Sb, Na3Bi, Na.
Todos los metales alcalinos reaccionan de forma vigorosa o explosiva con agua fría, produciendo una solución acuosa de un hidróxido de metal alcalino fuertemente básico y liberando gas hidrógeno. Esta reacción se vuelve más vigorosa al descender en el grupo: el litio reacciona constantemente con efervescencia, pero el sodio y el potasio pueden encenderse, y el rubidio y el cesio se hunden en el agua y generan gas hidrógeno tan rápidamente que se forman ondas de choque en el agua que pueden romper los recipientes de vidrio. Cuando un metal alcalino se deja caer en el agua, produce una explosión, de la cual hay dos etapas separadas. El metal reacciona primero con el agua, rompiendo los enlaces de hidrógeno en el agua y produciendo hidrógeno gaseoso; esto ocurre más rápido para los metales alcalinos pesados más reactivos. En segundo lugar, el calor generado por la primera parte de la reacción a menudo enciende el gas de hidrógeno, lo que hace que se queme de forma explosiva en el aire circundante. Esta explosión secundaria de gas hidrógeno produce la llama visible sobre el cuenco de agua, el lago u otra masa de agua, no la reacción inicial del metal con el agua (que tiende a ocurrir principalmente bajo el agua). Los hidróxidos de metales alcalinos son los hidróxidos más básicos conocidos.
Investigaciones recientes han sugerido que el comportamiento explosivo de los metales alcalinos en el agua es impulsado por una explosión de Coulomb y no únicamente por la rápida generación de hidrógeno. Todos los metales alcalinos se derriten como parte de la reacción con el agua. Las moléculas de agua ionizan la superficie metálica desnuda del metal líquido, dejando una superficie metálica cargada positivamente e iones de agua cargados negativamente. La atracción entre el metal cargado y los iones de agua aumentará rápidamente el área superficial, provocando un aumento exponencial de la ionización. Cuando las fuerzas repulsivas dentro de la superficie del metal líquido exceden las fuerzas de la tensión superficial, explota vigorosamente.
Los hidróxidos en sí mismos son los hidróxidos más básicos que se conocen, reaccionando con ácidos para dar sales y con alcoholes para dar alcóxidos oligoméricos. Reaccionan fácilmente con dióxido de carbono para formar carbonatos o bicarbonatos, o con sulfuro de hidrógeno para formar sulfuros o bisulfuros, y pueden usarse para separar tioles del petróleo. Reaccionan con óxidos anfóteros: por ejemplo, los óxidos de aluminio, zinc, estaño y plomo reaccionan con los hidróxidos de metales alcalinos para dar aluminatos, zincatos, estanatos y plumbatos. El dióxido de silicio es ácido y, por lo tanto, los hidróxidos de metales alcalinos también pueden atacar el vidrio de silicato.
Los metales alcalinos forman muchos compuestos intermetálicos entre sí y con los elementos de los grupos 2 a 13 en la tabla periódica de diferentes estequiometrías, como las amalgamas de sodio con mercurio, incluido el Na5Hg8 y Na3Hg. Algunos de estos tienen características iónicas: tomando como ejemplo las aleaciones con oro, el más electronegativo de los metales, NaAu y KAu son metálicos, pero RbAu y CsAu son semiconductores. El NaK es una aleación de sodio y potasio muy útil porque es líquido a temperatura ambiente, aunque hay que tener precauciones por su extrema reactividad con el agua y el aire. La mezcla eutéctica funde a -12,6 °C. Una aleación de 41 % de cesio, 47 % de sodio y 12 % de potasio tiene el punto de fusión más bajo conocido de cualquier metal o aleación, −78 °C.
Los compuestos intermetálicos de los metales alcalinos con los elementos más pesados del grupo 13 (aluminio, galio, indio y talio), como el NaTl, son malos conductores o semiconductores, a diferencia de las aleaciones normales con los elementos anteriores, lo que implica que el álcali metal involucrado ha perdido un electrón a los aniones Zintl involucrados. Sin embargo, mientras que los elementos del grupo 14 y posteriores tienden a formar grupos aniónicos discretos, los elementos del grupo 13 tienden a formar iones poliméricos con los cationes de metales alcalinos ubicados entre la red iónica gigante. Por ejemplo, NaTl consiste en un anión polimérico (—Tl−—)n con una estructura cúbica de diamante covalente con iones Na+ ubicados entre los red aniónica. Los metales alcalinos más grandes no pueden encajar de manera similar en una red aniónica y tienden a forzar a los elementos más pesados del grupo 13 a formar grupos aniónicos.
El boro es un caso especial, ya que es el único no metal del grupo 13. Los boruros de metales alcalinos tienden a ser ricos en boro, lo que implica un enlace boro-boro apreciable con estructuras deltaédricas, y son térmicamente inestables debido a que los metales alcalinos tienen una alta presión de vapor a temperaturas elevadas. Esto hace que la síntesis directa sea problemática porque los metales alcalinos no reaccionan con el boro por debajo de los 700 °C y, por lo tanto, esto debe realizarse en recipientes sellados con el metal alcalino en exceso. Además, excepcionalmente en este grupo, la reactividad con el boro disminuye hacia abajo en el grupo: el litio reacciona completamente a 700 °C, pero el sodio a 900 °C y el potasio no hasta los 1200 °C, y la reacción es instantánea para el litio pero toma horas para el potasio. Los boruros de rubidio y cesio ni siquiera han sido caracterizados. Se conocen varias fases, como LiB10, NaB6, NaB15 y KB6. Bajo alta presión, el enlace boro-boro en los boruros de litio cambia de seguir las reglas de Wade a formar aniones Zintl como el resto del grupo 13.
El litio y el sodio reaccionan con el carbono para formar acetiluros, Li2C2 y Na2C2, que también se puede obtener por reacción del metal con acetileno. El potasio, el rubidio y el cesio reaccionan con el grafito; sus átomos se intercalan entre las capas hexagonales de grafito, formando compuestos de intercalación de grafito de fórmulas MC60 (gris oscuro, casi negro), MC48 (gris oscuro, casi negro), MC36 (azul), MC24 (azul acero) y MC8 (bronce) (M = K, Rb o Cs). Estos compuestos son 200 veces más conductores de la electricidad que el grafito puro, lo que sugiere que el electrón de valencia del metal alcalino se transfiere a las capas de grafito (por ejemplo, M+C−8). Al calentar KC8, la eliminación de los átomos de potasio da como resultado la conversión en secuencia a KC24, KC36, KC48 y finalmente KC60. KC8 es un agente reductor muy fuerte y es pirofórico y explota al contacto con el agua. Mientras que los metales alcalinos más grandes (K, Rb y Cs) forman inicialmente MC8, los más pequeños forman inicialmente MC6 y, de hecho, requieren la reacción de los metales con el grafito. a altas temperaturas alrededor de 500 °C para formar. Aparte de esto, los metales alcalinos son agentes reductores tan fuertes que incluso pueden reducir el buckminsterfullereno para producir fulleruros sólidos MnC60; el sodio, el potasio, el rubidio y el cesio pueden formar fulléridos donde n = 2, 3, 4 o 6, y el rubidio y el cesio también pueden alcanzar n = 1.
Cuando los metales alcalinos reaccionan con los elementos más pesados del grupo del carbono (silicio, germanio, estaño y plomo), se forman sustancias iónicas con estructuras enjauladas, como los siliciuros M4 Si4 (M = K, Rb o Cs), que contiene M+ y tetraédrica Si4−4 iones. La química de los germanuros de metales alcalinos, que involucra el ion germanuro Ge4− y otros iones de grupo (Zintl) como Ge2−4, Ge 4−9, Ge2−9 y [(Ge9)2]6 −, es en gran parte análoga a la de los siliciuros correspondientes. Los estannuros de metales alcalinos son en su mayoría iónicos, a veces con el ion estannuro (Sn4−), y a veces con iones Zintl más complejos como Sn4−9, que aparece en el nonastannuro de tetrapotasio (K4Sn9). Se desconoce el ion plumbide monoatómico (Pb4−) y, de hecho, se predice que su formación será energéticamente desfavorable; Los plomos de metales alcalinos tienen iones Zintl complejos, como Pb4−9. Estos germanuros, estannuros y plumbidos de metales alcalinos se pueden producir reduciendo germanio, estaño y plomo con sodio metálico en amoníaco líquido.
El litio, el más ligero de los metales alcalinos, es el único metal alcalino que reacciona con el nitrógeno en condiciones estándar, y su nitruro es el único nitruro de metal alcalino estable. El nitrógeno es un gas no reactivo porque romper el fuerte triple enlace en la molécula de dinitrógeno (N2) requiere mucha energía. La formación de un nitruro de metal alcalino consumiría la energía de ionización del metal alcalino (formando iones M+), la energía necesaria para romper el triple enlace en N2 y la formación de iones N3-, y toda la energía liberada de la formación de un nitruro de metal alcalino proviene de la energía de red del nitruro de metal alcalino. La energía de la red se maximiza con iones pequeños y altamente cargados; los metales alcalinos no forman iones altamente cargados, solo forman iones con una carga de +1, por lo que solo el litio, el metal alcalino más pequeño, puede liberar suficiente energía de red para hacer que la reacción con nitrógeno sea exotérmica, formando nitruro de litio. Las reacciones de los otros metales alcalinos con nitrógeno no liberarían suficiente energía de red y, por lo tanto, serían endotérmicas, por lo que no forman nitruros en condiciones estándar. El nitruro de sodio (Na3N) y el nitruro de potasio (K3N), si bien existen, son extremadamente inestables, tienden a descomponerse nuevamente en sus elementos constituyentes y no pueden ser producido por la reacción de los elementos entre sí en condiciones estándar. El impedimento estérico prohíbe la existencia de nitruro de rubidio o cesio. Sin embargo, el sodio y el potasio forman sales de azida incoloras que involucran el N−3 lineales. anión; debido al gran tamaño de los cationes de metales alcalinos, son lo suficientemente estables térmicamente para poder fundirse antes de descomponerse.
Todos los metales alcalinos reaccionan rápidamente con fósforo y arsénico para formar fosfuros y arseniuros con la fórmula M3Pn (donde M representa un metal alcalino y Pn representa un pnictógeno: fósforo, arsénico, antimonio, o bismuto). Esto se debe al mayor tamaño de los iones P3− y As3−, por lo que se necesita liberar menos energía de red para que se formen las sales. Estos no son los únicos fosfuros y arseniuros de los metales alcalinos: por ejemplo, el potasio tiene nueve fosfuros diferentes conocidos, con fórmulas K3P, K4P3 , K5P4, KP, K4P6, K3 P7, K3P11, KP10.3 y KP15. Si bien la mayoría de los metales forman arseniuros, solo los metales alcalinos y alcalinotérreos forman principalmente arseniuros iónicos. La estructura del Na3As es compleja con distancias Na-Na inusualmente cortas de 328 a 330 pm que son más cortas que en el sodio metálico, y esto indica que incluso con estos metales electropositivos, el enlace no puede ser directamente iónico. Se conocen otros arseniuros de metales alcalinos que no se ajustan a la fórmula M3As, como el LiAs, que tiene un brillo metálico y una conductividad eléctrica que indica la presencia de algún enlace metálico. Las antimonidas son inestables y reactivas ya que el ion Sb3− es un fuerte agente reductor; la reacción de ellos con ácidos forma el gas tóxico e inestable estibina (SbH3). De hecho, tienen algunas propiedades metálicas, y los antimonuros de metales alcalinos de la estequiometría MSb involucran átomos de antimonio unidos en una estructura espiral de Zintl. Los bismuturos ni siquiera son totalmente iónicos; son compuestos intermetálicos que contienen enlaces parcialmente metálicos y parcialmente iónicos.
Todos los metales alcalinos reaccionan vigorosamente con el oxígeno en condiciones estándar. Forman varios tipos de óxidos, como óxidos simples (que contienen el ion O2−), peróxidos (que contienen el O2−2 ion, donde hay un enlace simple entre los dos átomos de oxígeno), superóxidos (que contienen la O−2 ion), y muchos otros. El litio se quema en el aire para formar óxido de litio, pero el sodio reacciona con el oxígeno para formar una mezcla de óxido de sodio y peróxido de sodio. El potasio forma una mezcla de peróxido de potasio y superóxido de potasio, mientras que el rubidio y el cesio forman el superóxido exclusivamente. Su reactividad aumenta al descender en el grupo: mientras que el litio, el sodio y el potasio simplemente se queman en el aire, el rubidio y el cesio son pirofóricos (se incendian espontáneamente en el aire).
Los metales alcalinos más pequeños tienden a polarizar los aniones más grandes (peróxido y superóxido) debido a su pequeño tamaño. Esto atrae los electrones de los aniones más complejos hacia uno de sus átomos de oxígeno constituyentes, formando un ion de óxido y un átomo de oxígeno. Esto hace que el litio forme el óxido exclusivamente al reaccionar con oxígeno a temperatura ambiente. Este efecto se vuelve drásticamente más débil para el sodio y el potasio más grandes, lo que les permite formar los peróxidos menos estables. El rubidio y el cesio, en la parte inferior del grupo, son tan grandes que incluso se pueden formar los superóxidos menos estables. Debido a que el superóxido libera la mayor cantidad de energía cuando se forma, el superóxido se forma preferentemente para los metales alcalinos más grandes donde los aniones más complejos no están polarizados. (Los óxidos y peróxidos de estos metales alcalinos existen, pero no se forman con la reacción directa del metal con el oxígeno en condiciones estándar). Además, el tamaño pequeño de Li+ y O2− contribuyen a que formen una estructura reticular iónica estable. Sin embargo, en condiciones controladas, se sabe que todos los metales alcalinos, con excepción del francio, forman sus óxidos, peróxidos y superóxidos. Los peróxidos y superóxidos de metales alcalinos son poderosos agentes oxidantes. El peróxido de sodio y el superóxido de potasio reaccionan con el dióxido de carbono para formar el carbonato de metal alcalino y el gas oxígeno, lo que permite su uso en purificadores de aire submarinos; la presencia de vapor de agua, naturalmente presente en el aliento, hace que la eliminación de dióxido de carbono por el superóxido de potasio sea aún más eficiente. Todos los metales alcalinos estables, excepto el litio, pueden formar ozónidos rojos (MO3) a través de la reacción a baja temperatura del hidróxido anhidro en polvo con el ozono: los ozónidos se pueden extraer luego con amoníaco líquido. Se descomponen lentamente en condiciones estándar en superóxidos y oxígeno, y se hidrolizan inmediatamente en hidróxidos cuando entran en contacto con el agua. El potasio, el rubidio y el cesio también forman sesquióxidos M2O3, que pueden considerarse mejor como disuperóxidos de peróxido, [(M+)4(O 2−2)(O−2)2].
El rubidio y el cesio pueden formar una gran variedad de subóxidos con los metales en estados de oxidación formales por debajo de +1. El rubidio puede formar Rb6O y Rb9O2 (de color cobre) al oxidarse en el aire, mientras que el cesio forma una inmensa variedad de óxidos, como el ozónido CsO3 y varios subóxidos de colores brillantes, como Cs7O (bronce), Cs4O (rojo-violeta), Cs11O3 (violeta), Cs3O (verde oscuro), CsO, Cs3 O2, así como Cs7O2. El último de estos puede calentarse al vacío para generar Cs2O.
Los metales alcalinos también pueden reaccionar de manera análoga con los calcógenos más pesados (azufre, selenio, telurio y polonio), y todos los calcogenuros de metales alcalinos son conocidos (a excepción del francio). La reacción con un exceso de calcógeno puede dar como resultado calcogenuros más bajos, con iones de calcógeno que contienen cadenas de los átomos de calcógeno en cuestión. Por ejemplo, el sodio puede reaccionar con el azufre para formar el sulfuro (Na2S) y varios polisulfuros con la fórmula Na2Sx ( x del 2 al 6), que contiene el S2−
x iones. Debido a la basicidad de los iones Se2− y Te2−, los seleniuros y telururos de metales alcalinos son alcalinos en solución; cuando reaccionan directamente con selenio y telurio, se forman poliselenuros y politelururos de metales alcalinos junto con los seleniuros y telururos con el Se2−
x y Te2−
x iones. Se pueden obtener directamente de los elementos en amoníaco líquido o cuando no hay aire, y son compuestos incoloros solubles en agua que el aire se oxida rápidamente de nuevo a selenio o telurio. Los polonidos de metales alcalinos son todos compuestos iónicos que contienen el ion Po2−; son muy estables químicamente y se pueden producir por reacción directa de los elementos a unos 300-400 °C.
Los metales alcalinos se encuentran entre los elementos más electropositivos de la tabla periódica y, por lo tanto, tienden a unirse iónicamente a los elementos más electronegativos de la tabla periódica, los halógenos (flúor, cloro, bromo, yodo y astato), formando sales conocidas como los haluros de metales alcalinos. La reacción es muy vigorosa y, en ocasiones, puede provocar explosiones. Se conocen los veinte haluros de metales alcalinos estables; los inestables no se conocen, a excepción del astato sódico, por la gran inestabilidad y rareza del astato y el francio. El más conocido de los veinte es sin duda el cloruro de sodio, también conocido como sal común. Todos los haluros de metales alcalinos estables tienen la fórmula MX, donde M es un metal alcalino y X es un halógeno. Todos son sólidos cristalinos iónicos blancos que tienen puntos de fusión altos. Todos los haluros de metales alcalinos son solubles en agua excepto el fluoruro de litio (LiF), que es insoluble en agua debido a su altísima entalpía de red. La alta entalpía de red del fluoruro de litio se debe a los pequeños tamaños de los iones Li+ y F−, lo que hace que las interacciones electrostáticas entre ellos sean fuertes: se produce un efecto similar para el fluoruro de magnesio, consistente con la relación diagonal entre el litio y el magnesio.
Los metales alcalinos también reaccionan de manera similar con el hidrógeno para formar hidruros de metales alcalinos iónicos, donde el anión hidruro actúa como un pseudohaluro: a menudo se usan como agentes reductores, produciendo hidruros, hidruros metálicos complejos o gas hidrógeno. También se conocen otros pseudohaluros, en particular los cianuros. Estos son isoestructurales para los haluros respectivos, excepto para el cianuro de litio, lo que indica que los iones de cianuro pueden girar libremente. Óxidos de halogenuros metálicos alcalinos ternarios, como Na3ClO, K3BrO (amarillo), Na4Br2O, Na4I2O y K4Br2O. Los polihaluros son bastante inestables, aunque los de rubidio y cesio están muy estabilizados por el débil poder polarizador de estos cationes extremadamente grandes.
Los cationes de metales alcalinos no suelen formar complejos de coordinación con bases de Lewis simples debido a su baja carga de solo +1 y su tamaño relativamente grande; por lo tanto, el ion Li+ forma la mayoría de los complejos y los iones de metales alcalinos más pesados forman cada vez menos (aunque se producen excepciones para los complejos débiles). El litio en particular tiene una química de coordinación muy rica en la que exhibe números de coordinación del 1 al 12, aunque la hexacoordinación octaédrica es su modo preferido. En solución acuosa, los iones de metales alcalinos existen como complejos hexahidratados octaédricos ([M(H2O)6)]+), con el excepción del ion litio, que debido a su pequeño tamaño forma complejos tetrahidratados tetraédricos ([Li(H2O)4)]+); los metales alcalinos forman estos complejos porque sus iones son atraídos por fuerzas electrostáticas de atracción hacia las moléculas polares de agua. Debido a esto, las sales anhidras que contienen cationes de metales alcalinos se utilizan a menudo como desecantes. Los metales alcalinos también forman fácilmente complejos con éteres corona (por ejemplo, 12-corona-4 para Li+, 15-corona-5 para Na+, 18-corona-6 para K + y 21-corona-7 para Rb+) y criptandos debido a la atracción electrostática.
Los metales alcalinos se disuelven lentamente en amoníaco líquido, formando soluciones amoniacales de catión metálico solvatado M+ y electrón solvatado e−, que reaccionan para formar hidrógeno gaseoso y el álcali amida metálica (MNH2, donde M representa un metal alcalino): esto fue observado por primera vez por Humphry Davy en 1809 y redescubierto por W. Weyl en 1864. El proceso puede acelerarse mediante un catalizador. Soluciones similares están formadas por los metales alcalinotérreos divalentes pesados calcio, estroncio, bario, así como los lantánidos divalentes, europio e iterbio. La sal de amida es bastante insoluble y precipita fácilmente de la solución, dejando soluciones amoniacales de los metales alcalinos intensamente coloreadas. En 1907, Charles Krause identificó que el color se debía a la presencia de electrones solvatados, que contribuyen a la alta conductividad eléctrica de estas soluciones. A bajas concentraciones (menos de 3 M), la solución es de color azul oscuro y tiene diez veces la conductividad del cloruro de sodio acuoso; en concentraciones más altas (por encima de 3 M), la solución es de color cobre y tiene aproximadamente la conductividad de los metales líquidos como el mercurio. Además de la sal de amida de metal alcalino y los electrones solvatados, tales soluciones de amoníaco también contienen el catión de metal alcalino (M+), el átomo de metal alcalino neutro (M), moléculas diatómicas de metal alcalino (M2) y aniones de metales alcalinos (M−). Estos son inestables y eventualmente se convierten en la amida de metal alcalino y el gas hidrógeno termodinámicamente más estables. Los electrones solvatados son poderosos agentes reductores y se utilizan a menudo en la síntesis química.
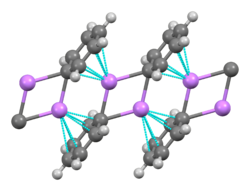
Al ser el metal alcalino más pequeño, el litio forma la variedad más amplia y los compuestos organometálicos más estables, que se unen de forma covalente. Los compuestos de organolitio son sólidos o líquidos volátiles eléctricamente no conductores que se funden a bajas temperaturas y tienden a formar oligómeros con la estructura (RLi)x donde R es el grupo orgánico. Como la naturaleza electropositiva del litio pone la mayor parte de la densidad de carga del enlace en el átomo de carbono, creando efectivamente un carbanión, los compuestos de organolitio son bases y nucleófilos extremadamente poderosos. Para uso como bases, los butillitios se usan a menudo y están disponibles comercialmente. Un ejemplo de un compuesto de organolitio es el metillitio ((CH3Li)x), que existe en tetramérico (x = 4, tetraédrica) y hexámera (x = 6, octaédrica). Los compuestos de organolitio, especialmente el n-butillitio, son reactivos útiles en la síntesis orgánica, como era de esperar dada la relación diagonal del litio con el magnesio, que juega un papel importante en la reacción de Grignard. Por ejemplo, se pueden usar alquillitios y arillitios para sintetizar aldehídos y cetonas por reacción con carbonilos metálicos. La reacción con el tetracarbonilo de níquel, por ejemplo, procede a través de un complejo carbonilo de acilo níquel inestable que luego sufre una sustitución electrofílica para dar el aldehído deseado (usando H+ como electrófilo) o cetona (usando un haluro de alquilo) producto.
Los alquil-litios y aril-litios también pueden reaccionar con amidas disustituidas con N,N para dar aldehídos y cetonas, y cetonas simétricas al reaccionar con monóxido de carbono. Se descomponen térmicamente para eliminar un β-hidrógeno, produciendo alquenos e hidruro de litio: otra ruta es la reacción de éteres con alquil- y aril-litios que actúan como bases fuertes. En solventes no polares, los aril-litios reaccionan como los carbaniones que son, convirtiendo el dióxido de carbono en ácidos carboxílicos aromáticos (ArCO2H) y las arilcetonas en carbinoles terciarios (Ar'2C(Ar)OH). Finalmente, pueden utilizarse para sintetizar otros compuestos organometálicos mediante intercambio metal-halógeno.
A diferencia de los compuestos organolíticos, los compuestos organometálicos de los metales alcalinos más pesados son predominantemente iónicos. La aplicación de compuestos organosódicos en química está limitada en parte debido a la competencia de los compuestos organolíticos, que están disponibles comercialmente y muestran una reactividad más conveniente. El principal compuesto organosódico de importancia comercial es la ciclopentadienida de sodio. El tetrafenilborato de sodio también se puede clasificar como un compuesto organosódico ya que, en estado sólido, el sodio se une a los grupos arilo. Los compuestos organometálicos de los metales alcalinos superiores son incluso más reactivos que los compuestos organosódicos y de utilidad limitada. Un reactivo notable es la base de Schlosser, una mezcla de n-butillitio y terc-butóxido de potasio. Este reactivo reacciona con el propeno para formar el compuesto alilpotasio (KCH2CHCH2). El cis-2-buteno y el trans-2-buteno se equilibran cuando entran en contacto con metales alcalinos. Mientras que la isomerización es rápida con litio y sodio, es lenta con los metales alcalinos más pesados. Los metales alcalinos más pesados también favorecen la conformación estéricamente congestionada. Se han reportado varias estructuras cristalinas de compuestos organopotásicos, estableciendo que ellos, al igual que los compuestos de sodio, son poliméricos. Los compuestos de organosodio, organopotasio, organorubidio y organocesio son en su mayoría iónicos y son insolubles (o casi) en solventes no polares.
Los derivados de alquilo y arilo de sodio y potasio tienden a reaccionar con el aire. Provocan la escisión de éteres, generando alcóxidos. A diferencia de los compuestos de alquillitio, los alquilsodios y los alquilpotasios no se pueden obtener haciendo reaccionar los metales con haluros de alquilo porque se produce el acoplamiento de Wurtz:
Como tales, deben fabricarse mediante la reacción de compuestos de alquilmercurio con sodio o potasio metálico en disolventes de hidrocarburos inertes. Mientras que el metilsodio forma tetrámeros como el metillitio, el metilpotasio es más iónico y tiene la estructura de arseniuro de níquel con aniones de metilo discretos y cationes de potasio.
Los metales alcalinos y sus hidruros reaccionan con hidrocarburos ácidos, por ejemplo ciclopentadienos y alquinos terminales, para dar sales. Se utilizan disolventes líquidos de amoníaco, éter o hidrocarburo, siendo el más común el tetrahidrofurano. El más importante de estos compuestos es el ciclopentadienuro de sodio, NaC5H5, un importante precursor de muchos derivados de ciclopentadienilo de metales de transición. De manera similar, los metales alcalinos reaccionan con ciclooctatetraeno en tetrahidrofurano para dar ciclooctatetraenuros de metales alcalinos; por ejemplo, la ciclooctatetraenida de dipotasio (K2C8H8) es un precursor importante de muchos derivados de ciclooctatetraenilo metálicos, como el uranoceno. Los cationes de metales alcalinos grandes y de polarización muy débil pueden estabilizar aniones radicales polarizables, aromáticos y grandes, como el naftalenuro de sodio de color verde oscuro, Na+[C10H8•]−, un fuerte agente reductor.
Reacción con oxígeno
Al reaccionar con el oxígeno, los metales alcalinos forman óxidos, peróxidos, superóxidos y subóxidos. Sin embargo, los tres primeros son más comunes. La siguiente tabla muestra los tipos de compuestos formados en reacción con el oxígeno. El compuesto entre paréntesis representa el producto menor de la combustión.
| Alkali metal | Oxido | Peroxide | Superoxida |
| Li | Li2O | (Li2O2) | |
| Na | (Na2O) | Na2O2 | |
| K | KO2 | ||
| Rb | RbO2 | ||
| Cs | CsO2 |
Los peróxidos de metales alcalinos son compuestos iónicos inestables en agua. El anión peróxido se une débilmente al catión y se hidroliza, formando enlaces covalentes más fuertes.
Los otros compuestos de oxígeno también son inestables en el agua.
Reacción con azufre
Con el azufre forman sulfuros y polisulfuros.
Debido a que los sulfuros de metales alcalinos son esencialmente sales de un ácido débil y una base fuerte, forman soluciones básicas.
Reacción con nitrógeno
El litio es el único metal que se combina directamente con el nitrógeno a temperatura ambiente.
Li3N puede reaccionar con agua para liberar amoníaco.
Reacción con hidrógeno
Con el hidrógeno, los metales alcalinos forman hidruros salinos que se hidrolizan en agua.
Reacción con carbón
El litio es el único metal que reacciona directamente con el carbono para dar acetiluro de dilitio. Na y K pueden reaccionar con acetileno para dar acetiluros.
Reacción con agua
Al reaccionar con el agua, generan iones de hidróxido y gas hidrógeno. Esta reacción es vigorosa y altamente exotérmica y el hidrógeno resultante puede inflamarse en el aire o incluso explotar en el caso de Rb y Cs.
Reacción con otras sales
Los metales alcalinos son muy buenos agentes reductores. Pueden reducir los cationes metálicos que son menos electropositivos. El titanio se produce industrialmente mediante la reducción de tetracloruro de titanio con Na a 4000C (proceso van Arkel-de Boer).
Reacción con compuestos organohalogenuros
Los metales alcalinos reaccionan con derivados de halógeno para generar hidrocarburos a través de la reacción de Wurtz.
Metales alcalinos en amoníaco líquido
Los metales alcalinos se disuelven en amoníaco líquido u otros solventes donantes como aminas alifáticas o hexametilfosforamida para dar soluciones azules. Se cree que estas soluciones contienen electrones libres.
Debido a la presencia de electrones solvatados, estas soluciones son agentes reductores muy potentes utilizados en síntesis orgánica.
La reacción 1) se conoce como reducción de Birch. Otras reducciones que pueden llevar estas soluciones son:
Aunque el francio es el metal alcalino más pesado que se ha descubierto, ha habido algunos trabajos teóricos que predicen las características físicas y químicas de hipotéticos metales alcalinos más pesados. Siendo el primer elemento del período 8, se predice que el elemento no descubierto ununennium (elemento 119) será el siguiente metal alcalino después del francium y se comportará de manera muy similar a sus congéneres más ligeros; sin embargo, también se prevé que difiera de los metales alcalinos más ligeros en algunas propiedades. Se prevé que su química sea más cercana a la del potasio o el rubidio en lugar de la del cesio o el francio. Esto es inusual ya que las tendencias periódicas, ignorando los efectos relativistas, predecirían que el ununenio sería aún más reactivo que el cesio y el francio. Esta reactividad reducida se debe a la estabilización relativista del electrón de valencia del ununenio, aumentando la energía de primera ionización del ununenio y disminuyendo los radios metálico e iónico; este efecto ya se ve para el francio. Esto supone que el ununenio se comportará químicamente como un metal alcalino, lo que, aunque es probable, puede no ser cierto debido a los efectos relativistas. La estabilización relativista del orbital 8s también aumenta la afinidad electrónica del ununenio mucho más allá que la del cesio y el francio; de hecho, se espera que el ununenio tenga una afinidad electrónica más alta que todos los metales alcalinos más ligeros que él. Los efectos relativistas también causan una caída muy grande en la polarizabilidad del ununenio. Por otro lado, se pronostica que el ununenio continuará con la tendencia de disminución de los puntos de fusión hacia abajo en el grupo, esperándose que tenga un punto de fusión entre 0 °C y 30 °C.
La estabilización del electrón de valencia del ununenio y, por lo tanto, la contracción del orbital 8s hacen que su radio atómico se reduzca a 240 pm, muy cerca del rubidio (247 pm), de modo que la química del ununenio en el estado de oxidación +1 debería ser más similar a la química del rubidio que a la del francio. Por otro lado, se prevé que el radio iónico del ion Uue+ sea mayor que el del Rb+, porque los orbitales 7p están desestabilizados y, por lo tanto, son más grandes que el orbitales p de las capas inferiores. Ununennium también puede mostrar los estados de oxidación +3 y +5, que no se ven en ningún otro metal alcalino, además del estado de oxidación +1 que es característico de los otros metales alcalinos y también es el estado de oxidación principal de todos los conocidos. metales alcalinos: esto se debe a la desestabilización y expansión del espinor 7p3/2, lo que hace que sus electrones más externos tengan una energía de ionización más baja de lo que cabría esperar. De hecho, se espera que muchos compuestos de ununenio tengan un gran carácter covalente, debido a la participación de los electrones 7p3/2 en el enlace.
No se ha trabajado tanto en la predicción de las propiedades de los metales alcalinos más allá de unenio. Aunque una simple extrapolación de la tabla periódica (mediante el principio de aufbau) colocaría el elemento 169, unhexenio, bajo ununenio, los cálculos de Dirac-Fock predicen que el siguiente elemento después de ununenio con propiedades similares a las de los metales alcalinos puede ser el elemento 165, unhexpentio, que se prevé que tenga la configuración electrónica [Og] 5g18 6f14 7d10 8s2 8p 1/22 9s1. Este elemento tendría propiedades intermedias entre un metal alcalino y un elemento del grupo 11, y aunque sus propiedades físicas y atómicas estarían más cerca del primero, su química podría estar más cerca de la del segundo. Cálculos posteriores muestran que el unhexpencio seguiría la tendencia de aumentar la energía de ionización más allá del cesio, con una energía de ionización comparable a la del sodio, y que también debería continuar la tendencia de disminución de los radios atómicos más allá del cesio, con un radio atómico comparable al del potasio.. Sin embargo, los electrones 7d del unhexpentium también pueden participar en reacciones químicas junto con el electrón 9s, lo que posiblemente permita estados de oxidación más allá de +1, de ahí el probable comportamiento del metal de transición del unhexpentium. Debido a que los metales alcalinos y alcalinotérreos son elementos del bloque s, estas predicciones para las tendencias y propiedades del ununennio y unhexpentium también son bastante similares para los correspondientes metales alcalinotérreos unbinilium (Ubn) y unhexhexium (Uhh). Unseptrium, elemento 173, puede ser un homólogo aún mejor y más pesado de ununennium; con una configuración electrónica pronosticada de [Usb] 6g1, vuelve a la situación similar al metal alcalino de tener un electrón fácilmente eliminado muy por encima de una capa p cerrada en energía, y se espera que sea incluso más reactivo que el cesio.
A partir de 2019, aún no se han explorado las propiedades probables de otros metales alcalinos más allá del unseptrium, y es posible que existan o no. En los períodos 8 y superiores de la tabla periódica, los efectos relativistas y de estructura de capa se vuelven tan fuertes que las extrapolaciones de congéneres más ligeros se vuelven completamente inexactas. Además, los efectos relativistas y de estructura de capas (que estabilizan los orbitales s y desestabilizan y expanden los orbitales d, f y g de las capas superiores) tienen efectos opuestos, lo que provoca una diferencia aún mayor entre relativistas y no relativistas. cálculos de las propiedades de elementos con números atómicos tan altos. El interés en las propiedades químicas del ununennio, unhexpentium y unseptrium surge del hecho de que están ubicados cerca de las ubicaciones esperadas de las islas de estabilidad, centradas en los elementos 122 (306Ubb) y 164 (482Uhq).
Muchas otras sustancias son similares a los metales alcalinos en su tendencia a formar cationes monopositivos. De manera análoga a los pseudohalógenos, a veces se les ha denominado "metales pseudoalcalinos". Estas sustancias incluyen algunos elementos y muchos más iones poliatómicos; los iones poliatómicos son especialmente similares a los metales alcalinos en su gran tamaño y débil poder de polarización.
El elemento hidrógeno, con un electrón por átomo neutro, generalmente se coloca en la parte superior del Grupo 1 de la tabla periódica por conveniencia, pero el hidrógeno normalmente no se considera un metal alcalino; cuando se considera que es un metal alcalino es por sus propiedades atómicas y no por sus propiedades químicas. En condiciones típicas, el hidrógeno puro existe como un gas diatómico que consta de dos átomos por molécula (H2); sin embargo, los metales alcalinos forman moléculas diatómicas (como el dilitio, Li2) solo a altas temperaturas, cuando se encuentran en estado gaseoso.
El hidrógeno, como los metales alcalinos, tiene un electrón de valencia y reacciona fácilmente con los halógenos, pero las similitudes en su mayoría terminan ahí debido al pequeño tamaño de un protón desnudo H+ en comparación con el metal alcalino. cationes. Su ubicación por encima del litio se debe principalmente a su configuración electrónica. A veces se coloca por encima del flúor debido a sus propiedades químicas similares, aunque el parecido tampoco es absoluto.
La energía de primera ionización del hidrógeno (1312,0 kJ/mol) es mucho mayor que la de los metales alcalinos. Como solo se requiere un electrón adicional para llenar la capa más externa del átomo de hidrógeno, el hidrógeno a menudo se comporta como un halógeno, formando el ion hidruro negativo, y muy ocasionalmente se considera que es un halógeno sobre esa base. (Los metales alcalinos también pueden formar iones negativos, conocidos como alcaluros, pero estos son poco más que curiosidades de laboratorio, ya que son inestables). Un argumento en contra de esta ubicación es que la formación de hidruro a partir de hidrógeno es endotérmica, a diferencia de la formación exotérmica de haluros a partir de halógenos.. El radio del anión H− tampoco se ajusta a la tendencia de aumentar el tamaño de los halógenos: de hecho, H− es muy difuso porque su único protón no puede controlar fácilmente ambos electrones Durante algún tiempo se esperó que el hidrógeno líquido mostrara propiedades metálicas; aunque se ha demostrado que este no es el caso, bajo presiones extremadamente altas, como las que se encuentran en los núcleos de Júpiter y Saturno, el hidrógeno se vuelve metálico y se comporta como un metal alcalino; en esta fase se le conoce como hidrógeno metálico. La resistividad eléctrica del hidrógeno metálico líquido a 3000 K es aproximadamente igual a la del rubidio y el cesio líquidos a 2000 K a las presiones respectivas cuando experimentan una transición de no metal a metal.
La configuración electrónica 1s1 del hidrógeno, aunque es análoga a la de los metales alcalinos (ns1), es única porque no hay una subcapa 1p. Por lo tanto, puede perder un electrón para formar el hidrón H+, o ganar uno para formar el ion hidruro H−. En el primer caso se parece superficialmente a los metales alcalinos; en el último caso, los halógenos, pero las diferencias debidas a la falta de una subcapa 1p son lo suficientemente importantes como para que ninguno de los grupos se ajuste bien a las propiedades del hidrógeno. El grupo 14 también encaja bien en términos de propiedades termodinámicas, como la energía de ionización y la afinidad electrónica, pero el hidrógeno no puede ser tetravalente. Por lo tanto, ninguna de las tres ubicaciones es completamente satisfactoria, aunque el grupo 1 es la ubicación más común (si se elige una) porque el hidrón es, con mucho, la más importante de todas las especies de hidrógeno monoatómico, siendo la base de la química ácido-base. Como ejemplo de las propiedades poco ortodoxas del hidrógeno derivadas de su configuración electrónica inusual y su pequeño tamaño, el ion de hidrógeno es muy pequeño (radio de alrededor de 150 fm en comparación con el tamaño de 50 a 220 pm de la mayoría de los otros átomos e iones) y también lo es inexistente en sistemas condensados que no sean en asociación con otros átomos o moléculas. De hecho, la transferencia de protones entre productos químicos es la base de la química ácido-base. También es única la capacidad del hidrógeno para formar enlaces de hidrógeno, que son un efecto de la transferencia de carga, la electrostática y los fenómenos contribuyentes correlativos de electrones. Si bien también se conocen enlaces de litio análogos, en su mayoría son electrostáticos. Sin embargo, el hidrógeno puede asumir el mismo papel estructural que los metales alcalinos en algunos cristales moleculares y tiene una estrecha relación con los metales alcalinos más ligeros (especialmente el litio).
El ion amonio (NH+4) tiene propiedades muy similares a las de los metales alcalinos más pesados, actuando como un metal alcalino intermedio entre el potasio y el rubidio, y a menudo se considera un pariente cercano. Por ejemplo, la mayoría de las sales de metales alcalinos son solubles en agua, una propiedad que comparten las sales de amonio. Se espera que el amonio se comporte de manera estable como un metal (NH+4 iones en un mar de electrones deslocalizados) a presiones muy altas (aunque menos que la presión típica donde las transiciones de comportamiento aislante a metálico ocurren alrededor de 100 GPa), y posiblemente podría ocurrir dentro de los gigantes de hielo Urano y Neptuno, que pueden tener impactos significativos en sus campos magnéticos interiores. Se ha estimado que la transición de una mezcla de moléculas de amoníaco y dihidrógeno a amonio metálico puede ocurrir a presiones justo por debajo de 25 GPa. En condiciones estándar, el amonio puede formar una amalgama metálica con el mercurio.
Otros "metales pseudoalcalinos" incluyen los cationes de alquilamonio, en los que algunos de los átomos de hidrógeno en el catión de amonio están reemplazados por grupos alquilo o arilo. En particular, los cationes de amonio cuaternario (NR+4 ) son muy útiles ya que están permanentemente cargados, y a menudo se usan como una alternativa al costoso Cs+ para estabilizar aniones muy grandes y muy fácilmente polarizables como HI−2. Los hidróxidos de tetraalquilamonio, como los hidróxidos de metales alcalinos, son bases muy fuertes que reaccionan con el dióxido de carbono atmosférico para formar carbonatos. Además, el átomo de nitrógeno puede ser reemplazado por un átomo de fósforo, arsénico o antimonio (los pnictógenos no metálicos más pesados), creando un fosfonio (PH +4) o arsonio (AsH +4) catión que se puede sustituir de manera similar; mientras que el estibonio (SbH+4) en sí no se conoce, se caracterizan algunos de sus derivados orgánicos.
El cobaltoceno, Co(C5H5)2, es un metaloceno, el análogo de cobalto del ferroceno. Es un sólido de color púrpura oscuro. El cobaltoceno tiene 19 electrones de valencia, uno más de los que se encuentran normalmente en los complejos de metales de organotransición, como su pariente muy estable, el ferroceno, de acuerdo con la regla de los 18 electrones. Este electrón adicional ocupa un orbital que es antienlazante con respecto a los enlaces Co-C. En consecuencia, muchas reacciones químicas de Co(C5H5)2 se caracterizan por su tendencia a perder este "extra" electrón, produciendo un catión de 18 electrones muy estable conocido como cobaltocenio. Muchas sales de cobaltocenio coprecipitan con sales de cesio, y el hidróxido de cobaltocenio es una base fuerte que absorbe el dióxido de carbono atmosférico para formar carbonato de cobaltocenio. Al igual que los metales alcalinos, el cobaltoceno es un fuerte agente reductor y el decametilcobaltoceno es aún más fuerte debido al efecto inductivo combinado de los diez grupos metilo. El cobalto se puede sustituir por su congénere más pesado rodio para dar rodoceno, un agente reductor aún más fuerte. Presumiblemente, el iridoceno (que involucra iridio) sería aún más potente, pero no se ha estudiado muy bien debido a su inestabilidad.
El talio es el elemento estable más pesado del grupo 13 de la tabla periódica. En la parte inferior de la tabla periódica, el efecto del par inerte es bastante fuerte, debido a la estabilización relativista del orbital 6s y la energía de enlace decreciente a medida que los átomos aumentan de tamaño, de modo que la cantidad de energía liberada al formar dos enlaces más no es vale la pena las altas energías de ionización de los electrones 6s. Muestra el estado de oxidación +1 que muestran todos los metales alcalinos conocidos, y los compuestos de talio con talio en su estado de oxidación +1 se parecen mucho a los compuestos de potasio o plata correspondientes estequiométricamente debido a los radios iónicos similares de Tl+ (164 pm), K+ (152 pm) y Ag+ (129 pm) iones. A veces se consideraba un metal alcalino en Europa continental (pero no en Inglaterra) en los años inmediatamente posteriores a su descubrimiento, y se colocó justo después del cesio como el sexto metal alcalino en la tabla periódica de 1869 de Dmitri Mendeleev y Julius Lothar Meyer. 39; s 1868 tabla periódica. (La tabla periódica de Mendeleev de 1871 y la tabla periódica de Meyer de 1870 colocan al talio en su posición actual en el grupo del boro y dejan el espacio debajo del cesio en blanco). Sin embargo, el talio también muestra el estado de oxidación +3, que no exhibiciones conocidas de metales alcalinos (aunque se predice que el ununennio, el séptimo metal alcalino no descubierto, posiblemente muestre el estado de oxidación +3). El sexto metal alcalino ahora se considera francio. Mientras que Tl+ está estabilizado por el efecto del par inerte, este par inerte de electrones 6s aún puede participar químicamente, por lo que estos electrones son estereoquímicamente activos en solución acuosa. Además, los haluros de talio (excepto TlF) son bastante insolubles en agua, y TlI tiene una estructura inusual debido a la presencia del par inerte estereoquímicamente activo en el talio.
Los metales del grupo 11 (o metales de acuñación), cobre, plata y oro, generalmente se clasifican como metales de transición dado que pueden formar iones con capas D incompletas. Físicamente, tienen puntos de fusión relativamente bajos y valores de electronegatividad altos asociados con los metales posteriores a la transición. La subcapa d llena y el electrón s libre de Cu, Ag y Au contribuyen a su alta conductividad eléctrica y térmica. Los metales de transición a la izquierda del grupo 11 experimentan interacciones entre los electrones s y la subcapa d parcialmente llena que reduce la movilidad de los electrones." Químicamente, los metales del grupo 11 se comportan como metales del grupo principal en sus estados de valencia +1 y, por lo tanto, están algo relacionados con los metales alcalinos: esta es una de las razones por las que anteriormente se etiquetaron como 'grupo IB', en paralelo. los metales alcalinos' "grupo IA". Ocasionalmente se clasifican como metales posteriores a la transición. Sus espectros son análogos a los de los metales alcalinos. Sus iones monopositivos son paramagnéticos y no aportan color a sus sales, como los de los metales alcalinos.
En la tabla periódica de Mendeleev de 1871, el cobre, la plata y el oro se enumeran dos veces, una en el grupo VIII (con la tríada del hierro y los metales del grupo del platino) y otra en el grupo IB. No obstante, el Grupo IB se puso entre paréntesis para indicar que era provisional. El criterio principal de Mendeleev para la asignación de grupos era el estado de oxidación máximo de un elemento: sobre esa base, los elementos del grupo 11 no podían clasificarse en el grupo IB, debido a la existencia de compuestos de cobre (II) y oro (III). ser conocido en ese momento. Sin embargo, la eliminación del grupo IB haría del grupo I el único grupo principal (el grupo VIII se denominó grupo de transición) sin una bifurcación A-B. Poco después, la mayoría de los químicos optaron por clasificar estos elementos en el grupo IB y eliminarlos del grupo VIII por la simetría resultante: esta fue la clasificación predominante hasta el surgimiento de la tabla periódica moderna de 18 columnas de tamaño medio-largo, que separaba el álcali metales y metales del grupo 11.
Los metales de acuñación se consideraban tradicionalmente como una subdivisión del grupo de metales alcalinos, debido a que comparten la configuración electrónica característica s1 de los metales alcalinos (grupo 1: p6s1; grupo 11: d10s1). Sin embargo, las similitudes se limitan en gran medida a las estequiometrías de los compuestos +1 de ambos grupos y no a sus propiedades químicas. Esto se debe a que la subcapa d llena proporciona un efecto de protección mucho más débil sobre el electrón s más externo que la subcapa p llena, de modo que los metales acuñados tienen energías de primera ionización mucho más altas y radios iónicos más pequeños que los metales alcalinos correspondientes. Además, tienen puntos de fusión, durezas y densidades más altas, y reactividades y solubilidades más bajas en amoníaco líquido, además de tener un carácter más covalente en sus compuestos. Finalmente, los metales alcalinos están en la parte superior de la serie electroquímica, mientras que los metales de acuñación están casi en la parte inferior. Los metales de acuñación' la capa d llena se rompe mucho más fácilmente que los metales alcalinos' capa p llena, de modo que las energías de ionización segunda y tercera son más bajas, lo que permite estados de oxidación más altos que +1 y una química de coordinación más rica, dando así a los metales del grupo 11 un claro carácter de metal de transición. Particularmente digno de mención es el oro que forma compuestos iónicos con rubidio y cesio, en los que forma el ion áurido (Au−) que también se presenta en forma solvatada en una solución de amoníaco líquido: aquí el oro se comporta como un pseudohalógeno porque su 5d La configuración 106s1 tiene un electrón menos que la configuración de capa casi cerrada 5d106s2 de mercurio.
La producción de metales alcalinos puros es algo complicada debido a su extrema reactividad con sustancias de uso común, como el agua. A partir de sus minerales de silicato, todos los metales alcalinos estables se pueden obtener de la misma manera: primero se usa ácido sulfúrico para disolver el ion de metal alcalino deseado y los iones de aluminio (III) del mineral (lixiviación), después de lo cual la precipitación básica elimina los iones de aluminio del mezcla precipitándola como el hidróxido. A continuación, el carbonato de metal alcalino insoluble restante se precipita selectivamente; la sal luego se disuelve en ácido clorhídrico para producir el cloruro. Luego se deja evaporar el resultado y luego se puede aislar el metal alcalino. El litio y el sodio generalmente se aíslan mediante electrólisis de sus cloruros líquidos, y generalmente se agrega cloruro de calcio para reducir el punto de fusión de la mezcla. Los metales alcalinos más pesados, sin embargo, se aíslan más típicamente de una manera diferente, donde se usa un agente reductor (típicamente sodio para potasio y magnesio o calcio para los metales alcalinos más pesados) para reducir el cloruro de metal alcalino. El producto líquido o gaseoso (el metal alcalino) luego se somete a destilación fraccionada para su purificación. La mayoría de las rutas hacia los metales alcalinos puros requieren el uso de electrólisis debido a su alta reactividad; uno de los pocos que no lo hace es la pirólisis de la azida de metal alcalino correspondiente, que produce el metal para sodio, potasio, rubidio y cesio y el nitruro para litio.
Las sales de litio deben extraerse del agua de manantiales minerales, piscinas de salmuera y depósitos de salmuera. El metal se produce electrolíticamente a partir de una mezcla de cloruro de litio fundido y cloruro de potasio.
El sodio se encuentra principalmente en el agua de mar y en el fondo marino seco, pero ahora se produce a través de la electrólisis del cloruro de sodio al reducir el punto de fusión de la sustancia por debajo de los 700 °C mediante el uso de una celda de Down. Se puede producir sodio extremadamente puro mediante la descomposición térmica de la azida de sodio. El potasio se encuentra en muchos minerales, como la silvita (cloruro de potasio). Anteriormente, el potasio generalmente se producía a partir de la electrólisis de cloruro de potasio o hidróxido de potasio, que se encontraba ampliamente en lugares como Canadá, Rusia, Bielorrusia, Alemania, Israel, Estados Unidos y Jordania, en un método similar a cómo se producía el sodio a finales 1800 y principios de 1900. También se puede producir a partir de agua de mar. Sin embargo, estos métodos son problemáticos porque el potasio metálico tiende a disolverse en su cloruro fundido y se vaporiza significativamente a las temperaturas de funcionamiento, formando potencialmente el superóxido explosivo. Como resultado, ahora se produce potasio metálico puro al reducir el cloruro de potasio fundido con sodio metálico a 850 °C.
Aunque el sodio es menos reactivo que el potasio, este proceso funciona porque a temperaturas tan altas, el potasio es más volátil que el sodio y se puede destilar fácilmente, por lo que el equilibrio se desplaza hacia la derecha para producir más potasio gaseoso y continúa casi hasta su finalización..
Los metales como el sodio se obtienen por electrólisis de sales fundidas. Rb &erio; Cs obtenido principalmente como subproductos del procesamiento de Li. Para hacer cesio puro, los minerales de cesio y rubidio se trituran y calientan a 650 °C con sodio metálico, lo que genera una aleación que luego se puede separar mediante una técnica de destilación fraccionada. Debido a que el cesio metálico es demasiado reactivo para manipularlo, normalmente se ofrece como azida de cesio (CsN3). El hidróxido de cesio se forma cuando el cesio interactúa agresivamente con agua y hielo (CsOH).
El rubidio es el decimosexto elemento más frecuente en la corteza terrestre, sin embargo, es bastante raro. Algunos minerales que se encuentran en América del Norte, Sudáfrica, Rusia y Canadá contienen rubidio. Algunos minerales de potasio (lepidolitas, biotitas, feldespato, carnalita) lo contienen, junto con el cesio. La polucita, la carnalita, la leucita y la lepidolita son minerales que contienen rubidio. Como subproducto de la extracción del litio, se obtiene comercialmente a partir de la lepidolita. El rubidio también se encuentra en rocas y salmueras de potasio, que es un suministro comercial. La mayor parte del rubidio ahora se obtiene como subproducto de la refinación del litio. El rubidio se utiliza en los tubos de vacío como absorbente, un material que se combina con los gases traza de los tubos de vacío y los elimina.
Durante varios años en las décadas de 1950 y 1960, un subproducto de la producción de potasio llamado Alkarb fue una fuente principal de rubidio. Alkarb contenía 21% de rubidio mientras que el resto era potasio y una pequeña fracción de cesio. Hoy en día, los mayores productores de cesio, por ejemplo, la mina Tanco en Manitoba, Canadá, producen rubidio como subproducto de la contaminación. Hoy en día, un método común para separar el rubidio del potasio y el cesio es la cristalización fraccionada de un alumbre de rubidio y cesio (Cs, Rb)Al(SO4)2·12H2O, que produce alumbre de rubidio puro después de aproximadamente 30 recristalizaciones. Las aplicaciones limitadas y la falta de un mineral rico en rubidio limitan la producción de compuestos de rubidio de 2 a 4 toneladas por año. El cesio, sin embargo, no se produce a partir de la reacción anterior. En cambio, la extracción de mineral de polucita es el método principal para obtener cesio puro, extraído del mineral principalmente por tres métodos: digestión ácida, descomposición alcalina y reducción directa. Ambos metales se producen como subproductos de la producción de litio: después de 1958, cuando el interés por las propiedades termonucleares del litio aumentó considerablemente, la producción de rubidio y cesio también aumentó en forma correspondiente. Los metales puros de rubidio y cesio se obtienen reduciendo sus cloruros con calcio metálico a 750 °C y baja presión.
Como resultado de su extrema rareza en la naturaleza, la mayor parte del francio se sintetiza en la reacción nuclear 197Au + 18O → 210Fr + 5 n, produciendo francio-209, francio-210 y francio-211. La mayor cantidad de francio jamás reunida hasta la fecha es de unos 300.000 átomos neutros, que se sintetizaron mediante la reacción nuclear mencionada anteriormente. Cuando se requiere específicamente el único isótopo natural francio-223, se produce como el hijo alfa del actinio-227, producido sintéticamente a partir de la irradiación de neutrones del radio-226 natural, uno de los hijos del uranio-238 natural.
El litio, el sodio y el potasio tienen muchas aplicaciones, mientras que el rubidio y el cesio son muy útiles en contextos académicos pero aún no tienen muchas aplicaciones. El litio se usa a menudo en baterías de iones de litio y el óxido de litio puede ayudar a procesar la sílice. El estearato de litio es un espesante y se puede utilizar para fabricar grasas lubricantes; se produce a partir de hidróxido de litio, que también se utiliza para absorber dióxido de carbono en cápsulas espaciales y submarinos. El cloruro de litio se utiliza como aleación de soldadura fuerte para piezas de aluminio. El litio metálico se utiliza en aleaciones con magnesio y aluminio para dar aleaciones muy resistentes y ligeras.
Los compuestos de sodio tienen muchas aplicaciones, la más conocida es el cloruro de sodio como sal de mesa. Las sales de sodio de los ácidos grasos se utilizan como jabón. El metal de sodio puro también tiene muchas aplicaciones, incluido el uso en lámparas de vapor de sodio, que producen una luz muy eficiente en comparación con otros tipos de iluminación y pueden ayudar a suavizar la superficie de otros metales. Al ser un fuerte agente reductor, a menudo se usa para reducir muchos otros metales, como el titanio y el zirconio, de sus cloruros. Además, es muy útil como líquido de intercambio de calor en reactores nucleares reproductores rápidos debido a su bajo punto de fusión, viscosidad y sección transversal hacia la absorción de neutrones.
Los compuestos de potasio se utilizan a menudo como fertilizantes, ya que el potasio es un elemento importante para la nutrición de las plantas. El hidróxido de potasio es una base muy fuerte y se usa para controlar el pH de varias sustancias. El nitrato de potasio y el permanganato de potasio se utilizan a menudo como potentes agentes oxidantes. El superóxido de potasio se usa en máscaras para respirar, ya que reacciona con el dióxido de carbono para dar carbonato de potasio y oxígeno gaseoso. El potasio metálico puro no se usa a menudo, pero sus aleaciones con sodio pueden sustituir al sodio puro en los reactores nucleares reproductores rápidos.
El rubidio y el cesio se utilizan a menudo en los relojes atómicos. Los relojes atómicos de cesio son extraordinariamente precisos; si se hubiera hecho un reloj en la época de los dinosaurios, se habría atrasado menos de cuatro segundos (después de 80 millones de años). Por esa razón, los átomos de cesio se usan como la definición del segundo. Los iones de rubidio se usan a menudo en fuegos artificiales de color púrpura y el cesio se usa a menudo en fluidos de perforación en la industria del petróleo.
Francium no tiene aplicaciones comerciales, pero debido a su estructura atómica relativamente simple, entre otras cosas, se ha utilizado en experimentos de espectroscopia, lo que lleva a obtener más información sobre los niveles de energía y las constantes de acoplamiento entre partículas subatómicas. Los estudios sobre la luz emitida por los iones de francio-210 atrapados con láser han proporcionado datos precisos sobre las transiciones entre los niveles de energía atómica, similares a los predichos por la teoría cuántica.
Los metales alcalinos puros reaccionan peligrosamente con el aire y el agua y deben mantenerse alejados del calor, el fuego, los agentes oxidantes, los ácidos, la mayoría de los compuestos orgánicos, los halocarbonos, los plásticos y la humedad. También reaccionan con el dióxido de carbono y el tetracloruro de carbono, por lo que los extintores normales son contraproducentes cuando se utilizan en incendios de metales alcalinos. Algunos extintores de polvo seco Clase D diseñados para incendios de metales son efectivos, privando al fuego de oxígeno y enfriando el metal alcalino.
Los experimentos generalmente se llevan a cabo usando solo pequeñas cantidades de unos pocos gramos en una campana extractora. Se pueden desechar pequeñas cantidades de litio por reacción con agua fría, pero los metales alcalinos más pesados se deben disolver en el isopropanol menos reactivo. Los metales alcalinos deben almacenarse bajo aceite mineral o atmósfera inerte. La atmósfera inerte utilizada puede ser gas argón o nitrógeno, excepto el litio, que reacciona con el nitrógeno. El rubidio y el cesio deben mantenerse alejados del aire, incluso bajo el aceite, porque incluso una pequeña cantidad de aire difundido en el aceite puede desencadenar la formación del peróxido peligrosamente explosivo; por la misma razón, el potasio no debe almacenarse bajo aceite en una atmósfera que contenga oxígeno durante más de 6 meses.
La química bioinorgánica de los iones de metales alcalinos ha sido revisada extensamente. Se han determinado estructuras cristalinas en estado sólido para muchos complejos de iones de metales alcalinos en péptidos pequeños, constituyentes de ácidos nucleicos, carbohidratos y complejos de ionóforos.
El litio naturalmente solo se encuentra en trazas en los sistemas biológicos y no tiene un papel biológico conocido, pero tiene efectos en el cuerpo cuando se ingiere. El carbonato de litio se usa como estabilizador del estado de ánimo en psiquiatría para tratar el trastorno bipolar (maníaco-depresivo) en dosis diarias de alrededor de 0,5 a 2 gramos, aunque tiene efectos secundarios. La ingestión excesiva de litio causa somnolencia, dificultad para hablar y vómitos, entre otros síntomas, y envenena el sistema nervioso central, lo cual es peligroso ya que la dosis requerida de litio para tratar el trastorno bipolar es solo un poco más baja que la dosis tóxica. Su bioquímica, la forma en que el cuerpo humano lo maneja y los estudios con ratas y cabras sugieren que es un oligoelemento esencial, aunque aún no se ha identificado la función biológica natural del litio en humanos.
El sodio y el potasio se encuentran en todos los sistemas biológicos conocidos y, por lo general, funcionan como electrolitos dentro y fuera de las células. El sodio es un nutriente esencial que regula el volumen sanguíneo, la presión arterial, el equilibrio osmótico y el pH; el requerimiento fisiológico mínimo de sodio es de 500 miligramos por día. El cloruro de sodio (también conocido como sal común) es la principal fuente de sodio en la dieta y se usa como condimento y conservante, por ejemplo, para encurtidos y cecina; la mayor parte proviene de alimentos procesados. La ingesta dietética de referencia de sodio es de 1,5 gramos por día, pero la mayoría de las personas en los Estados Unidos consumen más de 2,3 gramos por día, la cantidad mínima que promueve la hipertensión; esto a su vez causa 7,6 millones de muertes prematuras en todo el mundo.
El potasio es el catión principal (ion positivo) dentro de las células animales, mientras que el sodio es el catión principal fuera de las células animales. Las diferencias de concentración de estas partículas cargadas provocan una diferencia de potencial eléctrico entre el interior y el exterior de las células, conocida como potencial de membrana. El equilibrio entre el potasio y el sodio se mantiene gracias a las proteínas transportadoras de iones de la membrana celular. El potencial de la membrana celular creado por los iones de potasio y sodio permite que la célula genere un potencial de acción: un "pico" de descarga eléctrica. La capacidad de las células para producir descargas eléctricas es fundamental para funciones corporales como la neurotransmisión, la contracción muscular y la función cardíaca. La alteración de este equilibrio puede ser fatal: por ejemplo, la ingestión de grandes cantidades de compuestos de potasio puede provocar una hiperpotasemia que influye fuertemente en el sistema cardiovascular. El cloruro de potasio se usa en los Estados Unidos para las ejecuciones por inyección letal.

Debido a sus radios atómicos similares, el rubidio y el cesio en el cuerpo imitan al potasio y se absorben de manera similar. El rubidio no tiene una función biológica conocida, pero puede ayudar a estimular el metabolismo y, de manera similar al cesio, reemplazar el potasio en el cuerpo que causa la deficiencia de potasio. La sustitución parcial es bastante posible y bastante no tóxica: una persona de 70 kg contiene en promedio 0,36 g de rubidio, y un aumento en este valor de 50 a 100 veces no mostró efectos negativos en las personas de prueba. Las ratas pueden sobrevivir hasta un 50% de sustitución de potasio por rubidio. El rubidio (y en mucha menor medida el cesio) pueden funcionar como curas temporales para la hipopotasemia; mientras que el rubidio puede sustituir fisiológicamente al potasio de manera adecuada en algunos sistemas, el cesio nunca puede hacerlo. Solo hay evidencia muy limitada en forma de síntomas de deficiencia de rubidio que posiblemente sea esencial en las cabras; aunque esto sea cierto, las trazas que suelen estar presentes en los alimentos son más que suficientes.
La mayoría de las personas rara vez encuentran compuestos de cesio, pero la mayoría de los compuestos de cesio son levemente tóxicos. Al igual que el rubidio, el cesio tiende a sustituir al potasio en el cuerpo, pero es significativamente más grande y, por lo tanto, es un sustituto más pobre. El exceso de cesio puede provocar hipopotasemia, arritmia y paro cardíaco agudo, pero tales cantidades normalmente no se encontrarían en fuentes naturales. Como tal, el cesio no es un contaminante ambiental químico importante. El valor de la dosis letal mediana (LD50) para el cloruro de cesio en ratones es de 2,3 g por kilogramo, que es comparable a los valores de LD50 del cloruro de potasio y el cloruro de sodio. El cloruro de cesio se ha promocionado como una terapia alternativa contra el cáncer, pero se ha relacionado con la muerte de más de 50 pacientes, en quienes se usó como parte de un tratamiento contra el cáncer científicamente no validado.
Los radioisótopos de cesio requieren precauciones especiales: el manejo inadecuado de las fuentes de rayos gamma de cesio-137 puede provocar la liberación de este radioisótopo y lesiones por radiación. Quizás el caso más conocido es el accidente de Goiânia de 1987, en el que un sistema de radioterapia desechado incorrectamente de una clínica abandonada en la ciudad de Goiânia, Brasil, fue rescatado de un depósito de chatarra y la sal de cesio incandescente vendida a curiosos., compradores sin educación. Esto provocó cuatro muertes y lesiones graves por exposición a la radiación. Junto con el cesio-134, el yodo-131 y el estroncio-90, el cesio-137 estuvo entre los isótopos distribuidos por el desastre de Chernóbil que constituyen el mayor riesgo para la salud. Presumiblemente, los radioisótopos de francio también serían peligrosos debido a su alta energía de desintegración y su corta vida media, pero ninguno se ha producido en cantidades lo suficientemente grandes como para representar un riesgo grave.
En química, un grupo acilo es un resto derivado de la eliminación de uno o más grupos hidroxilo de un oxoácido, incluidos los ácidos inorgánicos.... (leer más)
El nitruro de boro es un compuesto refractario de boro y nitrógeno resistente térmica y químicamente con la fórmula química BN. Existe en varias formas... (leer más)
En química, un carburo generalmente describe un compuesto compuesto de carbono y un metal. En metalurgia, carburar o cementar es el proceso para producir... (leer más)