Sistema de cristal cúbico



En cristalografía, el sistema cristalino cúbico (o isométrico) es un sistema cristalino en el que la celda unitaria tiene forma de cubo. . Esta es una de las formas más comunes y simples que se encuentran en cristales y minerales.
Existen tres variedades principales de estos cristales:
- Primitivo cúbico (abbreviado) cP y otros llamados simple cúbico)
- Cobijo centrado en el cuerpo (abbreviado) cI o bcc)
- Cobijo centrado en la cara (abbreviado) cF o fcc)
Nota: el término fcc se utiliza a menudo como sinónimo de la estructura cúbica compacta o ccp que se encuentra en los metales. Sin embargo, fcc representa una red de Bravais cúbica centrada en la cara, que no necesariamente está compacta cuando se coloca un motivo en los puntos de la red. P.ej. las redes de diamante y zincblenda son fcc pero no están compactas. Cada uno se subdivide en otras variantes que se enumeran a continuación. Aunque las celdas unitarias de estos cristales se consideran convencionalmente cubos, las celdas unitarias primitivas a menudo no lo son.
Celosías de Bravais
Los tres látex de Bravais en el sistema cristalino cúbico son:
| Bravais lattice | Primitivo cúbico | Centrado en el cuerpo cúbico | Centrado en la cara cúbico |
|---|---|---|---|
| Símbolo Pearson | cP | cI | cF |
| Unidad celular |  |  |  |
La red cúbica primitiva (cP) consta de un punto de red en cada esquina del cubo; esto significa que cada celda unitaria cúbica simple tiene en total un punto de red. Cada átomo en un punto de la red se comparte equitativamente entre ocho cubos adyacentes y, por lo tanto, la celda unitaria contiene en total un átomo (1⁄8 × 8).
La red cúbica centrada en el cuerpo (cI) tiene un punto de red en el centro de la celda unitaria además de los ocho puntos de las esquinas. Tiene un total neto de dos puntos de red por celda unitaria (1⁄8 × 8 + 1).
La red cúbica centrada en las caras (cF) tiene puntos de red en las caras del cubo, cada uno de los cuales da exactamente la mitad de la contribución, además de los puntos de red de las esquinas, lo que da un total de 4 puntos de red por celda unitaria (1⁄8 × 8 desde las esquinas más 1⁄2 × 6 de las caras).
La red cúbica centrada en las caras está estrechamente relacionada con el sistema hexagonal compacto (hcp), donde dos sistemas difieren sólo en la ubicación relativa de sus capas hexagonales. El plano [111] de una red cúbica centrada en las caras es una cuadrícula hexagonal.
Intentar crear una red cúbica centrada en la base (es decir, colocar un punto de red adicional en el centro de cada cara horizontal) da como resultado una red de Bravais tetragonal simple.
El número de coordinación (CN) es el número de vecinos más cercanos de un átomo central en la estructura. Cada esfera en una red cP tiene número de coordinación 6, en una red cI 8 y en una red cF 12.
El factor de empaquetamiento atómico (APF) es la fracción de volumen ocupada por los átomos. La red cP tiene un APF de aproximadamente 0,524, la red cI un APF de aproximadamente 0,680 y la red cF un APF de aproximadamente 0,740.
Clases de cristal
Los nombres de clase del sistema cristalino isométrico, grupos de puntos (en notación Schönflies, notación Hermann-Mauguin, notación orbifold y Coxeter), tipo, ejemplos, tablas internacionales para cristalografía, número de grupo espacial y espacio. Los grupos se enumeran en la siguiente tabla. Hay un total de 36 grupos espaciales cúbicos.
| No. | Grupo de puntos | Tipo | Ejemplo | Grupos espaciales | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Nombre | Schön. | Intl | Orb. | Cox. | Primitivo | Centrado en la cara | Centrado en el cuerpo | |||
| 195–197 | Tetartoidal | T | 23 | 332 | [3,3]+ | enantiomorfo | Ullmannite, clorato de sodio | P23 | F23 | I23 |
| 198–199 | P213 | I213 | ||||||||
| 200–204 | Diploidal | Th | 2/m3 (m3) | 3*2 | [3]+4] | centros simétricos | Pirita | Pm3, Pn3 | F m3, Fd3 | I3 |
| 205–206 | Pa3 | Ia3 | ||||||||
| 207–211 | Gyroidal | O | 432 | 432 | [3,4]+ | enantiomorfo | Petzite | P432, P4232 | F432, F4132 | I432 |
| 212–214 | P4332, P4132 | I4132 | ||||||||
| 215–217 | Hextetrahedral | Td | 43m | *332 | [3,3] | Sphalerite | P43m | F43m | I43m | |
| 218–220 | P43n | F43c | I43d | |||||||
| 221–230 | Hexoctadral | Oh. | 4/m32/m (m3m) | *432 | [3,4] | centros simétricos | Galena, Halite | Pm3m, Pn3n, Pm3n, Pn3m | Fm3m, Fm3c, Fd3m, Fd3c | Im3m, Ia3d |
Otros términos para hexoctaédrico son: clase normal, holoédrico, clase central ditesseral, tipo galena.
Estructuras de un solo elemento

Como regla general, dado que los átomos en un sólido se atraen entre sí, las disposiciones de átomos más compactas tienden a ser más comunes. (Sin embargo, se producen disposiciones poco empaquetadas, por ejemplo, si la hibridación orbital exige ciertos ángulos de enlace). En consecuencia, la estructura cúbica primitiva, con un factor de empaquetamiento atómico especialmente bajo, es rara en la naturaleza, pero se encuentra en el polonio. El bcc y el fcc, con sus densidades más altas, son bastante comunes en la naturaleza. Ejemplos de bcc incluyen hierro, cromo, tungsteno y niobio. Ejemplos de fcc incluyen aluminio, cobre, oro y plata.
Otra estructura cristalina cúbica importante es la estructura cúbica del diamante, que puede aparecer en carbono, silicio, germanio y estaño. A diferencia de fcc y bcc, esta estructura no es una red, ya que contiene múltiples átomos en su celda primitiva. Otras estructuras elementales cúbicas incluyen la estructura A15 que se encuentra en el tungsteno y la estructura extremadamente complicada del manganeso.
Estructuras multielementos
Los compuestos que constan de más de un elemento (por ejemplo, compuestos binarios) a menudo tienen estructuras cristalinas basadas en el sistema cristalino cúbico. Algunos de los más comunes se enumeran aquí. Estas estructuras pueden verse como dos o más subredes interpenetrantes donde cada subred ocupa los sitios intersticiales de las demás.
Estructura del cloruro de cesio

Una estructura es la "cúbica primitiva interpenetrante" estructura, también llamada "cloruro de cesio" o estructura B2. Esta estructura a menudo se confunde con una estructura cúbica centrada en el cuerpo porque la disposición de los átomos es la misma. Sin embargo, la estructura del cloruro de cesio tiene una base compuesta por dos especies atómicas diferentes. En una estructura cúbica centrada en el cuerpo, habría simetría traslacional a lo largo de la dirección [111]. En la estructura del cloruro de cesio, la traslación a lo largo de la dirección [111] da como resultado un cambio de especie. La estructura también se puede considerar como dos estructuras cúbicas simples separadas, una de cada especie, que se superponen entre sí. La esquina del cubo de cloruro es el centro del cubo de cesio y viceversa.

Funciona de la misma manera para la estructura NaCl descrita en la siguiente sección. Si sacas los átomos Cl, los átomos Na sobrantes todavía forman una estructura FCC, no una simple estructura cúbica.
En la célula unitaria de CsCl, cada ion está en el centro de un cubo de iones de la clase opuesta, por lo que el número de coordinación es ocho. La cation central se coordina a 8 aniones en las esquinas de un cubo como se muestra, y de forma similar, el anión central se coordina a 8 caciones en las esquinas de un cubo. Alternately, one could view this lattice as a simple cubic structure with a secondary atom in its cubic void.
Además del cloruro de cesio en sí, la estructura también aparece en otros haluros alcalinos cuando se preparan a bajas temperaturas o altas presiones. Generalmente, es más probable que esta estructura se forme a partir de dos elementos cuyos iones sean aproximadamente del mismo tamaño (por ejemplo, radio iónico de Cs+ = 167 pm y Cl− = 181 pm).
El grupo espacial de la estructura del cloruro de cesio (CsCl) se denomina Pm3m (en notación Hermann-Mauguin), o "221&. #34; (en las Tablas Internacionales de Cristalografía). La designación Strukturbericht es "B2".
Hay casi cien compuestos intermetálicos de tierras raras que cristalizan en la estructura de CsCl, incluidos muchos compuestos binarios de tierras raras con magnesio y con elementos de los grupos 11, 12 y 13. Otros compuestos que muestran una estructura similar al cloruro de cesio son CsBr , CsI, RbCl de alta temperatura, AlCo, AgZn, BeCu, MgCe, RuAl y SrTl.
Estructura de sal gema
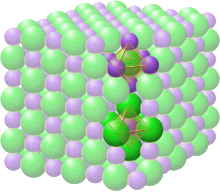
El grupo espacial de la estructura de sal gema o halita (cloruro de sodio) se denota como Fm3m (en notación Hermann-Mauguin), o "225" (en las Tablas Internacionales de Cristalografía). La designación Strukturbericht es "B1".
En la estructura de sal de roca, cada uno de los dos tipos de átomos forma una red cúbica separada centrada en las caras, con las dos redes interpenetrándose para formar un patrón de tablero de ajedrez 3D. La estructura de la sal gema tiene coordinación octaédrica: los vecinos más cercanos de cada átomo constan de seis átomos del tipo opuesto, colocados como los seis vértices de un octaedro regular. En el cloruro de sodio hay una proporción de 1:1 de átomos de sodio a cloro. La estructura también se puede describir como una red FCC de sodio con cloro ocupando cada vacío octaédrico o viceversa.
Ejemplos de compuestos con esta estructura incluyen el propio cloruro de sodio, junto con casi todos los demás haluros alcalinos y "muchos óxidos, sulfuros, seleniuros y telururos de metales divalentes". De acuerdo con la regla de la relación de radio, es más probable que se forme esta estructura si el catión es algo más pequeño que el anión (una relación de radio catión/anión de 0,414 a 0,732).
La distancia interatómica (distancia entre catión y anión, o la mitad de la longitud de la celda unitaria a) en algunos cristales con estructura de sal de roca es: 2,3 Å (2,3 × 10−10m) para NaF, 2,8 Å para NaCl y 3,2 Å para SnTe. La mayoría de los hidruros y haluros de metales alcalinos tienen la estructura de sal gema, aunque algunos tienen la estructura de cloruro de cesio.
| Hidrides | Fluorides | Chlorides | Bromides | Iodides | |
|---|---|---|---|---|---|
| Litio | Hidruro de litio | Fluoruro de litio | Cloruro de litio | Bromuro de litio | iodida de litio |
| Sodium | Hidruro de sodio | Fluoruro de sodio | Cloruro de sodio | Bromuro de sodio | Sodium iodide |
| Potasio | Hidruro de potasio | fluoruro de potasio | Cloruro de potasio | Bromuro de potasio | iodida de potasio |
| Rubidium | Hidruro de Rubidio | Fluoruro de Rubidio | Cloruro de Rubio | Rubidium bromide | Rubidium iodide |
| Caesio | Hidruro de caesio | Fluoruro de caesio | (estructura CsCl) | ||
| Oxides | Sulfides | Selenides | Tellurides | Polonides | |
|---|---|---|---|---|---|
| Magnesio | Óxido de magnesio | Sulfuro de magnesio | Magnesio selenide | Dibujo de magnesio | (NiAs structure) |
| Calcio | Oxido de calcio | Sulfuro de calcio | Selenida de calcio | Dibujo de calcio | Polonida de calcio |
| Estroncio | Óxido de estroncio | Sulfuro de estroncio | Selenide de estroncio | Dibujo de estroncio | Polonida de estroncio |
| Bario | Oxido de bario | Sulfuro de bario | Barium selenide | Barium telluride | Polonida de bario |
| Nitridas | Phosphides | Arsenides | Antimonidas | Bismuthides | |
|---|---|---|---|---|---|
| Escandio | Nitrido escandio | Fosfido escandio | Escandio arsenida | Antimonide escandio | Escandium bismuthide |
| Yttrium | Yttrium nitride | Yttrium phosphide | Yttrium arsenide | Yttrium antimonide | Yttrium bismuthide |
| Lanthanum | Lanthanum nitride | Fosfido de Lanthanum | Lanthanum arsenide | Antimonio de Lanthanum | Lanthanum bismuthide |
| Cerium | Nitruro de cercio | Fósfido de Cerium | Cerium arsenide | Antimonide Cerium | Cerium bismuthide |
| Praseodymium | Praseodymium nitride | Praseodymium phosphide | Praseodymium arsenide | Antimonio de Praseodymium | Praseodymium bismuthide |
| Neodymium | Neodymium nitride | Fosfido de neodimio | Neodymium arsenide | Antimonio de neodimio | Neodymium bismuthide |
| Prometio | ? | ? | ? | ? | ? |
| Samarium | Samarium nitride | Samarium phosphide | Samarium arsenide | Samarium antimonide | Samarium bismuthide |
| Europium | Europium nitride | Europium phosphide | (Na2O2 estructura) | (inestable) | |
| Gadolinium | Gadolinium nitride | Gadolinium phosphide | Gadolinium arsenide | Antimonio de Gadolinio | Gadolinium bismuthide |
| Terbium | Terbium nitride | Terbium phosphide | Terbium arsenide | Antimonio de Terbium | Terbium bismuthide |
| Dysprosium | Dysprosium nitride | Fosfido de Dysprosium | Dysprosium arsenide | Antimonio de Dysprosium | Dysprosium bismuthide |
| Holmium | Holmium nitride | Fosfido de Holmium | Holmium arsenide | Antimonio de Holmium | Holmium bismuthide |
| Erbium | Erbium nitride | Fosfido de Erbium | Erbium arsenide | Erbium antimonide | Erbium bismuthide |
| Thulium | Thulium nitride | Thulium phosphide | Thulium arsenide | Antimonio de Thulium | Thulium bismuthide |
| Ytterbium | Ytterbium nitride | Fosfido de nutribium | Ytterbium arsenide | Ytterbium antimonide | (inestable) |
| Lutetium | Lutetium nitride | Fosfido de lutetio | Lutetium arsenide | Lutetium antimonide | Lutetium bismuthide |
| Actinium | ? | ? | ? | ? | ? |
| Thorium | Thorium nitride | Fósfido de Thorium | Torium arsenide | Antimonide de Thorium | (estructura CsCl) |
| Protactinio | ? | ? | ? | ? | ? |
| Uranio | Nitruro de uranio | Monografía de uranio | Arseniuro de uranio | Antimonio de uranio | bismutida de uranio |
| Neptunium | Nitruro de neptunio | Fosfido Neptunium | Neptunium arsenide | Antimonide neptunium | Neptunium bismuthide |
| Plutonium | Nitruro de plutonio | Plutonium phosphide | Plutonium arsenide | Antimonio de plutonio | Plutonium bismuthide |
| Americium | Americium nitride | Americium phosphide | Americium arsenide | Americium antimonide | Americium bismuthide |
| Curium | Curium nitride | Curium phosphide | Curium arsenide | Curium antimonide | Curium bismuthide |
| Berkelium | Nitruro de Berkelium | Fosfido de Berkelium | Berkelium arsenide | ? | Berkelium bismuthide |
| Californio | ? | ? | Californium arsenide | ? | Californium bismuthide |
| Oxides | Sulfides | Selenides | Tellurides | Polonides | |
|---|---|---|---|---|---|
| Escandio | (inestable) | Scandium monosulfide | |||
| Yttrium | Yttrium monosulfide | ||||
| Lanthanum | Lanthanum monosulfide | ||||
| Cerium | Cerium monosulfide | Monoselenida de cerio | Cerium monotelluride | ||
| Praseodymium | Praseodymium monosulfide | Praseodymium monoselenide | Praseodymium monotelluride | ||
| Neodymium | Neodymium monosulfide | Neodymium monoselenide | Neodymium monotelluride | ||
| Prometio | ? | ? | ? | ? | |
| Samarium | Samarium monosulfide | Samarium monoselenide | Samarium monotelluride | Samarium monopolonide | |
| Europium | Monóxido de europio | Europium monosulfide | Europium monoselenide | Europium monotelluride | Europium monopolonide |
| Gadolinium | (inestable) | Gadolinium monosulfide | |||
| Terbium | Terbium monosulfide | Terbium monopolonide | |||
| Dysprosium | Dysprosium monosulfide | Monopolio de Dysprosium | |||
| Holmium | Holmium monosulfide | El monopolio de Holmium | |||
| Erbium | Erbium monosulfide | ||||
| Thulium | Thulium monosulfide | Thulium monopolonide | |||
| Ytterbium | Monóxido de hierro | Ytterbium monosulfide | Ytterbium monopolonide | ||
| Lutetium | (inestable) | Lutetium monosulfide | Lutetium monopolonide | ||
| Actinium | ? | ? | ? | ? | |
| Thorium | Thorium monosulfide | Thorium monoselenide | (estructura CsCl) | ||
| Protactinio | ? | ? | ? | ? | |
| Uranio | Uranium monosulfide | Monoselenida de uranio | Monotelluride de uranio | ||
| Neptunium | Neptunium monosulfide | Neptunium monoselenide | Neptunium monotelluride | ||
| Plutonium | Plutonium monosulfide | Plutonium monoselenide | Plutonium monotelluride | ||
| Americium | Americium monosulfide | Americium monoselenide | Americium monotelluride | ||
| Curium | Curium monosulfide | Curium monoselenide | Curium monotelluride |
| Carburos | Nitridas | |
|---|---|---|
| Titanio | Carburo de titanio | Nitruro de titanio |
| Zirconium | Carburo de zinc | Zirconium nitride |
| Hafnium | Carburo de Hafnium | Nitruro de Hafnium |
| Vanadium | Carburo de Vanadium | Vanadium nitride |
| Niobio | Carburo de niobio | Nitrito de nitrito de nitrio |
| Tantalum | Carburo de Tantalum | (CoSn structure) |
| Cromo | (inestable) | Nitruro de cromo |
Muchos monóxidos de metal de transición también tienen la estructura de sal de roca (TiO, VO, CrO, MnO, FeO, CoO, NiO, CdO). Los monocarburos actinoide tempranos también tienen esta estructura (ThC, PaC, UC, NpC, PuC).
Estructura de fluorita
Al igual que la estructura de la sal gema, la estructura de fluorita (AB2) también es una estructura Fm3m, pero tiene Relación 1:2 de iones. La estructura antifluorita es casi idéntica, excepto que las posiciones de los aniones y cationes están cambiadas en la estructura. Se denominan posiciones Wyckoff 4a y 8c, mientras que las posiciones de la estructura de sal gema son 4a y 4b.
Estructura de zincblende

El grupo espacial de la estructura Zincblende se llama F43m (en la notación Hermann-Mauguin), o 216. La designación Strukturbericht es "B3".
La estructura de zincblenda (también escrita "blenda de zinc") lleva el nombre del mineral zincblenda (esfalerita), una forma de sulfuro de zinc (β-ZnS). Como en la estructura de la sal gema, los dos tipos de átomos forman dos redes cúbicas interpenetrantes centradas en las caras. Sin embargo, se diferencia de la estructura de sal gema en la forma en que las dos redes están posicionadas entre sí. La estructura de la zincblenda tiene coordinación tetraédrica: los vecinos más cercanos de cada átomo constan de cuatro átomos del tipo opuesto, colocados como los cuatro vértices de un tetraedro regular. En el sulfuro de zinc, la proporción de zinc a azufre es de 1:1. En total, la disposición de los átomos en la estructura de la mezcla de zinc es la misma que la de la estructura cúbica del diamante, pero con tipos alternos de átomos en los diferentes sitios de la red. La estructura también se puede describir como una red FCC de zinc con átomos de azufre que ocupan la mitad de los huecos tetraédricos o viceversa.
Ejemplos de compuestos con esta estructura incluyen la propia mezcla de zinc, nitrato de plomo (II), muchos semiconductores compuestos (como el arseniuro de galio y el telururo de cadmio) y una amplia gama de otros compuestos binarios. Los pnictogenuros del grupo del boro suelen tener una estructura de zincblenda, aunque los nitruros son más comunes en la estructura de wurtzita y sus formas de zincblenda son polimorfos menos conocidos.
| Fluorides | Chlorides | Bromides | Iodides | |
|---|---|---|---|---|
| Copper | Fluoruro de cobre(I) | Cobre(I) cloruro | Cobre(I) bromide | Copper(I) iodide |
| Sulfides | Selenides | Tellurides | Polonides | |
|---|---|---|---|---|
| Beryllium | Sulfuro de berilio | Beryllium selenide | Beryllium telluride | Polonida de berilio |
| Zinc | Sulfuro de zinc | Zinc selenide | Zinc telluride | Polonida de zinc |
| Cadmio | Sulfuro de cadmio | Cadmium selenide | Cadmium telluride | Polonida de cadmio |
| Mercurio | Sulfuro de mercurio | Mercurio selenide | Mercurio | – |
Este grupo también se conoce como la familia II-VI de compuestos, la mayoría de los cuales se pueden hacer tanto en la forma de zincblende (cubica) o wurtzita (hexagonal).
| Nitridas | Phosphides | Arsenides | Antimonidas | |
|---|---|---|---|---|
| Boron | Nitruro de hierro* | Fosfido de hierro | Arseniuro de hierro | Antimonio de hierro |
| Aluminio | Nitruro de aluminio* | Fosfido de aluminio | Arseniuro de aluminio | Antimonio de aluminio |
| Gallium | Nitruro de calcio* | Fosfido de calcio | Arseniuro de calcio | Antimonio de galio |
| Indio | Nitruro indio* | Fosfido indio | Indium arsenide | Antimonide indio |
Este grupo también se conoce como familia de compuestos III-V.

Estructura de Heusler
La estructura de Heusler, basada en la estructura del Cu2MnAl, es una estructura común para compuestos ternarios que involucran metales de transición. Tiene el grupo espacial Fm3m (No. 225) y la designación Strukturbericht es L21. Junto con los compuestos de medio Heusler y Huesler inverso, estrechamente relacionados, hay cientos de ejemplos.
Estructura monosiliciuro de hierro

El grupo espacial de la estructura monosilida de hierro es P213 (No 198), y la designación Strukturbericht es B20. Esta es una estructura quiral, y a veces se asocia con propiedades helimagneticas. Hay cuatro átomos de cada elemento para un total de ocho átomos en la célula unidad.
Se encuentran ejemplos entre los siliciuros y germanuros de metales de transición, así como algunos otros compuestos como la paladida de galio.
| Silicidios | Germanides | |
|---|---|---|
| Manganese | Manganese monosilicide | Manganese germanide |
| Iron | Iron monosilicide | germanide de hierro |
| Cobalto | Cobalto monosilcida | germanida de cobalto |
| Cromo | Silicidio por cromo (IV) | Cromo (IV) germanida |
Estructura Weaire-Phelan

Una estructura Weaire-Phelan tiene simetría Pm3n (223).
Tiene tres orientaciones de tetradecaedros apilados con células piritoédricas en los huecos. Se encuentra como una estructura cristalina en química, donde generalmente se la conoce como "estructura de clatrato tipo I". Los hidratos de gas formados por metano, propano y dióxido de carbono a bajas temperaturas tienen una estructura en la que las moléculas de agua se encuentran en los nodos de la estructura Weaire-Phelan y están unidas por enlaces de hidrógeno, y las moléculas de gas más grandes quedan atrapadas en las jaulas poliédricas.
Contenido relacionado
Ley de Fick
Miscibilidad
Masa molar
Ley de las proporciones múltiples
Anilina