Quimiotaxis
Quimiotaxis (de quimio- + taxis) es el movimiento de un organismo o entidad en respuesta a un estímulo químico. Las células somáticas, las bacterias y otros organismos unicelulares o multicelulares dirigen sus movimientos de acuerdo con ciertas sustancias químicas de su entorno. Esto es importante para que las bacterias encuentren alimento (p. ej., glucosa) nadando hacia la mayor concentración de moléculas de alimento o para huir de los venenos (p. ej., fenol). En los organismos multicelulares, la quimiotaxis es fundamental para el desarrollo temprano (p. ej., el movimiento de los espermatozoides hacia el óvulo durante la fecundación) y el desarrollo (p. ej., la migración de neuronas o linfocitos), así como para el funcionamiento y la salud normales (p. ej., la migración de leucocitos durante una lesión o infección). Además, se ha reconocido que los mecanismos que permiten la quimiotaxis en animales pueden subvertirse durante la metástasis del cáncer. La quimiotaxis aberrante de leucocitos y linfocitos también contribuye a enfermedades inflamatorias como aterosclerosis, asma y artritis. Los componentes subcelulares, como el parche de polaridad generado por el apareamiento de la levadura, también pueden mostrar un comportamiento quimiotáctico.
La quimiotaxispositiva ocurre si el movimiento es hacia una mayor concentración del químico en cuestión; Quimiotaxis negativa si el movimiento es en la dirección opuesta. La cinesis provocada químicamente (dirigida al azar o no direccional) puede denominarse quimiocinesis.
Historia de la investigación de la quimiotaxis
Aunque Leeuwenhoek detectó la migración de células desde los primeros días del desarrollo de la microscopía, una conferencia de Caltech sobre la quimiotaxis propone que "la descripción erudita de la quimiotaxis solo fue realizada por primera vez por T. W. Engelmann (1881) y W. F. Pfeffer (1884) en bacterias y H. S. Jennings (1906) en ciliados'. El premio Nobel I. Metchnikoff también contribuyó al estudio del campo durante 1882 a 1886, con investigaciones del proceso como paso inicial de la fagocitosis. La importancia de la quimiotaxis en biología y patología clínica fue ampliamente aceptada en la década de 1930, y las definiciones más fundamentales que subyacen al fenómeno se redactaron en ese momento. Los aspectos más importantes en el control de calidad de los ensayos de quimiotaxis fueron descritos por H. Harris en la década de 1950. En las décadas de 1960 y 1970, la revolución de la biología celular y la bioquímica modernas proporcionó una serie de técnicas novedosas que estuvieron disponibles para investigar las células respondedoras migratorias y las fracciones subcelulares responsables de la actividad quimiotáctica. La disponibilidad de esta tecnología condujo al descubrimiento de C5a, un importante factor quimiotáctico implicado en la inflamación aguda. Los trabajos pioneros de J. Adler modernizaron el ensayo capilar de Pfeffer y representaron un importante punto de inflexión en la comprensión de todo el proceso de transducción de señales intracelulares de bacterias.
Quimiotaxis bacteriana—características generales
Algunas bacterias, como E. coli, tienen varios flagelos por célula (normalmente de 4 a 10). Estos pueden rotar de dos formas:
- La rotación en sentido contrario alinea la flagella en un único paquete giratorio, haciendo que la bacteria nada en una línea recta; y
- La rotación del reloj rompe el paquete de flagella de manera que cada flagellum apunta en una dirección diferente, causando que la bacteria se tumble en su lugar.
Las direcciones de rotación se dan para un observador fuera de la celda que mira desde los flagelos hacia la celda.
Comportamiento
El movimiento general de una bacteria es el resultado de alternar las fases de voltear y nadar, lo que se conoce como movimiento de correr y voltear. Como resultado, la trayectoria de una bacteria nadando en un ambiente uniforme formará una caminata aleatoria con nadadas relativamente rectas interrumpidas por volteretas aleatorias que reorientan a la bacteria. Las bacterias como E. coli no pueden elegir la dirección en la que nadan y no pueden nadar en línea recta durante más de unos segundos debido a la difusión rotacional; en otras palabras, las bacterias "olvidan" la dirección en la que van. Al evaluar repetidamente su curso y ajustar si se están moviendo en la dirección incorrecta, las bacterias pueden dirigir su movimiento de caminata aleatoria hacia ubicaciones favorables.
En presencia de un gradiente químico, las bacterias ejercerán quimiotaxis o dirigirán su movimiento general en función del gradiente. Si la bacteria siente que se está moviendo en la dirección correcta (hacia el atrayente/alejándose del repelente), seguirá nadando en línea recta durante más tiempo antes de dar vueltas; sin embargo, si se mueve en la dirección equivocada, caerá antes. Las bacterias como E. coli utiliza la detección temporal para decidir si su situación está mejorando o no, y de esta manera, encontrar la ubicación con la mayor concentración de atrayente, detectando incluso pequeñas diferencias en la concentración.
Este recorrido aleatorio sesgado es el resultado de simplemente elegir entre dos métodos de movimiento aleatorio; a saber, volteretas y natación recta. La naturaleza helicoidal del filamento flagelar individual es fundamental para que se produzca este movimiento. La estructura proteica que constituye el filamento flagelar, la flagelina, se conserva entre todas las bacterias flageladas. Los vertebrados parecen haberse aprovechado de este hecho al poseer un receptor inmunitario (TLR5) diseñado para reconocer esta proteína conservada.
Como en muchos casos en biología, hay bacterias que no siguen esta regla. Muchas bacterias, como Vibrio, son monoflageladas y tienen un solo flagelo en un polo de la célula. Su método de quimiotaxis es diferente. Otros poseen un solo flagelo que se mantiene dentro de la pared celular. Estas bacterias se mueven girando toda la célula, que tiene forma de sacacorchos.
Transducción de señales
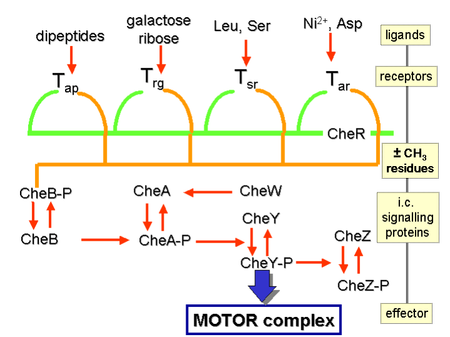
Los gradientes químicos se detectan a través de múltiples receptores transmembrana, llamados proteínas de quimiotaxis aceptoras de metilo (MCP), que varían en las moléculas que detectan. Se sabe que miles de receptores de MCP están codificados en todo el reino bacteriano. Estos receptores pueden unirse a atrayentes o repelentes directa o indirectamente a través de la interacción con proteínas del espacio periplasmático. Las señales de estos receptores se transmiten a través de la membrana plasmática hacia el citosol, donde se activan las proteínas Che. Las proteínas Che alteran la frecuencia de volteretas y alteran los receptores.
Regulación del flagelo
Las proteínas CheW y CheA se unen al receptor. La ausencia de activación del receptor da como resultado la autofosforilación en la histidina quinasa, CheA, en un solo residuo de histidina altamente conservado. CheA, a su vez, transfiere grupos fosforilo a residuos de aspartato conservados en los reguladores de respuesta CheB y CheY; CheA es una histidina quinasa y no transfiere activamente el grupo fosforilo, sino que el regulador de respuesta CheB toma el grupo fosforilo de CheA. Este mecanismo de transducción de señales se denomina sistema de dos componentes y es una forma común de transducción de señales en bacterias. CheY induce la rotación al interactuar con la proteína interruptora flagelar FliM, lo que induce un cambio de rotación del flagelo en sentido contrario a las agujas del reloj. El cambio en el estado de rotación de un solo flagelo puede romper todo el haz de flagelos y provocar una caída.
Regulación de receptores
CheB, cuando es activado por CheA, actúa como una metilesterasa, eliminando los grupos metilo de los residuos de glutamato en el lado citosólico del receptor; funciona antagónicamente con CheR, una metiltransferasa, que agrega residuos de metilo a los mismos residuos de glutamato. Si el nivel de un atrayente permanece alto, el nivel de fosforilación de CheA (y, por lo tanto, CheY y CheB) permanecerá bajo, la célula nadará suavemente y el nivel de metilación de las MCP aumentará (porque CheB-P es no presente para desmetilar). Los MCP ya no responden al atrayente cuando están completamente metilados; por lo tanto, aunque el nivel de atrayente permanezca alto, el nivel de CheA-P (y CheB-P) aumenta y la célula comienza a dar tumbos. Los MCP pueden ser desmetilados por CheB-P y, cuando esto sucede, los receptores pueden responder nuevamente a los atrayentes. La situación es opuesta con respecto a los repelentes: las MCP completamente metiladas responden mejor a los repelentes, mientras que las MCP menos metiladas responden peor a los repelentes. Esta regulación permite que la bacteria 'recuerde' concentraciones químicas del pasado reciente, unos segundos, y compararlas con las que está experimentando actualmente, de esta manera 'conocer' ya sea que esté viajando hacia arriba o hacia abajo en una pendiente. que las bacterias tienen a los gradientes químicos, otros mecanismos están involucrados en el aumento del valor absoluto de la sensibilidad en un fondo dado. Ejemplos bien establecidos son la respuesta ultrasensible del motor a la señal CheY-P y la agrupación de quimiorreceptores.
Quimioatrayentes y quimiorrepelentes
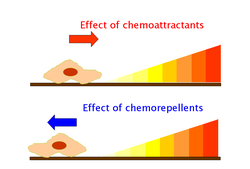
Los quimioatrayentes y quimiorrepelentes son sustancias inorgánicas u orgánicas que poseen un efecto inductor de quimiotaxis en las células móviles. Estos ligandos quimiotácticos crean gradientes de concentración química a los que los organismos, procariotas y eucariotas, se acercan o se alejan, respectivamente.
Los efectos de los quimioatrayentes se obtienen a través de quimiorreceptores como las proteínas de quimiotaxis aceptoras de metilo (MCP). Los MCP en E.coli incluyen Tar, Tsr, Trg y Tap. Los quimioatrayentes de Trg incluyen ribosa y galactosa con fenol como quimiorrepelente. Tap y Tsr reconocen dipéptidos y serina como quimioatrayentes, respectivamente.
Los quimioatrayentes o quimiorrepelentes se unen a las MCP en su dominio extracelular; un dominio de señalización intracelular transmite los cambios en la concentración de estos ligandos quimiotácticos a proteínas aguas abajo como la de CheA, que luego transmite esta señal a los motores flagelares a través de CheY fosforilado (CheY-P). CheY-P puede entonces controlar la rotación flagelar que influye en la dirección de la motilidad celular.
Para E.coli, S. meliloti y R. esferoides, la unión de los quimioatrayentes a las MCP inhibe la actividad de CheA y, por lo tanto, de CheY-P, lo que resulta en corridas suaves, pero para B. substilis, aumenta la actividad de CheA. Los eventos de metilación en E.coli hacen que las MCP tengan una menor afinidad por los quimioatrayentes, lo que provoca una mayor actividad de CheA y CheY-P, lo que provoca caídas. De esta forma, las células pueden adaptarse a la concentración inmediata de quimioatrayente y detectar cambios adicionales para modular la motilidad celular.
Los quimioatrayentes en eucariotas están bien caracterizados para las células inmunitarias. Los péptidos de formilo, como fMLF, atraen leucocitos como neutrófilos y macrófagos, provocando el movimiento hacia los sitios de infección. Los péptidos de metioninilo no acilados no actúan como quimioatrayentes de neutrófilos y macrófagos. Los leucocitos también se mueven hacia los quimioatrayentes C5a, un componente del complemento y ligandos específicos de patógenos en bacterias.
Los mecanismos relacionados con los quimiorrepelentes son menos conocidos que los quimioatrayentes. Aunque los quimiorrepelentes funcionan para conferir una respuesta de evitación en los organismos, Tetrahymena thermophila se adapta a un quimiorrepelente, el péptido Netrin-1, dentro de los 10 minutos posteriores a la exposición; sin embargo, la exposición a quimiorrepelentes como GTP, PACAP-38 y nociceptina no muestra tales adaptaciones. GTP y ATP son quimiorrepelentes en concentraciones micromolares tanto para Tetrahymena como para Paramecium. Estos organismos evitan estas moléculas produciendo reacciones de evitación para reorientarse lejos del gradiente.
Quimiotaxis eucariótica
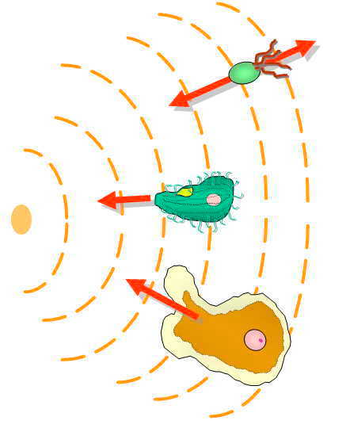
El mecanismo de quimiotaxis que emplean las células eucariotas es bastante diferente al de las bacterias E. coli; sin embargo, la detección de gradientes químicos sigue siendo un paso crucial en el proceso. Debido a su pequeño tamaño y otras limitaciones biofísicas, E. coli no puede detectar directamente un gradiente de concentración. En su lugar, emplean la detección de gradiente temporal, donde se mueven en distancias más grandes varias veces su propio ancho y miden la velocidad a la que cambia la concentración química percibida.
Las células eucariotas son mucho más grandes que las procariotas y tienen receptores incrustados uniformemente en toda la membrana celular. La quimiotaxis eucariótica consiste en detectar espacialmente un gradiente de concentración comparando la activación asimétrica de estos receptores en los diferentes extremos de la célula. La activación de estos receptores da como resultado la migración hacia los quimioatrayentes, o lejos de los quimiorrepelentes. En el apareamiento de levaduras, que no son móviles, los parches de proteínas de polaridad en la corteza celular pueden reubicarse de manera quimiotáctica en gradientes de feromonas.
También se ha demostrado que tanto las células procariotas como las eucariotas son capaces de memoria quimiotáctica. En procariotas, este mecanismo involucra la metilación de receptores llamados proteínas de quimiotaxis aceptoras de metilo (MCP). Esto da como resultado su desensibilización y permite a los procariotas "recordar" y adaptarse a un gradiente químico. Por el contrario, la memoria quimiotáctica en eucariotas puede explicarse mediante el modelo de Inhibición Global de Excitación Local (LEGI). LEGI implica el equilibrio entre una excitación rápida y una inhibición retardada que controla la señalización posterior, como la activación de Ras y la producción de PIP3.
Los niveles de los receptores, las vías de señalización intracelular y los mecanismos efectores representan diversos componentes de tipo eucariota. En las células unicelulares eucariotas, el movimiento ameboide y el cilio o el flagelo eucariota son los principales efectores (p. ej., Amoeba o Tetrahymena). Algunas células eucariotas de origen vertebrado superior, como las células inmunitarias, también se desplazan hacia donde necesitan estar. Además de las células inmunocompetentes (granulocitos, monocitos, linfocitos), un gran grupo de células, consideradas anteriormente como fijadas en los tejidos, también son móviles en condiciones fisiológicas especiales (p. ej., mastocitos, fibroblastos, células endoteliales) o patológicas (p. ej., metástasis). La quimiotaxis tiene una gran importancia en las primeras fases de la embriogénesis, ya que el desarrollo de las capas germinales está guiado por gradientes de moléculas señalizadoras.
Motilidad
A diferencia de la motilidad en la quimiotaxis bacteriana, el mecanismo por el cual las células eucariotas se mueven físicamente no está claro. Parece haber mecanismos por los cuales se detecta un gradiente quimiotáctico externo y se convierte en un gradiente de PIP3 intracelular, lo que da como resultado un gradiente y la activación de una vía de señalización, que culmina en la polimerización de los filamentos de actina. El extremo distal en crecimiento de los filamentos de actina desarrolla conexiones con la superficie interna de la membrana plasmática a través de diferentes conjuntos de péptidos y da como resultado la formación de seudópodos anteriores y urópodos posteriores. Los cilios de las células eucariotas también pueden producir quimiotaxis; en este caso, es principalmente una inducción dependiente de Ca2+ del sistema microtubular del cuerpo basal y el latido de los microtúbulos 9 + 2 dentro de los cilios. El latido orquestado de cientos de cilios está sincronizado por un sistema submembranoso construido entre cuerpos basales. Los detalles de las vías de señalización aún no están del todo claros.
Respuestas migratorias relacionadas con la quimiotaxis
La quimiotaxis se refiere a la migración direccional de las células en respuesta a gradientes químicos; existen varias variaciones de migración inducida por productos químicos, como se indica a continuación.
- Chemokinesis se refiere a un aumento de la motilidad celular en respuesta a los productos químicos en el entorno circundante. A diferencia de la quimiotaxis, la migración estimulada por la quimioquinesis carece de direccionalidad, y en cambio aumenta los comportamientos de escaneo ambiental.
- In haptotaxis el gradiente del químico se expresa o se liga en una superficie, en contraste con el modelo clásico de la quimiotaxis, en el que el gradiente se desarrolla en un líquido soluble. La superficie haptotáctica biológicamente activa más común es la matriz extracelular (ECM); la presencia de ligandos ligados es responsable de la inducción de la migración transendotelial y la angiogénesis.
- Necrotaxis encarna un tipo especial de quimiotaxis cuando las moléculas quimiotratantes se liberan de células necrotas o apoptóticas. Dependiendo del carácter químico de las sustancias liberadas, la necrotaxis puede acumular o repeler células, lo que subraya la importancia fisiofisiológica de este fenómeno.
Receptores
En general, las células eucariotas detectan la presencia de estímulos quimiotácticos mediante el uso de receptores acoplados a proteína G heterotriméricos de 7 transmembrana (o serpentina), una clase que representa una parte importante del genoma. Algunos miembros de esta superfamilia de genes se utilizan en la vista (rodopsinas), así como en el olfato. Las principales clases de receptores de quimiotaxis son desencadenadas por:
- Péptidos de formal - receptores de péptidos de forma (FPR),
- Chemokines - receptores de quimioquinas (CCR o CXCR) y
- Leukotrienes - receptores de leucotrieno (BLT).
Sin embargo, la inducción de un amplio conjunto de receptores de membrana (p. ej., nucleótidos cíclicos, aminoácidos, insulina, péptidos vasoactivos) también provoca la migración de la célula.
Selección quimiotáctica
Mientras que algunos receptores de quimiotaxis se expresan en la superficie de la membrana con características a largo plazo, ya que están determinadas genéticamente, otros tienen dinámicas a corto plazo, ya que se ensamblan ad hoc en presencia de la ligando Las diversas características de los receptores y ligandos de quimiotaxis permiten la posibilidad de seleccionar células respondedoras quimiotácticas con un ensayo de quimiotaxis simple. Mediante la selección quimiotáctica, podemos determinar si una molécula aún no caracterizada actúa a través de la vía del receptor a largo o corto plazo. El término selección quimiotáctica también se usa para designar una técnica que separa células eucariotas o procariotas según su capacidad de respuesta quimiotáctica a ligandos selectores.
Ligandos quimiotácticos
El número de moléculas capaces de provocar respuestas quimiotácticas es relativamente alto y podemos distinguir moléculas quimiotácticas primarias y secundarias. Los principales grupos de ligandos primarios son los siguientes:
- Péptidos de formal son di-, tri-, tetrapeptides de origen bacteriano, formaylated en el N-terminus del péptido. Se liberan de bacterias in vivo o después de la descomposición de la célula[un miembro típico de este grupo es el N-formylmethionyl-leucyl-phenylalanine (abbreviated fMLF o fMLP). El FMLF bacteriano es un componente clave de la inflamación tiene efectos químicos característicos en los granulocitos y monocitos de neutrófilos. Los ligandos y receptores del factor quimiotáctico relacionados con los péptidos de formalo se resumen en el artículo relacionado, receptores de péptidos de Formyl.
- Complemento 3a (C3a) y complemento 5a (C5a) son productos intermedios de la cascada de complemento. Su síntesis se une a las tres vías alternativas (clásicas, dependientes de la lectina y alternativas) de la activación de complementos por una enzima conversora. Las principales células objetivo de estos derivados son los granulocitos neutrófilos y los monocitos también.
- Chemokines pertenecen a una clase especial de citocinas; no sólo hacen sus grupos (C, CC, CXC, CXC, CX3C chemokines) representan moléculas estructuralmente relacionadas con un arreglo especial de puentes desulfidos, pero también su especificidad celular objetivo es diversa. Las quimioquinas de CC actúan sobre monocitos (por ejemplo, RANTES), y las quimioquinas de CXC son neutrófilos de granulocito específico (por ejemplo, IL-8). Investigaciones de las estructuras tridimensionales de las quimioquinas proporcionaron evidencia de que una composición característica de las hojas beta y un helix alfa proporciona expresión de las secuencias necesarias para la interacción con los receptores de quimioquinas. La formación de los dimers y su aumento de la actividad biológica fue demostrada por la cristalografía de varias quimioquinas, por ejemplo IL-8.
- Metabolitos de ácidos grasos poliinsaturados
- Leukotrienes son mediadores lipídicos eicosanoides hechos por el metabolismo del ácido araquidónico por ALOX5 (también denominado 5-lipoxigenasa). Su miembro más prominente con actividad factor quimiotáctica es el leucotrieno B4, que provoca adherencia, quimiotaxis y agregación de leucocitos. La acción química de LTB4 se induce a través de dos receptores de proteína G, BLT1 y BLT2, que están altamente expresados en células involucradas en la inflamación y la alergia.
- La familia de eicosanoides ácido hidroxiicosatetraenoico son metabolitos ácido araquidónico también formados por ALOX5. Tres miembros de la familia forman naturalmente y tienen una actividad química prominente. Estos, enumerados en orden de disminución de potencia, son: 5-oxo-eicosatetraenoico ácido, 5-oxo-15-hidroxi-eicosatetraenoico ácido, y 5-Acido Hidroxieicosatetraenoico. Esta familia de agonistas estimula respuestas quimiotácticas en eosinófilos humanos, neutrófilos y monocitos mediante la unión al receptor Oxoeicosanoide 1, que como los receptores para el leucotrieno B4, es un receptor de proteína G. Aparte de la piel, los neutrófilos son la primera línea de defensa del cuerpo contra las infecciones bacterianas. Después de dejar los vasos sanguíneos cercanos, estas células reconocen los productos químicos producidos por bacterias en un corte o arañazo y migran "hacia el olor".
- Ácido 5-hidroxieicosatrieónico y Ácido 5-oxoeicosatrienoico son metabolitos del ácido Mead (5Z,8Z,11Z- ácido eicosatrirenoide); estimulan la quimiotaxis leucocito a través del receptor oxoeicosanoide 1 con ácido 5-oxoeicosatrienoico siendo tan potente como su araquidonico ácido derivado analógico, ácido 5-oxo-eicosatetraenoico, estimulando la sangre humana eosinófilo y la quimiotaxis neutrófilo.
- 12-Hydroxyeicosatetraenoic acid es un metabolito eicosanoide de ácido araquidonico hecho por ALOX12 que estimula la quimiotaxis leucocito a través del receptor B4 de leucotrieno, BLT2.
- Prostaglandin D2 es un metabolito eicosanoide de ácido araquidonónico hecho por ciclooxigenasa 1 o ciclooxigenasa 2 que estimula la quimiotaxis a través del receptor Prostaglandin DP2. Provoca respuestas quimiotácticas en eosinófilos, basófilos y células de ayuda T del subtipo Th2.
- Ácido 12-Hydroxyheptadecatrienoico es un metabolito no eicosanoide de ácido araquidónico hecho por ciclooxigenasa 1 o ciclooxigenasa 2 que estimula la quimataxis de leucocitos aunque el receptor de leucotrieno B4, BLT2.
- 15-oxo-eicosatetraenoico ácido es un metabolito eicosanoide de ácido araquidónico hecho mi ALOX15; tiene una actividad química débil para los monocitos humanos (ver ácido 15-Hydroxieicosatetraenoico#15-oxo-ETE). El receptor u otro mecanismo por el que este metabolito estimula la quimiotaxis no ha sido aclarado.
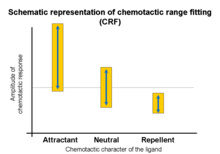
Ajuste gama quimiotáctica
Las respuestas quimiotácticas provocadas por las interacciones ligando-receptor varían con la concentración del ligando. Las investigaciones de familias de ligandos (p. ej., aminoácidos u oligopéptidos) demuestran que la actividad quimioatrayente se produce en un amplio rango, mientras que las actividades quimiorrepelentes tienen rangos estrechos.
Importancia clínica
Un potencial migratorio modificado de las células tiene una importancia relativamente alta en el desarrollo de varios síntomas y síndromes clínicos. La actividad quimiotáctica alterada de patógenos extracelulares (p. ej., Escherichia coli) o intracelulares (p. ej., Listeria monocytogenes) representa en sí misma un objetivo clínico significativo. La modificación de la capacidad quimiotáctica endógena de estos microorganismos por agentes farmacéuticos puede disminuir o inhibir la proporción de infecciones o la propagación de enfermedades infecciosas. Además de las infecciones, existen algunas otras enfermedades en las que la quimiotaxis alterada es el principal factor etiológico, como en el síndrome de Chédiak-Higashi, en el que las vesículas intracelulares gigantes inhiben la migración normal de las células.
| Tipo de enfermedad | La quimioterapia aumentó | La quimioterapia disminuyó |
|---|---|---|
| Infecciones | Inflamaciones | SIDA, Brucellosis |
| Los resultados de la quimioterapia en la enfermedad | — | Síndrome de Chédiak-Higashi, síndrome de Kartagener |
| La quimioterapia se ve afectada | Aterosclerosis, artritis, periodontitis, psoriasis, lesión de reperfusión, tumores metastásicos | Esclerosis múltiple, enfermedad de Hodgkin, infertilidad masculina |
| Intoxicaciones | asbesto, benzpyrene | Hg y sales Cr, ozono |
Modelos matemáticos
Se desarrollaron varios modelos matemáticos de quimiotaxis según el tipo de
- Migración (por ejemplo, diferencias básicas de natación bacteriana, movimiento de eucariotas unicelares con cilia/flagellum y migración ameboide)
- Características fisico-químicas de los químicos (por ejemplo, difusión) trabajando como ligands
- Características biológicas de los ligandos (moléculas atractivas, neutrales y repelentes)
- Sistemas de ensayo aplicados para evaluar la quimiotaxis (ver tiempos de incubación, desarrollo y estabilidad de gradientes de concentración)
- Otros efectos ambientales que poseen influencia directa o indirecta en la migración (luz, temperatura, campos magnéticos, etc.)
Aunque las interacciones de los factores mencionados anteriormente hacen que el comportamiento de las soluciones de los modelos matemáticos de la quimiotaxis sea bastante complejo, es posible describir el fenómeno básico del movimiento impulsado por la quimiotaxis de manera directa. De hecho, demos cuenta con la concentración espacialmente no uniforme del químico-atractante y como su gradiente. Luego el flujo celular quimiotáctico (también llamado corriente) que se genera por la quimiotaxis está ligada a lo anterior gradiente por la ley:
Donde es la densidad espacial de las células y es el llamado "coeficiente químico" - a menudo no es constante, pero una función decreciente del químico-atractante. Para alguna cantidad que está sujeto al flujo total y período de generación y destrucción , es posible formular una ecuación de continuidad:
Donde es la divergencia. Esta ecuación general se aplica tanto a la densidad celular como al químico-atractante. Por lo tanto, incorporando un flujo de difusión en el término total del flujo, las interacciones entre estas cantidades se rigen por un conjunto de ecuaciones diferenciales parciales de reacción-difusión acopladas que describen el cambio en y :
Donde describe el crecimiento de la densidad celular, es el término kinetics/source para el químico-atractante, y los coeficientes de difusión para la densidad celular y el químico-atractante son respectivamente y .
La ecología espacial de los microorganismos del suelo es una función de sus sensibilidades quimiotácticas hacia el sustrato y otros organismos. Se demostró que el comportamiento quimiotáctico de la bacteria conduce a patrones de población no triviales incluso en ausencia de heterogeneidades ambientales. La presencia de heterogeneidades en la escala de poros estructurales tiene un impacto adicional en los patrones bacterianos emergentes.
Medición de quimiotaxis
Se encuentra disponible una amplia gama de técnicas para evaluar la actividad quimiotáctica de las células o el carácter quimioatrayente y quimiorrepelente de los ligandos. Los requisitos básicos de la medición son los siguientes:
- Los gradientes de concentración pueden desarrollarse relativamente rápido y persistir durante mucho tiempo en el sistema
- Las actividades quimiotácticas y quimiocinéticas se distinguen
- La migración de las células es libre hacia y hacia el eje del gradiente de concentración
- Las respuestas detectadas son los resultados de la migración activa de células
A pesar de que aún no se dispone de un ensayo de quimiotaxis ideal, existen varios protocolos y equipos que ofrecen una buena correspondencia con las condiciones descritas anteriormente. Los más utilizados se resumen en la siguiente tabla:
| Tipo de ensayo | Agar-plate assays | Ensayos de dos cámaras | Otros |
|---|---|---|---|
| Ejemplos |
|
|
|
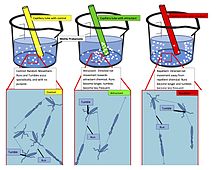
Sistemas quimiotácticos artificiales
Se han diseñadorobots químicos que utilizan quimiotaxis artificial para navegar de forma autónoma. Las aplicaciones incluyen la entrega dirigida de medicamentos en el cuerpo. Más recientemente, las moléculas enzimáticas también han mostrado un comportamiento quimiotáctico positivo en el gradiente de sus sustratos. La unión termodinámicamente favorable de las enzimas a sus sustratos específicos se reconoce como el origen de la quimiotaxis enzimática. Además, las enzimas en cascadas también han mostrado agregación quimiotáctica impulsada por sustrato.
Además de las enzimas activas, las moléculas que no reaccionan también muestran un comportamiento quimiotáctico. Esto se ha demostrado mediante el uso de moléculas de tinte que se mueven direccionalmente en gradientes de solución de polímero a través de interacciones hidrofóbicas favorables.
Contenido relacionado
Canguro de árbol
Hipótesis del simio acuático
Esquema de biología
















![{displaystyle {begin{aligned}{partial C over {partial t}}&=f(C)+nabla cdot left[D_{C}nabla C-Cchi (varphi)nabla varphi right]\{partial varphi over {partial t}}&=g(varphiC)+nabla cdot (D_{varphi }nabla varphi)end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/924b3d46d7dc2a27228a7d98cf43d035a4622c41)



