Prueba de Schiff
La prueba de Schiff es una de las primeras reacciones químicas orgánicas denominada reacción desarrollada por Hugo Schiff, y es una prueba química relativamente general para la detección de muchos aldehídos orgánicos que también ha encontrado uso en la tinción de tejidos biológicos. El reactivo de Schiff es el producto de reacción de una formulación de tinte como fucsina y bisulfito de sodio; la pararosanilina (que carece de un grupo metilo aromático) y la nueva fucsina (que está uniformemente monometilada orto con respecto a las funcionalidades amina del tinte) no son tintes alternativos con una química de detección comparable.
En su uso como prueba cualitativa para aldehídos, la muestra desconocida se agrega al reactivo de Schiff decolorado; cuando hay aldehído presente, se desarrolla un color magenta característico. Los reactivos de tipo Schiff se utilizan para diversos métodos de tinción de tejidos biológicos, p. Tinción de Feulgen y tinción con ácido peryódico de Schiff. La piel humana también contiene grupos funcionales aldehído en los extremos de los sacáridos y, por lo tanto, también está teñida.
Mecanismo
Las soluciones de fucsina aparecen coloreadas debido a la absorbancia de longitud de onda visible de su estructura quinoide central (véase también, por ejemplo, viológeno), pero se "decoloran" cuando se eliminan. tras la sulfonación del tinte en su átomo de carbono central por ácido sulfuroso o su base conjugada, bisulfito. Esta reacción altera el sistema de electrones pi extendido deslocalizado, que de otro modo sería favorecido, y la resonancia en la molécula original.

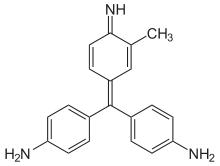
La reacción posterior del reactivo de Schiff con aldehídos es compleja y varios grupos de investigación informan múltiples productos de reacción con compuestos modelo. En el mecanismo actualmente aceptado, la pararosanilina y el bisulfito se combinan para producir el tejido "decolorado" aducto con sulfonación en el carbono central como se describe y muestra. Los grupos amina aromáticos libres y sin carga reaccionan luego con el aldehído que se está probando para formar dos grupos aldimina; Estos grupos también han sido nombrados por su descubridor como bases de Schiff (azometinas), formándose y deshidratando el intermedio carbinolamina (hemiaminal) habitual en el camino hacia la base de Schiff. Estos grupos aldimino electrófilos luego reaccionan con más bisulfito y el producto Ar-NH-CH(R)-SO3- (y otras especies estabilizadas por resonancia en equilibrio con el producto) dan lugar al color magenta de una prueba positiva. La formación previa de aductos de bisulfito clásicos del aldehído analizado puede, cuando los aductos son estables, dar lugar a pruebas falsamente negativas, como en el caso de las pruebas del extremo aldehídico de la glucosa. El reactivo de Schiff al reaccionar con acetaldehído da color rosa.
Este mecanismo mediado por imina fue propuesto por primera vez por Paul Rumpf (1908-1999) en 1935, y Hardonk y van Duijn proporcionaron evidencia experimental en 1964. En 1980, Robins, Abrams y Pincock proporcionaron evidencia sustancial de RMN para el mecanismo que conduzca a su aceptación general. Stoward había examinado el mecanismo en 1966 y, en general, lo consideraba correcto.
Un segundo mecanismo anterior sigue apareciendo en la literatura. El mecanismo fue propuesto en 1921 por el eminente químico orgánico alemán Heinrich Wieland y su alumno Georg Scheuing (1895-1949). Se creía que el bisulfito reaccionaba con los grupos funcionales amina aromática disponibles para formar grupos de ácido N-sulfínico, Ar-NH-SO2H, seguido de una reacción con aldehído para formar sulfonamidas, Ar-NH-SO2CH(OH)-R. Los datos de RMN de 1980 que permitieron la visualización de intermediarios no respaldan este mecanismo ni las sulfonamidas como producto cromogénico.
Contenido relacionado
Ley de Fick
Miscibilidad
Masa molar
Ley de las proporciones múltiples
Anilina