Prueba controlada aleatoria
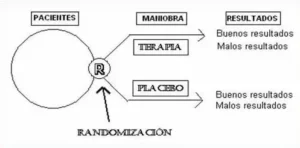
Una prueba controlado aleatoria (o ensayo de control aleatorio; ECA) es una forma de experimento científico que se utiliza para controlar factores que no están bajo control experimental directo. Ejemplos de ECA son ensayos clínicos que comparan los efectos de medicamentos, técnicas quirúrgicas, dispositivos médicos, procedimientos de diagnóstico u otros tratamientos médicos.
Los participantes que se inscriben en ECA difieren entre sí en formas conocidas y desconocidas que pueden influir en los resultados del estudio y, sin embargo, no se pueden controlar directamente. Al asignar aleatoriamente a los participantes entre los tratamientos comparados, un ECA permite el control estadístico de estas influencias. Siempre que esté bien diseñado, se lleve a cabo correctamente y reclute suficientes participantes, un ECA puede lograr un control suficiente sobre estos factores de confusión para ofrecer una comparación útil de los tratamientos estudiados.
Definición y ejemplos
Un ECA en investigación clínica generalmente compara un nuevo tratamiento propuesto con un estándar de atención existente; estos se denominan tratamientos 'experimentales' y 'control', respectivamente. Cuando no se dispone de un tratamiento generalmente aceptado, se puede usar un placebo en el grupo de control para que los participantes estén cegados a sus asignaciones de tratamiento. Idealmente, este principio de cegamiento también se extiende tanto como sea posible a otras partes, incluidos investigadores, técnicos, analistas de datos y evaluadores. El cegamiento efectivo aísla experimentalmente los efectos fisiológicos de los tratamientos de varias fuentes psicológicas de sesgo.
La aleatoriedad en la asignación de los participantes a los tratamientos reduce el sesgo de selección y de asignación, equilibrando los factores pronósticos conocidos y desconocidos en la asignación de los tratamientos. El cegamiento reduce otras formas de sesgos del experimentador y del sujeto.
Un RCT bien ciego se considera el estándar de oro para los ensayos clínicos. Los ECA cegados se usan comúnmente para probar la eficacia de las intervenciones médicas y, además, pueden proporcionar información sobre los efectos adversos, como las reacciones a los medicamentos. Un ensayo controlado aleatorizado puede proporcionar evidencia convincente de que el tratamiento del estudio causa un efecto en la salud humana.
Los términos "RCT" y " ensayo aleatorizado " a veces se usan como sinónimos, pero el último término omite la mención de los controles y, por lo tanto, puede describir estudios que comparan múltiples grupos de tratamiento entre sí en ausencia de un grupo de control. De manera similar, la sigla a veces se expande como " ensayo clínico aleatorizado " o " ensayo comparativo aleatorizado ", lo que genera ambigüedad en la literatura científica. No todos los ECA son ensayos controlados aleatorios (y algunos de ellos nunca podrían serlo, como en los casos en que los controles no serían prácticos o no serían éticos). El término ensayo clínico controlado aleatorizado es un término alternativo utilizado en la investigación clínica;sin embargo, los ECA también se emplean en otras áreas de investigación, incluidas muchas de las ciencias sociales.
Historia
El primer ensayo clínico informado fue realizado por James Lind en 1747 para identificar el tratamiento para el escorbuto. El primer experimento a ciegas fue realizado por la Comisión Real Francesa sobre Magnetismo Animal en 1784 para investigar las afirmaciones del mesmerismo. Uno de los primeros ensayos que defendía el cegamiento de los investigadores provino de Claude Bernard en la segunda mitad del siglo XIX. Bernard recomendó que el observador de un experimento no debe tener conocimiento de la hipótesis que se está probando. Esta sugerencia contrastaba marcadamente con la actitud prevaleciente en la era de la Ilustración de que la observación científica solo puede ser objetivamente válida cuando la lleva a cabo un científico bien educado e informado.El primer estudio registrado que tuvo un investigador cegado fue realizado en 1907 por WHR Rivers y HN Webber para investigar los efectos de la cafeína.
Los experimentos aleatorios aparecieron por primera vez en psicología, donde fueron introducidos por Charles Sanders Peirce y Joseph Jastrow en la década de 1880, y en educación.
A principios del siglo XX, aparecieron experimentos aleatorios en la agricultura, gracias a Jerzy Neyman y Ronald A. Fisher. La investigación experimental de Fisher y sus escritos popularizaron los experimentos aleatorios.
El primer ensayo controlado aleatorio publicado en medicina apareció en el artículo de 1948 titulado "Tratamiento con estreptomicina de la tuberculosis pulmonar", que describía una investigación del Consejo de Investigación Médica. Uno de los autores de ese artículo fue Austin Bradford Hill, a quien se le atribuye haber concebido el RCT moderno.
El diseño de los ensayos se vio influido aún más por los ensayos ISIS a gran escala sobre tratamientos para ataques cardíacos que se realizaron en la década de 1980.
A fines del siglo XX, los ECA fueron reconocidos como el método estándar para la "terapéutica racional" en medicina. A partir de 2004, había más de 150 000 ECA en la Biblioteca Cochrane. Para mejorar el informe de los ECA en la literatura médica, un grupo internacional de científicos y editores publicó las declaraciones de los Estándares consolidados de informes de ensayos (CONSORT) en 1996, 2001 y 2010, y estos han sido ampliamente aceptados. La aleatorización es el proceso de asignación de sujetos de prueba a grupos de tratamiento o de control utilizando un elemento de azar para determinar las asignaciones a fin de reducir el sesgo.
Ética
Aunque el principio de equilibrio clínico ("incertidumbre genuina dentro de la comunidad médica experta... sobre el tratamiento preferido") común a los ensayos clínicos se ha aplicado a los ECA, la ética de los ECA tiene consideraciones especiales. Por un lado, se ha argumentado que el equilibrio en sí mismo es insuficiente para justificar los ECA. Por otra parte, el "equilibrio colectivo" puede entrar en conflicto con la falta de equilibrio personal (p. ej., la creencia personal de que una intervención es eficaz). Finalmente, el diseño de Zelen, que se ha utilizado para algunos ECA, aleatoriza a los sujetos antes de que den su consentimiento informado, lo que puede ser ético para los ECA de detección y terapias seleccionadas, pero probablemente no sea ético "para la mayoría de los ensayos terapéuticos".
Aunque los sujetos casi siempre brindan su consentimiento informado para su participación en un ECA, los estudios desde 1982 han documentado que los sujetos de ECA pueden creer que están seguros de recibir el tratamiento que es mejor para ellos personalmente; es decir, no entienden la diferencia entre investigación y tratamiento. Se necesita más investigación para determinar la prevalencia y las formas de abordar este "concepto terapéutico erróneo".
Las variaciones del método RCT también pueden crear efectos culturales que no han sido bien entendidos. Por ejemplo, los pacientes con enfermedades terminales pueden unirse a los ensayos con la esperanza de curarse, incluso cuando es poco probable que los tratamientos tengan éxito.
Registro de prueba
En 2004, el Comité Internacional de Editores de Revistas Médicas (ICMJE) anunció que todos los ensayos que iniciaran la inscripción después del 1 de julio de 2005 deben registrarse antes de ser considerados para su publicación en una de las 12 revistas miembros del comité. Sin embargo, el registro de prueba aún puede ocurrir tarde o no ocurrir en absoluto. Las revistas médicas han tardado en adaptar las políticas que requieren el registro obligatorio de ensayos clínicos como requisito previo para la publicación.
Clasificaciones
Por diseño de estudio
Una forma de clasificar los ECA es según el diseño del estudio. De más a menos común en la literatura médica, las principales categorías de diseños de estudios RCT son:
- Grupo paralelo: cada participante se asigna aleatoriamente a un grupo y todos los participantes del grupo reciben (o no reciben) una intervención.
- Cruzamiento: con el tiempo, cada participante recibe (o no recibe) una intervención en una secuencia aleatoria.
- Grupo: grupos preexistentes de participantes (p. ej., aldeas, escuelas) se seleccionan al azar para recibir (o no recibir) una intervención.
- Factorial: cada participante se asigna aleatoriamente a un grupo que recibe una combinación particular de intervenciones o no intervenciones (p. ej., el grupo 1 recibe vitamina X y vitamina Y, el grupo 2 recibe vitamina X y placebo Y, el grupo 3 recibe placebo X y vitamina Y , y el grupo 4 recibe placebo X y placebo Y).
Un análisis de los 616 ECA indexados en PubMed durante diciembre de 2006 encontró que el 78 % eran ensayos de grupos paralelos, el 16 % eran cruzados, el 2 % eran de cuerpo dividido, el 2 % eran de grupo y el 2 % eran factoriales.
Por resultado de interés (eficacia frente a efectividad)
Los ECA se pueden clasificar como "explicativos" o "pragmáticos". Los ECA explicativos prueban la eficacia en un entorno de investigación con participantes muy seleccionados y en condiciones muy controladas. Por el contrario, los ECA pragmáticos (pRCT) prueban la efectividad en la práctica diaria con participantes relativamente no seleccionados y en condiciones flexibles; de esta manera, los ECA pragmáticos pueden "informar las decisiones sobre la práctica".
Por hipótesis (superioridad vs. no inferioridad vs. equivalencia)
Otra clasificación de los ECA los clasifica como "ensayos de superioridad", "ensayos de no inferioridad" y "ensayos de equivalencia", que difieren en la metodología y el informe. La mayoría de los ECA son ensayos de superioridad, en los que se supone que una intervención es superior a otra de una manera estadísticamente significativa. Algunos ECA son ensayos de no inferioridad "para determinar si un nuevo tratamiento no es peor que un tratamiento de referencia". Otros ECA son ensayos de equivalencia en los que la hipótesis es que dos intervenciones son indistinguibles entre sí.
Aleatorización
Las ventajas de la aleatorización adecuada en los ECA incluyen:
- "Elimina el sesgo en la asignación de tratamientos", específicamente el sesgo de selección y la confusión.
- "Facilita el cegamiento (enmascaramiento) de la identidad de los tratamientos por parte de investigadores, participantes y asesores".
- "Permite el uso de la teoría de la probabilidad para expresar la probabilidad de que cualquier diferencia en el resultado entre los grupos de tratamiento simplemente indique casualidad".
Hay dos procesos involucrados en la aleatorización de pacientes a diferentes intervenciones. El primero es elegir un procedimiento de aleatorización para generar una secuencia impredecible de asignaciones; esto puede ser una simple asignación aleatoria de pacientes a cualquiera de los grupos con las mismas probabilidades, puede ser "restringido" o puede ser "adaptativo". Un segundo problema, más práctico, es el ocultamiento de la asignación , que se refiere a las estrictas precauciones que se toman para asegurar que la asignación de grupos de pacientes no se revele antes de asignarlos definitivamente a sus respectivos grupos. Los métodos "sistemáticos" no aleatorios de asignación de grupos, como la alternancia de sujetos entre un grupo y otro, pueden causar "posibilidades de contaminación ilimitadas".
Sin embargo, la evidencia empírica de que la aleatorización adecuada cambia los resultados en relación con la aleatorización inadecuada ha sido difícil de detectar.
Procedimientos
La asignación al tratamiento es la proporción deseada de pacientes en cada brazo de tratamiento.
Un procedimiento de aleatorización ideal lograría los siguientes objetivos:
- Maximice el poder estadístico , especialmente en los análisis de subgrupos. Generalmente, los tamaños de grupo iguales maximizan el poder estadístico, sin embargo, los tamaños de grupos desiguales pueden ser más poderosos para algunos análisis (p. ej., comparaciones múltiples de placebo versus varias dosis mediante el procedimiento de Dunnett ), y a veces se desean por razones no analíticas (p. ej., los pacientes pueden estar más motivado para inscribirse si hay una mayor posibilidad de obtener el tratamiento de prueba, o las agencias reguladoras pueden exigir un número mínimo de pacientes expuestos al tratamiento).
- Minimizar el sesgo de selección . Esto puede ocurrir si los investigadores pueden, consciente o inconscientemente, inscribir preferentemente a los pacientes entre los brazos de tratamiento. Un buen procedimiento de aleatorización será impredecible, de modo que los investigadores no puedan adivinar la asignación de grupo del siguiente sujeto en función de las asignaciones de tratamiento anteriores. El riesgo de sesgo de selección es mayor cuando se conocen las asignaciones de tratamientos anteriores (como en los estudios no ciegos) o se pueden adivinar (quizás si un fármaco tiene efectos secundarios distintivos).
- Minimizar el sesgo de asignación (o confusión ). Esto puede ocurrir cuando las covariables que afectan el resultado no se distribuyen por igual entre los grupos de tratamiento y el efecto del tratamiento se confunde con el efecto de las covariables (es decir, un "sesgo accidental" ). Si el procedimiento de aleatorización provoca un desequilibrio en las covariables relacionadas con el resultado entre los grupos, las estimaciones del efecto pueden estar sesgadas si no se ajustan las covariables (que pueden no medirse y, por lo tanto, es imposible ajustarlas).
Sin embargo, ningún procedimiento de aleatorización único cumple esos objetivos en todas las circunstancias, por lo que los investigadores deben seleccionar un procedimiento para un estudio determinado en función de sus ventajas y desventajas.
Simple
Este es un procedimiento intuitivo y de uso común, similar al "lanzamiento de monedas justo repetido". También conocido como aleatorización "completa" o "sin restricciones", es resistente tanto a la selección como a los sesgos accidentales. Sin embargo, su principal inconveniente es la posibilidad de tamaños de grupo desequilibrados en ECA pequeños. Por lo tanto, se recomienda solo para ECA con más de 200 sujetos.
Restringido
Para equilibrar los tamaños de los grupos en ECA más pequeños, se recomienda alguna forma de asignación al azar "restringida". Los principales tipos de aleatorización restringida utilizados en los ECA son:
- Aleatorización de bloques permutados o aleatorización de bloques : se especifica un "tamaño de bloque" y una "proporción de asignación" (número de sujetos en un grupo frente al otro grupo), y los sujetos se asignan aleatoriamente dentro de cada bloque. Por ejemplo, un tamaño de bloque de 6 y una proporción de asignación de 2:1 conduciría a la asignación aleatoria de 4 sujetos a un grupo y 2 al otro. Este tipo de aleatorización se puede combinar con la "aleatorización estratificada", por ejemplo, por centro en un ensayo multicéntrico, para "garantizar un buen equilibrio de las características de los participantes en cada grupo". Un caso especial de aleatorización de bloques permutados es la asignación aleatoria , en la que toda la muestra se trata como un bloque.La principal desventaja de la aleatorización de bloques permutados es que incluso si los tamaños de los bloques son grandes y varían al azar, el procedimiento puede conducir a un sesgo de selección. Otra desventaja es que el análisis "adecuado" de los datos de los ECA aleatorizados por bloques permutados requiere la estratificación por bloques.
- Métodos adaptativos de aleatorización de monedas sesgadas (de los cuales la aleatorización de urnas es el tipo más conocido): en estos métodos relativamente poco comunes, la probabilidad de ser asignado a un grupo disminuye si el grupo está sobrerrepresentado y aumenta si el grupo está subrepresentado. Se cree que los métodos se ven menos afectados por el sesgo de selección que la aleatorización de bloques permutados.
Adaptado
En los ECA se han utilizado al menos dos tipos de procedimientos de aleatorización "adaptativos", pero con mucha menos frecuencia que la aleatorización simple o restringida:
- Aleatorización adaptativa de covariables , de la cual un tipo es la minimización : la probabilidad de ser asignado a un grupo varía para minimizar el "desequilibrio de covariables". Se informa que la minimización tiene "partidarios y detractores" porque solo la asignación de grupo del primer sujeto se elige realmente al azar, el método no elimina necesariamente el sesgo en factores desconocidos.
- Aleatorización adaptativa a la respuesta , también conocida como aleatorización adaptativa a los resultados : La probabilidad de ser asignado a un grupo aumenta si las respuestas de los pacientes anteriores en el grupo fueron favorables. Aunque se ha argumentado que este enfoque es más ético que otros tipos de aleatorización cuando la probabilidad de que un tratamiento sea eficaz o ineficaz aumenta durante el curso de un ECA, los especialistas en ética aún no han estudiado el enfoque en detalle.
Ocultamiento de asignación
El "ocultamiento de la asignación" (definido como "el procedimiento para proteger el proceso de asignación al azar de modo que no se conozca el tratamiento que se asignará antes de que el paciente ingrese al estudio") es importante en los ECA. En la práctica, a los investigadores clínicos de los ECA a menudo les resulta difícil mantener la imparcialidad. Abundan las historias de investigadores que sostienen sobres sellados frente a las luces o saquean oficinas para determinar las asignaciones de grupo con el fin de dictar la asignación de su próximo paciente. Tales prácticas introducen sesgos de selección y factores de confusión (ambos deben minimizarse mediante la aleatorización), lo que posiblemente distorsione los resultados del estudio.El ocultamiento adecuado de la asignación debería evitar que los pacientes y los investigadores descubran la asignación del tratamiento una vez que el estudio está en marcha y después de que ha concluido. Los efectos secundarios o eventos adversos relacionados con el tratamiento pueden ser lo suficientemente específicos como para revelar la asignación a los investigadores o pacientes, lo que introduce sesgos o influye en cualquier parámetro subjetivo recopilado por los investigadores o solicitado a los sujetos.
Algunos métodos estándar para asegurar el ocultamiento de la asignación incluyen sobres sellados, opacos, numerados secuencialmente (SNOSE); contenedores numerados secuencialmente; aleatorización controlada por farmacia; y aleatorización central. Se recomienda que los métodos de ocultación de la asignación se incluyan en el protocolo de un ECA, y que los métodos de ocultación de la asignación se informen en detalle en una publicación de los resultados de un ECA; sin embargo, un estudio de 2005 determinó que la mayoría de los ECA tienen un ocultamiento de la asignación poco claro en sus protocolos, en sus publicaciones o en ambos. Por otro lado, un estudio de 2008 de 146 metanálisis concluyó que los resultados de los ECA con una ocultación de la asignación inadecuada o poco clara tendían a estar sesgados hacia los efectos beneficiosos solo si los resultados de los ECA eran subjetivos en lugar de objetivos.
Tamaño de la muestra
El número de unidades de tratamiento (sujetos o grupos de sujetos) asignados a los grupos de control y tratamiento afecta la confiabilidad de un ECA. Si el efecto del tratamiento es pequeño, el número de unidades de tratamiento en cualquiera de los grupos puede ser insuficiente para rechazar la hipótesis nula en la prueba estadística respectiva. El hecho de no rechazar la hipótesis nula implicaría que el tratamiento no muestra un efecto estadísticamente significativo sobre los tratados en una prueba dada . Pero a medida que aumenta el tamaño de la muestra, el mismo ECA puede demostrar un efecto significativo del tratamiento, incluso si este efecto es pequeño.
Cegador
Un ECA puede estar cegado (también llamado "enmascarado") por "procedimientos que impiden que los participantes del estudio, los cuidadores o los evaluadores de resultados sepan qué intervención se recibió". A diferencia de la ocultación de la asignación, el cegamiento a veces es inapropiado o imposible de realizar en un ECA; por ejemplo, si un ECA implica un tratamiento en el que es necesaria la participación activa del paciente (p. ej., fisioterapia), los participantes no pueden estar cegados a la intervención.
Tradicionalmente, los ECA ciegos se han clasificado como "simple ciego", "doble ciego" o "triple ciego"; sin embargo, en 2001 y 2006 dos estudios demostraron que estos términos tienen diferentes significados para diferentes personas. La Declaración CONSORT de 2010 especifica que los autores y editores no deben usar los términos "simple ciego", "doble ciego" y "triple ciego"; en cambio, los informes de ECA cegados deben discutir "Si se realizó, quién estaba cegado después de la asignación a las intervenciones (por ejemplo, participantes, proveedores de atención, aquellos que evalúan los resultados) y cómo".
Los ECA sin cegamiento se denominan "no cegados", "abiertos" o (si la intervención es un medicamento) "abiertos". En 2008, un estudio concluyó que los resultados de los ECA no ciegos tendían a estar sesgados hacia los efectos beneficiosos solo si los resultados de los ECA eran subjetivos en lugar de objetivos; por ejemplo, en un ECA de tratamientos para la esclerosis múltiple, los neurólogos no cegados (pero no los neurólogos cegados) consideraron que los tratamientos eran beneficiosos. En los ECA pragmáticos, aunque los participantes y los proveedores a menudo no están cegados, "todavía es deseable y, a menudo, posible cegar al evaluador u obtener una fuente objetiva de datos para la evaluación de los resultados".
Análisis de los datos
Los tipos de métodos estadísticos utilizados en los ECA dependen de las características de los datos e incluyen:
- Para los datos de resultados dicotómicos (binarios), se puede utilizar la regresión logística (p. ej., para predecir una respuesta virológica sostenida después de recibir peginterferón alfa-2a para la hepatitis C) y otros métodos.
- Para datos de resultados continuos, el análisis de covarianza (p. ej., cambios en los niveles de lípidos en sangre después de recibir atorvastatina después de un síndrome coronario agudo) prueba los efectos de las variables predictoras.
- Para los datos de resultado del tiempo hasta el evento que pueden censurarse, es apropiado el análisis de supervivencia (p. ej., estimadores de Kaplan-Meier y modelos de riesgos proporcionales de Cox para el tiempo hasta la cardiopatía coronaria después de recibir terapia de reemplazo hormonal en la menopausia).
Independientemente de los métodos estadísticos utilizados, las consideraciones importantes en el análisis de los datos de RCT incluyen:
- Si un ECA debe detenerse antes de tiempo debido a los resultados provisionales. Por ejemplo, los ECA pueden detenerse antes de tiempo si una intervención produce "beneficios o daños mayores de lo esperado", o si "los investigadores encuentran pruebas de que no hay diferencias importantes entre las intervenciones experimentales y de control".
- La medida en que los grupos pueden analizarse exactamente como existían en el momento de la aleatorización (es decir, si se usa el llamado "análisis por intención de tratar"). Un análisis por intención de tratar "puro" es "posible solo cuando se dispone de datos de resultados completos" para todos los sujetos aleatorizados; cuando faltan algunos datos de resultados, las opciones incluyen analizar solo los casos con resultados conocidos y usar datos imputados. Sin embargo, cuanto más los análisis puedan incluir a todos los participantes en los grupos a los que fueron asignados al azar, menos sesgo estará sujeto a un ECA.
- Si se debe realizar un análisis de subgrupos. Estos "a menudo se desaconsejan" porque las comparaciones múltiples pueden producir resultados falsos positivos que no pueden ser confirmados por otros estudios.
Reporte de resultados
La Declaración CONSORT 2010 es "un conjunto mínimo de recomendaciones basadas en evidencia para informar ECA". La lista de verificación CONSORT 2010 contiene 25 elementos (muchos con subelementos) que se centran en "ensayos paralelos, de dos grupos, aleatorizados individualmente", que son el tipo más común de ECA.
Para otros diseños de estudios RCT, se han publicado "extensiones CONSORT", algunos ejemplos son:
- Declaración de Consort 2010: Extensión a ensayos aleatorizados por grupos
- Declaración de Consort 2010: Intervenciones de tratamiento no farmacológico
Importancia relativa y estudios observacionales
Dos estudios publicados en The New England Journal of Medicine en 2000 encontraron que los estudios de observación y los ECA en general produjeron resultados similares. Los autores de los hallazgos de 2000 cuestionaron la creencia de que "los estudios observacionales no deben usarse para definir la atención médica basada en la evidencia" y que los resultados de los ECA son "evidencia del grado más alto". Sin embargo, un estudio de 2001 publicado en Journal of the American Medical Association concluyó que "las discrepancias más allá del azar ocurren y las diferencias en la magnitud estimada del efecto del tratamiento son muy comunes" entre los estudios observacionales y los ECA.
Otras dos líneas de razonamiento cuestionan la contribución de los ECA al conocimiento científico más allá de otro tipo de estudios:
- Si los diseños de los estudios se clasifican por su potencial para nuevos descubrimientos, entonces la evidencia anecdótica estaría en la parte superior de la lista, seguida de los estudios observacionales, seguidos de los ECA.
- Los ECA pueden ser innecesarios para los tratamientos que tienen efectos drásticos y rápidos en relación con el curso natural esperado estable o progresivamente peor de la afección tratada. Un ejemplo es la quimioterapia combinada que incluye cisplatino para el cáncer testicular metastásico, que aumentó la tasa de curación del 5 % al 60 % en un estudio no aleatorio de 1977.
Interpretación de resultados estadísticos
Como todos los métodos estadísticos, los ECA están sujetos a errores estadísticos de tipo I ("falso positivo") y tipo II ("falso negativo"). Con respecto a los errores de tipo I, un ECA típico utilizará 0,05 (es decir, 1 en 20) como la probabilidad de que el ECA encuentre falsamente dos tratamientos igualmente efectivos significativamente diferentes. Con respecto a los errores de tipo II, a pesar de la publicación de un artículo de 1978 que señalaba que los tamaños de muestra de muchos ECA "negativos" eran demasiado pequeños para sacar conclusiones definitivas sobre los resultados negativos, en 2005-2006 una proporción considerable de ECA todavía tenían informes inexactos o incompletos . cálculos del tamaño de la muestra.
Revisión por pares
La revisión por pares de los resultados es una parte importante del método científico. Los revisores examinan los resultados del estudio en busca de posibles problemas con el diseño que podrían conducir a resultados no confiables (por ejemplo, creando un sesgo sistemático), evalúan el estudio en el contexto de estudios relacionados y otras pruebas, y evalúan si se puede considerar razonablemente que el estudio tiene probado sus conclusiones. Para subrayar la necesidad de una revisión por pares y el peligro de generalizar demasiado las conclusiones, dos investigadores médicos del área de Boston realizaron un ensayo controlado aleatorio en el que asignaron al azar un paracaídas o una mochila vacía a 23 voluntarios que saltaron desde un biplano o un helicóptero. El estudio pudo informar con precisión que los paracaídas no logran reducir las lesiones en comparación con las mochilas vacías.
Ventajas
Los ECA se consideran la forma más confiable de evidencia científica en la jerarquía de evidencia que influye en la política y la práctica de atención médica porque reducen la causalidad falsa y el sesgo. Los resultados de los ECA se pueden combinar en revisiones sistemáticas que se utilizan cada vez más en la realización de la práctica basada en la evidencia. Algunos ejemplos de organizaciones científicas que consideran que los ECA o las revisiones sistemáticas de ECA son la evidencia de mayor calidad disponible son:
- A partir de 1998, el Consejo Nacional de Investigación Médica y de Salud de Australia designó evidencia de "Nivel I" como la "obtenida de una revisión sistemática de todos los ensayos controlados aleatorios relevantes" y evidencia de "Nivel II" como la "obtenida de al menos un ensayo adecuadamente diseñado". ensayo controlado aleatorio."
- Desde al menos 2001, al hacer las recomendaciones de las guías de práctica clínica, el Grupo de Trabajo de Servicios Preventivos de los Estados Unidos ha considerado tanto el diseño de un estudio como su validez interna como indicadores de su calidad. Ha reconocido "evidencia obtenida de al menos un ensayo controlado aleatorio adecuado" con buena validez interna (es decir, una calificación de "I-bueno") como la evidencia de mayor calidad disponible.
- El grupo de trabajo GRADE concluyó en 2008 que "los ensayos aleatorios sin limitaciones importantes constituyen evidencia de alta calidad".
- Para cuestiones relacionadas con "Terapia/Prevención, Etiología/Daño", el Centro de Oxford para la Medicina Basada en la Evidencia a partir de 2011 definió la evidencia de "Nivel 1a" como una revisión sistemática de ECA que son consistentes entre sí, y la evidencia de "Nivel 1b" como un "ECA individual (con intervalo de confianza estrecho)".
Los ECA notables con resultados inesperados que contribuyeron a los cambios en la práctica clínica incluyen:
- Después de la aprobación de la Administración de Drogas y Alimentos, los agentes antiarrítmicos flecainida y encainida salieron al mercado en 1986 y 1987 respectivamente. Los estudios no aleatorizados sobre los medicamentos se caracterizaron como "resplandecientes", y sus ventas aumentaron a un total combinado de aproximadamente 165 000 prescripciones por mes a principios de 1989. En ese año, sin embargo, un informe preliminar de un RCT concluyó que los dos medicamentos aumento de la mortalidad. Las ventas de las drogas luego disminuyeron.
- Antes de 2002, según estudios observacionales, era habitual que los médicos prescribieran terapia de reemplazo hormonal para mujeres posmenopáusicas para prevenir el infarto de miocardio. Sin embargo, en 2002 y 2004, los ECA publicados por la Women's Health Initiative afirmaron que las mujeres que tomaban terapia de reemplazo hormonal con estrógeno más progestágeno tenían una tasa más alta de infartos de miocardio que las mujeres que tomaban un placebo, y que la terapia de reemplazo hormonal solo con estrógeno no provocó una reducción en la incidencia de enfermedad coronaria. Las posibles explicaciones de la discrepancia entre los estudios observacionales y los ECA involucraron diferencias en la metodología, en los regímenes hormonales utilizados y en las poblaciones estudiadas. El uso de la terapia de reemplazo hormonal disminuyó después de la publicación de los ECA.
Desventajas
Muchos artículos analizan las desventajas de los ECA. Entre los inconvenientes citados con más frecuencia se encuentran:
Tiempo y costos
Los ECA pueden ser costosos; un estudio encontró 28 ECA de fase III financiados por el Instituto Nacional de Trastornos Neurológicos y Accidentes Cerebrovasculares antes de 2000 con un costo total de US$ 335 millones, para un costo medio de US$ 12 millones por ECA. Sin embargo, el retorno de la inversión de los ECA puede ser alto, ya que el mismo estudio proyectó que los 28 ECA produjeron un "beneficio neto para la sociedad a los 10 años" de 46 veces el costo del programa de ensayos, basado en la evaluación de un programa de calidad. año de vida ajustado como igual al producto interno bruto medio per cápita prevaleciente.
La realización de un ECA tarda varios años hasta que se publica; por lo tanto, los datos están restringidos a la comunidad médica durante largos años y pueden ser menos relevantes en el momento de la publicación.
Es costoso mantener ECA durante los años o décadas que serían ideales para evaluar algunas intervenciones.
Las intervenciones para prevenir eventos que ocurren con poca frecuencia (p. ej., síndrome de muerte súbita del lactante) y resultados adversos poco frecuentes (p. ej., un efecto secundario raro de un fármaco) requerirían ECA con tamaños de muestra extremadamente grandes y, por lo tanto, pueden evaluarse mejor mediante estudios observacionales. .
Debido a los costos de realizar ECA, por lo general solo examinan una variable o muy pocas variables, y rara vez reflejan el panorama completo de una situación médica complicada; mientras que el informe del caso, por ejemplo, puede detallar muchos aspectos de la situación médica del paciente (por ejemplo, historial del paciente, examen físico, diagnóstico, aspectos psicosociales, seguimiento).
Conflicto de intereses peligros
Un estudio de 2011 realizado para revelar posibles conflictos de intereses en estudios de investigación subyacentes utilizados para metanálisis médicos revisó 29 metanálisis y encontró que los conflictos de intereses en los estudios subyacentes a los metanálisis rara vez se revelaron. Los 29 metanálisis incluyeron 11 de revistas de medicina general; 15 de revistas especializadas en medicina y 3 de la Base de Datos Cochrane de Revisiones Sistemáticas. Los 29 metanálisis revisaron un total de 509 ensayos controlados aleatorios (ECA). De estos, 318 ECA informaron fuentes de financiación con 219 (69%) financiados por la industria. 132 de los 509 ECA informaron sobre conflictos de intereses del autor, con 91 estudios (69 %) que revelaron vínculos financieros de la industria con uno o más autores. Sin embargo, la información rara vez se reflejó en los metanálisis. Solo dos (7%) informaron fuentes de financiación de ECA y ninguno informó vínculos entre el autor y la industria del ECA. Los autores concluyeron que "sin el reconocimiento de COI debido a la financiación de la industria o los lazos financieros de la industria del autor de los ECA incluidos en los metanálisis, la comprensión y la evaluación de la evidencia del metanálisis por parte de los lectores pueden verse comprometidas".
Algunos ECA están total o parcialmente financiados por la industria de atención de la salud (p. ej., la industria farmacéutica) a diferencia del gobierno, organizaciones sin fines de lucro u otras fuentes. Una revisión sistemática publicada en 2003 encontró cuatro artículos de 1986–2002 que comparaban RCT patrocinados y no patrocinados por la industria, y en todos los artículos había una correlación entre el patrocinio de la industria y el resultado positivo del estudio. Un estudio de 2004 de ECA de 1999–2001 publicado en las principales revistas médicas y quirúrgicas determinó que los ECA financiados por la industria "tienen más probabilidades de estar asociados con hallazgos favorables a la industria estadísticamente significativos". Estos resultados se han reflejado en los ensayos en cirugía, donde aunque la financiación de la industria no afectó la tasa de interrupción del ensayo, se asoció con una menor probabilidad de publicación de los ensayos completados.Una posible razón de los resultados a favor de la industria en los ECA publicados financiados por la industria es el sesgo de publicación. Otros autores han citado los diferentes objetivos de la investigación académica y patrocinada por la industria como factores que contribuyen a la diferencia. Los patrocinadores comerciales pueden centrarse más en realizar ensayos de medicamentos que ya se han mostrado prometedores en las primeras etapas de los ensayos y en replicar resultados positivos anteriores para cumplir con los requisitos reglamentarios para la aprobación de medicamentos.
Ética
Si se desarrolla una innovación disruptiva en tecnología médica, puede ser difícil probar esto éticamente en un RCT si se vuelve "obvio" que los sujetos de control tienen peores resultados, ya sea debido a otras pruebas anteriores o dentro de la fase inicial del RCT. sí mismo. Desde el punto de vista ético, puede ser necesario abortar el ECA prematuramente, y puede que no sea factible obtener la aprobación ética (y el acuerdo del paciente) para retener la innovación del grupo de control en futuros ECA.
Los ensayos de control histórico (HCT) explotan los datos de ECA anteriores para reducir el tamaño de la muestra; sin embargo, estos enfoques son controvertidos en la comunidad científica y deben manejarse con cuidado.
En ciencias sociales
Debido a la reciente aparición de ECA en ciencias sociales, el uso de ECA en ciencias sociales es un tema controvertido. Algunos escritores con antecedentes médicos o de salud han argumentado que la investigación existente en una variedad de disciplinas de las ciencias sociales carece de rigor y debería mejorarse mediante un mayor uso de ensayos controlados aleatorios.
Ciencia del transporte
Los investigadores de la ciencia del transporte argumentan que el gasto público en programas como los planes de viajes escolares no podría justificarse a menos que se demuestre su eficacia mediante ensayos controlados aleatorios. Graham-Rowe y sus colegas revisaron 77 evaluaciones de intervenciones de transporte encontradas en la literatura, clasificándolas en 5 "niveles de calidad". Llegaron a la conclusión de que la mayoría de los estudios eran de baja calidad y abogaron por el uso de ensayos controlados aleatorios siempre que sea posible en futuras investigaciones sobre el transporte.
El Dr. Steve Melia discrepó con estas conclusiones y argumentó que se han exagerado las afirmaciones sobre las ventajas de los ECA para establecer la causalidad y evitar el sesgo. Propuso los siguientes ocho criterios para el uso de ECA en contextos donde las intervenciones deben cambiar el comportamiento humano para ser efectivas:
La intervención:
- No se ha aplicado a todos los miembros de un grupo único de personas (por ejemplo, la población de todo un país, todos los empleados de una organización única, etc.)
- Se aplica en un contexto o entorno similar al que se aplica al grupo de control
- Puede aislarse de otras actividades, y el propósito del estudio es evaluar este efecto aislado.
- Tiene un corto plazo entre su implementación y la madurez de sus efectos.
Y los mecanismos causales:
- Son conocidos por los investigadores, o se pueden probar todas las alternativas posibles
- No implican mecanismos de retroalimentación significativos entre el grupo de intervención y los entornos externos.
- Tener una relación estable y predecible con los factores exógenos.
- Actuaría de la misma manera si se invirtieran el grupo de control y el grupo de intervención
Criminología
Una revisión de 2005 encontró 83 experimentos aleatorios en criminología publicados entre 1982 y 2004, en comparación con solo 35 publicados entre 1957 y 1981. Los autores clasificaron los estudios que encontraron en cinco categorías: "vigilancia", "prevención", "correcciones", "tribunal" y "comunidad". Hollin (2008) se centró únicamente en los programas de conducta delictiva y argumentó que los ECA pueden ser difíciles de implementar (p. ej., si un ECA requería "aprobar sentencias que asignarían a los delincuentes aleatoriamente a los programas") y, por lo tanto, los experimentos con un diseño cuasi-experimental aún son necesarios. .
Educación
Los ECA se han utilizado para evaluar una serie de intervenciones educativas. Entre 1980 y 2016 se han publicado más de 1000 informes de ECA. Por ejemplo, un estudio de 2009 aleatorizó las aulas de 260 maestros de escuela primaria para recibir o no un programa de evaluación del comportamiento, intervención en el aula y capacitación para padres, y luego midió el desempeño académico y de comportamiento de sus estudiantes. Otro estudio de 2009 aleatorizó salones de clases para 678 niños de primer grado para recibir una intervención centrada en el salón de clases, una intervención centrada en los padres o ninguna intervención, y luego siguió sus resultados académicos hasta los 19 años.
Crítica
Una revisión de 2018 de los 10 ensayos controlados aleatorios más citados señaló una distribución deficiente de los rasgos de fondo, dificultades con el cegamiento y discutió otras suposiciones y sesgos inherentes a los ensayos controlados aleatorios. Estos incluyen el "sesgo de evaluación del período de tiempo único", la "suposición de que los rasgos de fondo permanecen constantes", la "limitación de los efectos del tratamiento promedio", la "limitación del tratamiento simple a nivel individual", la "suposición de que se cumplen plenamente todas las condiciones previas", la la "limitación variable cuantitativa" y la "limitación solo con placebo o solo con tratamiento convencional".
Contenido relacionado
Ley de Fick
Presión oncótica
Memoria explícita
Sociología médica
Memoria implícita