Piperidina
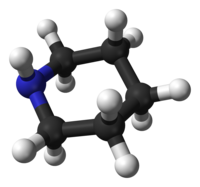
piperidina es un compuesto orgánico de fórmula molecular (CH2)5NH. Esta amina heterocíclica consta de un anillo de seis miembros que contiene cinco puentes de metileno (–CH2–) y un puente de amina (–NH–). Es un líquido incoloro con un olor descrito como objetable y típico de las aminas. El nombre proviene del nombre del género Piper, que es la palabra latina para pimienta. Aunque la piperidina es un compuesto orgánico común, es mejor conocido como un elemento estructural representativo dentro de muchos productos farmacéuticos y alcaloides, como las solenopsinas naturales.
Producción
La piperidina fue reportada por primera vez en 1850 por el químico escocés Thomas Anderson y nuevamente, de forma independiente, en 1852 por el químico francés Auguste Cahours, quien le dio el nombre. Ambos obtuvieron piperidina al hacer reaccionar piperina con ácido nítrico.
Desde el punto de vista industrial, la piperidina se produce mediante la hidrogenación de la piridina, generalmente sobre un catalizador de disulfuro de molibdeno:
- C5H5N + 3 H2 → C5H10NH
La piridina también se puede reducir a piperidina a través de una reducción de Birch modificada usando sodio en etanol.
Ocurrencia natural de piperidina y derivados
La propia piperidina se ha obtenido de la pimienta negra, de Psilocaulon absimile (Aizoaceae) y de Petrosimonia monandra.
El motivo estructural piperidina está presente en numerosos alcaloides naturales. Estos incluyen la piperina, que le da a la pimienta negra su sabor picante. Esto le dio al compuesto su nombre. Otros ejemplos son la toxina de la hormiga de fuego, la solenopsina, el análogo de la nicotina anabasina del árbol del tabaco (Nicotiana glauca), la lobelina del tabaco indio y el alcaloide tóxico conina de la cicuta venenosa, que se utilizó para ejecutar a Sócrates..
Conformación
La piperidina prefiere una conformación de silla, similar al ciclohexano. A diferencia del ciclohexano, la piperidina tiene dos conformaciones de silla distinguibles: una con el enlace N-H en una posición axial y la otra en una posición ecuatorial. Después de mucha controversia durante las décadas de 1950 y 1970, se descubrió que la conformación ecuatorial era más estable en 0,72 kcal/mol en la fase gaseosa. En disolventes no polares se ha estimado un rango entre 0,2 y 0,6 kcal/mol, pero en disolventes polares el confórmero axial puede ser más estable. Los dos confórmeros se interconvierten rápidamente por inversión de nitrógeno; la barrera de activación de energía libre para este proceso, estimada en 6,1 kcal/mol, es sustancialmente menor que las 10,4 kcal/mol para la inversión del anillo. En el caso de la N-metilpiperidina, se prefiere la conformación ecuatorial por 3,16 kcal/mol, que es mucho mayor que la preferencia en el metilciclohexano, 1,74 kcal/mol.
 |  |
| axial conformation | Conformación ecuatorial |
Reacciones
La piperidina es ampliamente utilizada para convertir cetonas en enaminas. Las enaminas derivadas de la piperidina son sustratos en la reacción de alquilación de enaminas de Stork.
Tras el tratamiento con hipoclorito de calcio, la piperidina se convierte en N-cloropiperidina, una cloramina con la fórmula C5H10NCl. La cloramina resultante sufre deshidrohalogenación para producir la imina cíclica.
Desplazamientos químicos de RMN
- 13C NMR: (CDCl3, ppm) 47.27.2, 25.2
- 1H NMR: (CDCl3, ppm) 2.79, 2.19, 1.51
Usos
La piperidina se utiliza como disolvente y como base. Lo mismo es cierto para ciertos derivados: la N-formilpiperidina es un solvente aprótico polar con mejor solubilidad en hidrocarburos que otros solventes de amida, y la 2,2,6,6-tetrametilpiperidina es una base altamente impedida estéricamente, útil debido a su baja nucleofilia y alta solubilidad en disolventes orgánicos.
Una importante aplicación industrial de la piperidina es la producción de tetrasulfuro de dipiperidinil ditiuram, que se utiliza como acelerador de la vulcanización del caucho con azufre.
Lista de medicamentos con piperidina
La piperidina y sus derivados son componentes básicos omnipresentes en productos farmacéuticos y químicos finos. La estructura de piperidina se encuentra, por ejemplo:
- Icaridina (Repelente de insectos)
- ISRS (inhibidores de la recaptación de serotonina selectiva)
- Paroxetine
- Estimulantes y nootrópicos:
- Metilfenidato
- Ethylphenidate
- Pipradrol
- Desoxypipradrol
- Histamina 3 (H3) antagonistas del receptor/agonistas inversos:
- Pitolisant
- SERM (moduladores selectivos de receptores de estrógeno)
- Raloxifene
- Vasodilators
- Minoxidil
- Medicamentos antipsicóticos:
- Droperidol
- Haloperidol
- Melperone
- Mesoridazine
- Risperidone
- Thioridazine
- Opioides:
- Dipipanone
- Fentanilo y análogos
- Loperamide
- Pethidine (meperidina)
- Prodine
- Arylcyclohexylamines:
- PCP y análogos
- armas químicas anticholinergicas
- Ditran
- N-Methyl-3-piperidyl benzilate (JB-336, BZ)
La piperidina también se usa comúnmente en reacciones de degradación química, como la secuenciación de ADN en la escisión de nucleótidos modificados particulares. La piperidina también se usa comúnmente como base para la desprotección de Fmoc-aminoácidos usados en la síntesis de péptidos en fase sólida.
La piperidina figura como precursor de la Tabla II en la Convención de las Naciones Unidas contra el Tráfico Ilícito de Estupefacientes y Sustancias Psicotrópicas debido a su uso (que alcanzó su punto máximo en la década de 1970) en la fabricación clandestina de PCP (1-(1-fenilciclohexil)piperidina, también conocido como polvo de ángel, sherms, mojado, etc.).
Contenido relacionado
Energía de ionización
Grupo hidroxi
Esfalerita