Energía de ionización

En física y química, energía de ionización (IE) (ortografía en inglés americano), energía de ionización (ortografía en inglés británico) es el mínimo energía necesaria para eliminar el electrón más débilmente unido de un átomo gaseoso aislado, ion positivo o molécula. La primera energía de ionización se expresa cuantitativamente como
- X(g) + energía X+g) + e−
donde X es cualquier átomo o molécula, X+ es el ion resultante cuando se despojó al átomo original de un solo electrón, y e− es el electrón eliminado. La energía de ionización es positiva para los átomos neutros, lo que significa que la ionización es un proceso endotérmico. En términos generales, cuanto más cerca están los electrones más externos del núcleo del átomo, mayor es la energía de ionización del átomo.
En física, la energía de ionización generalmente se expresa en electronvoltios (eV) o julios (J). En química, se expresa como la energía para ionizar un mol de átomos o moléculas, generalmente como kilojulios por mol (kJ/mol) o kilocalorías por mol (kcal/mol).
La comparación de las energías de ionización de los átomos en la tabla periódica revela dos tendencias periódicas que siguen las reglas de la atracción de Coulombic:
- La energía de la ionización generalmente aumenta de izquierda a derecha dentro de un período determinado (es decir, fila).
- La energía de la ionización generalmente disminuye de arriba a abajo en un grupo determinado (es decir, columna).
La última tendencia se debe a que la capa externa de electrones se aleja progresivamente del núcleo, con la adición de una capa interna por fila a medida que uno se desplaza hacia abajo en la columna.
La nésima energía de ionización se refiere a la cantidad de energía necesaria para eliminar el electrón más débilmente unido de las especies que tienen una carga positiva de (n − 1). Por ejemplo, las tres primeras energías de ionización se definen de la siguiente manera:
- La primera energía de ionización es la energía que permite la reacción X X+ + e−
- 2a energía de ionización es la energía que permite la reacción X+ X2+ + e−
- 3a energía de ionización es la energía que permite la reacción X2+ X3+ + e−
Las influencias más notables que determinan la energía de ionización incluyen:
- Configuración electrónica: Esto representa el IE de la mayoría de los elementos, ya que todas sus características químicas y físicas pueden determinarse sólo determinando su configuración de electrones respectiva.
- Cargo nuclear: Si la carga nuclear (número atómico) es mayor, los electrones son mantenidos con más fuerza por el núcleo y por lo tanto la energía de ionización será mayor (de acuerdo con la tendencia mencionada 1 dentro de un período determinado).
- Número de conchas de electrones: Si el tamaño del átomo es mayor debido a la presencia de más conchas, los electrones se mantienen menos ajustados por el núcleo y la energía de ionización será más pequeña.
- Cargo nuclear eficaz (en inglés)Zeff): Si la magnitud del blindaje de electrones y la penetración son mayores, los electrones se sostienen menos fuertemente por el núcleo, el Zeff del electrón y la energía de ionización es menor.
- Estabilidad: Un átomo que tiene una configuración electrónica más estable tiene una tendencia reducida a perder electrones y por lo tanto tiene una energía de ionización más alta.
Las influencias menores incluyen:
- Efectos relativos: Los elementos más pesados (especialmente aquellos cuyo número atómico es mayor que cerca de 70) se ven afectados por estos como sus electrones se acercan a la velocidad de la luz. Por lo tanto, tienen radies atómicas más pequeñas y energías de ionización más altas.
- Lanthanide and actinide contraction (and scandide contraction): La reducción de los elementos afecta a la energía de ionización, ya que la carga neta del núcleo se siente más fuertemente.
- Energías de unión de electrones: Los submarinos medio llenos suelen resultar en energías de ionización más elevadas.
El término potencial de ionización es un término antiguo y obsoleto para la energía de ionización, porque el método más antiguo para medir la energía de ionización se basaba en ionizar una muestra y acelerar el electrón eliminado mediante un potencial electrostático.
Determinación de las energías de ionización
La energía de ionización de los átomos, denominada Ei, se mide encontrando la energía mínima de los cuantos de luz (fotones) o electrones acelerados a una energía conocida que pateará los electrones atómicos menos ligados. La medición se realiza en fase gaseosa en átomos individuales. Si bien solo los gases nobles se presentan como gases monoatómicos, otros gases se pueden dividir en átomos individuales. Además, muchos elementos sólidos se pueden calentar y vaporizar en átomos individuales. El vapor monoatómico está contenido en un tubo previamente evacuado que tiene dos electrodos paralelos conectados a una fuente de voltaje. La excitación ionizante se introduce a través de las paredes del tubo o se produce en su interior.
Cuando se usa luz ultravioleta, la longitud de onda se desplaza hacia abajo en el rango ultravioleta. A una determinada longitud de onda (λ) y frecuencia de luz (ν=c/λ, donde c es la velocidad de la luz), los cuantos de luz, cuya energía es proporcional a la frecuencia, tendrán una energía lo suficientemente alta como para desalojar los electrones menos unidos.. Estos electrones serán atraídos por el electrodo positivo y los iones positivos que queden después de la fotoionización serán atraídos por el electrodo con carga negativa. Estos electrones e iones establecerán una corriente a través del tubo. La energía de ionización será la energía de los fotones hνi (h es la constante de Planck) que causaron un fuerte aumento en la corriente: Ei = hνi.
Cuando se utilizan electrones de alta velocidad para ionizar los átomos, se producen mediante un cañón de electrones dentro de un tubo de vacío similar. La energía del haz de electrones puede ser controlada por los voltajes de aceleración. La energía de estos electrones que da lugar a un inicio brusco de la corriente de iones y electrones liberados a través del tubo coincidirá con la energía de ionización de los átomos.
Átomos: valores y tendencias
Generalmente, la (N+1)-ésima energía de ionización de un elemento en particular es mayor que la Nésima energía de ionización (también se puede notar que la energía de ionización de un anión es generalmente menor que la de cationes y átomo neutro para el mismo elemento). Cuando la siguiente energía de ionización implica la eliminación de un electrón de la misma capa de electrones, el aumento de la energía de ionización se debe principalmente al aumento de la carga neta del ion del que se elimina el electrón. Los electrones extraídos de iones más cargados experimentan mayores fuerzas de atracción electrostática; por lo tanto, su eliminación requiere más energía. Además, cuando la próxima energía de ionización involucra la eliminación de un electrón de una capa de electrones inferior, la distancia mucho menor entre el núcleo y el electrón también aumenta tanto la fuerza electrostática como la distancia sobre la cual se debe superar esa fuerza para eliminar el electrón. Ambos factores aumentan aún más la energía de ionización.
Algunos valores para los elementos del tercer período se dan en la siguiente tabla:
| Elemento | Primera | Segundo | Tercera | Cuarto | Quinta | Sexta | Séptimo |
|---|---|---|---|---|---|---|---|
| Na | 496 | 4,560 | |||||
| Mg | 738 | 1.450 | 7.730 | ||||
| Al | 577 | 1.816 | 2.881 | 11.600 | |||
| Si | 786 | 1,577 | 3.228 | 4.354 | 16.100 | ||
| P | 1.060 | 1.890 | 2,905 | 4.950 | 6.270 | 21.200 | |
| S | 1.000 | 2.295 | 3.375 | 4,565 | 6.950 | 8.490 | 27.107 |
| Cl | 1.256 | 2.260 | 3,850 | 5,160 | 6.560 | 9.360 | 11. |
| Ar | 1,520 | 2.665 | 3.945 | 5.770 | 7.230 | 8.780 | 12.000 |
Se producen grandes saltos en las energías de ionización molares sucesivas al pasar por configuraciones de gases nobles. Por ejemplo, como se puede ver en la tabla anterior, las energías de ionización de los dos primeros molares del magnesio (quitando los dos electrones 3s de un átomo de magnesio) son mucho más pequeñas que la tercera, que requiere quitar un electrón 2p de la configuración de neón de Mg2+. Ese electrón 2p está mucho más cerca del núcleo que los electrones 3s eliminados anteriormente.
La energía de ionización también es una tendencia periódica dentro de la tabla periódica. Moviéndose de izquierda a derecha dentro de un período, o hacia arriba dentro de un grupo, la primera energía de ionización generalmente aumenta, con excepciones como el aluminio y el azufre en la tabla anterior. A medida que aumenta la carga nuclear del núcleo a lo largo del período, aumenta la atracción electrostática entre los electrones y los protones, por lo que el radio atómico disminuye y la nube de electrones se acerca al núcleo porque los electrones, especialmente el más externo, están retenidos con más fuerza por la mayor carga nuclear efectiva.
Al moverse hacia abajo dentro de un grupo dado, los electrones se mantienen en capas de mayor energía con un número cuántico principal n más alto, más alejados del núcleo y, por lo tanto, se unen de manera más flexible, por lo que la energía de ionización disminuye. La carga nuclear efectiva aumenta lentamente, de modo que su efecto se ve contrarrestado por el aumento de n.
Excepciones en energías de ionización
Hay excepciones a la tendencia general de aumento de las energías de ionización dentro de un período. Por ejemplo, el valor disminuye de berilio (
4Be
: 9,3 eV) a boro (
5B
: 8,3 eV), y de nitrógeno (
7N
: 14,5 eV) a oxígeno (
8 O
: 13,6 eV). Estas caídas se pueden explicar en términos de configuraciones electrónicas.
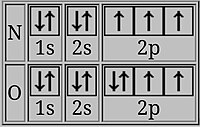
El boro tiene su último electrón en un orbital 2p, que tiene su densidad electrónica más lejos del núcleo en promedio que los electrones 2s en la misma capa. Los electrones 2s luego protegen al electrón 2p del núcleo hasta cierto punto, y es más fácil eliminar el electrón 2p del boro que eliminar un electrón 2s del berilio, lo que resulta en una energía de ionización más baja para B.
En el oxígeno, el último electrón comparte un orbital p doblemente ocupado con un electrón de espín opuesto. Los dos electrones en el mismo orbital están más juntos en promedio que dos electrones en diferentes orbitales, por lo que se protegen entre sí de manera más efectiva y es más fácil eliminar uno, lo que resulta en una energía de ionización más baja.
Además, después de cada elemento de gas noble, la energía de ionización cae drásticamente. Esto ocurre porque el electrón externo en los metales alcalinos requiere una cantidad mucho menor de energía para ser eliminado del átomo que las capas internas. Esto también da lugar a valores de electronegatividad bajos para los metales alcalinos.
Las tendencias y excepciones se resumen en las siguientes subsecciones:
La energía de ionización disminuye cuando
- Transitioning to a new period: an alkali metal easily loses one electron to leave an octet or pseudo-noble gas settings, so those elements have only small values for IE.
- Moviendo del bloqueo a la p-block: un p-orbital pierde un electron más fácilmente. Un ejemplo es berilio a borón, con configuración de electrones 1s2 2s2 2p1. Los electrones de 2s protegen el electron de 2p de mayor energía del núcleo, lo que hace que sea ligeramente más fácil de eliminar. Esto también ocurre de magnesio a aluminio.
- Ocupar un p-subshell con su primero electrones con giro opuesto a los otros electrones: como en nitrógeno (
7N
: 14,5 eV) al oxígeno (
8O
: 13,6 eV), así como fósforo (
15P
: 10.48 eV) azufre
16S
: 10.36 eV). La razón de esto es porque el oxígeno, el azufre y el selenio tienen energías de ionización dipping debido a los efectos de blindaje. Sin embargo, esta discontinua a partir de Tellurium donde el blindaje es demasiado pequeño para producir un dip. - Moviendo desde el d-block hasta el p-block: como en el caso del zinc (
30Zn
: 9.4 eV) al galio (
31Ga
: 6.0 eV) - Caso especial: disminución del plomo (por ejemplo)
82Pb
: 7.42 eV) a bismut (
83Bi
: 7.29 eV). Esto no puede atribuirse al tamaño (la diferencia es mínima: el plomo tiene un radio covalente de 146 pm, mientras que el bismuth es de 148 pm). Esto se debe a la división de la espina-órbita de la cáscara de 6p (el plomo está eliminando un electron del 6p estabilizado1/2 espina dorsal, pero el bismuto está eliminando uno de los 6p desestabilizados3/2 spinor). - Caso especial: disminución del radio (en inglés)
88Ra
: 5.27 eV) a actinium (
89Ac
: 5.17 eV), que es un interruptor de un s a un d orbital. Sin embargo el interruptor análogo del bario (
56Ba
: 5.2 eV) al lantano (
57La
: 5.6 eV) no muestra un cambio hacia abajo. - Lutetium
71Lu
) and lawrencium ()
103Lr
) ambos tienen energías de ionización inferiores a los elementos anteriores. En ambos casos el último electron añadido comienza una nueva subshell: 5d para Lu con configuración de electrones [Xe] 4f14 5d1 6s2, y 7p para Lr con configuración [Rn] 5f4 7s2 7p1. Estos dips en energías de ionización y lutetium y especialmente el lawrencium muestran que estos elementos pertenecen al d-block, y no al lantano y actinium.
La energía de ionización aumenta cuando
- Grupo 18 elementos de gas noble: Esto se debe a sus subcuencas de electrones completas, por lo que estos elementos requieren grandes cantidades de energía para eliminar un electrón.
- Grupo 12: Los elementos aquí, zinc (
30Zn
: 9,4 eV), cadmio (
48Cd
: 9,0 eV) y mercurio (
80Hg
: 10.4 eV) todos los valores repentinos de crecimiento de IE en contraste con sus elementos anteriores: cobre (
29Cu
: 7.7 eV), plata
47Ag
: 7,6 eV) y oro (
79Au
: 9,2 eV), respectivamente. Para el mercurio, se puede extrapolar que la estabilización relativista de los electrones de 6s aumenta la energía de ionización, además de un mal blindaje de 4f electrones que aumenta la carga nuclear efectiva en los electrones de valencia externa. Además, las configuraciones de electrones de bajada cerradas: [Ar] 3d10 4s2, [Kr] 4d105s2 y [Xe] 4f14 5d10 6s2 proporcionar mayor estabilidad. - Caso especial: cambio de rhodium
45Rh
: 7,5 eV) a palladium (
46Pd
: 8.3 eV). A diferencia de otros elementos del Grupo 10, el palladio tiene una mayor energía de ionización que el átomo anterior, debido a su configuración de electrones. En contraste con el níquel 3d8 4s2, y platino [Xe] 4f14 5d9 6s1, la configuración de electrones de Palladium es [Kr] 4d10 5s0 (aunque la regla Madelung predice [Kr] 4d8 5s2). Finalmente, el IE inferior de plata (
47Ag
: 7.6 eV) acentua aún más el alto valor para el palladio; el electron único añadido s se elimina con una menor energía de ionización que el palladio, lo que enfatiza el alto IE del palladio (como se muestra en los valores de tabla lineal arriba para IE) - El IE de gadolinio
64Gd
: 6.15 eV) es algo más alto que el anterior (
62Sm
: 5.64 eV), (
63Eu
: 5.67 eV) y siguientes elementos (
65Tb
: 5.86 eV), (
66Dy
: 5.94 eV). Esta anomalía se debe al hecho de que gadolinium valence d-subshell presta 1 electron del valence f-subshell. Ahora la subshell de valence es el d-subshell, y debido al mal blindaje de carga nuclear positiva por electrones del f-subshell, el electrón del valence d-subshell experimenta una mayor atracción hacia el núcleo, por lo tanto, aumentando la energía necesaria para eliminar el electron de valence (antiguo). - Moviéndose en elementos de bloqueo: Los elementos Sc con 3d1 configuración electrónica tiene superior IP
21Sc
: 6.56 eV) que el elemento anterior (
20Ca
: 6.11 eV), contrariamente a las disminuciones en el paso a los elementos de bloqueo y p-block. Los electrones 4 y 3d tienen una capacidad de blindaje similar: la órbita 3d forma parte de la cáscara n=3 cuya posición promedio está más cerca del núcleo que los 4s orbitales y la cáscara n=4, pero los electrones en los orbitales experimentan mayor penetración en el núcleo que los electrones en órbitas d. Así que el escudo mutuo de electrones 3d y 4s es débil, y la carga nuclear efectiva que actúa en el electron ionizado es relativamente grande. Yttrium
39Y
) tiene un IP superior (6.22 eV) que
38Sr
: 5.69 eV. - Moviéndose en elementos de bloqueo f; Los elementos (
57La
: 5.18 eV) y (
89Ac
: 5.17 eV) tienen sólo IP muy ligeramente inferior que sus elementos anteriores (
56Ba
: 5.21 eV) y (
88Ra
: 5.18 eV), aunque sus átomos son anomalías en que añaden un d-electron en lugar de un f-electron. Como se puede ver en el gráfico anterior para las energías de ionización, el fuerte aumento de los valores de IE de (
55Cs
a
56Ba
) es seguido por un pequeño aumento casi lineal a medida que se añaden electrones f. Esto se debe a la contracción de lantanoide (para lantanoides). Esta disminución del radio iónico se asocia con un aumento de la energía de ionización a su vez aumenta, ya que las dos propiedades se correlacionan entre sí. En cuanto a los elementos de bloque d, los electrones se añaden en una cáscara interior, de modo que no se forman nuevas cáscaras. La forma de los orbitales añadidos les impide penetrar en el núcleo para que los electrones que los ocupan tengan menos capacidad de blindaje.
Anomalías de energía de ionización en grupos
Los valores de energía de ionización tienden a disminuir al pasar a elementos más pesados dentro de un grupo, ya que más electrones proporcionan protección y, en general, las capas de valencia experimentan una atracción más débil del núcleo, atribuido al radio covalente más grande que aumenta al descender por un grupo Sin embargo, este no es siempre el caso. Como excepción, en el grupo 10 paladio (
46Pd
: 8,34 eV) tiene una energía de ionización más alta que el níquel (
28Ni
: 7,64 eV), contrario a la disminución general de los elementos de tecnecio
43Tc
a xenón
54Xe
. Estas anomalías se resumen a continuación:
- Grupo 1:
- La energía de ionización de hidrógeno es muy alta (a 13.59844 eV), en comparación con los metales alcalinos. Esto se debe a su único electrón (y por lo tanto, muy pequeña nube de electrones), que está cerca del núcleo. Del mismo modo, ya que no hay otros electrones que puedan causar blindaje, ese electron único experimenta la carga neta positiva total del núcleo.
- La energía de ionización de Francium es más alta que el metal alcalino precedente, cesio. Esto se debe a su pequeño radio iónico (y radio) debido a efectos relativistas. Debido a su gran masa y tamaño, esto significa que sus electrones están viajando a velocidades extremadamente altas, lo que resulta en los electrones que se acercan al núcleo de lo esperado, y por lo tanto son más difíciles de eliminar (IE más alto).
- Grupo 2: La energía de ionización de Radium es más alta que su anterior bario de metal alcalino, como francio, que también se debe a efectos relativistas. Los electrones, especialmente los electrones 1s, experiencia cargas nucleares muy eficaces. Para evitar caer en el núcleo, los electrones 1s deben moverse a velocidades muy altas, lo que hace que las correcciones relativistas especiales sean sustancialmente superiores a la hora clásica aproximada. Por el principio de incertidumbre, esto causa una contracción relativista de los 1s orbitales (y otros orbitales con densidad de electrones cerca del núcleo, especialmente ns y np orbitales). Por lo tanto esto causa una cascada de cambios de electrones, que finalmente resulta en los cáscaras de electrones exteriores que contratan y acercarse al núcleo.
- Grupo 4:
- La semejanza cercana de Hafnium en IE con zirconium. Los efectos de la contracción de la lantanoide todavía se pueden sentir después de los lanthanides. Se puede ver a través del radio atómico más pequeño del primero (que contradice la tendencia periódica observada Archived 2018-10-11 en la máquina Wayback) a las 159 pm (valor empírico), que difiere de las 155 pm de este último. Esto a su vez hace que sus energías de ionización aumenten en 18 kJ/mol−1.
- El IE de Titanium es más pequeño que el de hafnium y zirconium. La energía de ionización de Hafnium es similar al zirconio debido a la contracción de lantanoide. Sin embargo, por qué la energía de ionización de zirconio es más alta que los elementos anteriores permanece poco clara; no podemos atribuirlo al radio atómico ya que es más alto para el zirconio y el hafnio para las 15 pm. Tampoco podemos invocar condensado energía de ionización, ya que es más o menos la misma ([Ar] 3d2 4s2 para el titanio, mientras que [Kr] 4d2 5s2 para zirconio). Además, no hay órbitas media llenas ni totalmente llenas que podamos comparar. Por lo tanto, sólo podemos invocar el zirconio completo configuración de electrones, que es 1s22s22p63s23p63d104s24p64d25s2. La presencia de un subnivel 3d-block completo equivale a una mayor eficiencia de blindaje en comparación con los elementos 4d-block (que son sólo dos electrones).
- Grupo 5: similar al Grupo 4, el niobio y el equivalente son análogos entre sí, debido a su configuración de electrones y a la contracción de lantanoide que afecta a este último elemento. Ipso facto, su aumento significativo en IE en comparación con el elemento más importante del grupo, vanadium, se puede atribuir debido a sus electrones de bloqueo completo, además de su configuración de electrones. Otra noción intrigante es la órbita de los 5s medio llenos de niobio; debido a la repulsión y el intercambio de energía (en otras palabras, el "costos" de poner un electron en un subnivel de baja energía para llenarlo completamente en lugar de poner el electrón en una de alta energía) superando la brecha energética entre los electrones s- y d-(o f) bloque, la CE no sigue la regla Madelung.
- Grupo 6: al igual que sus grupos de precursores 4 y 5, el grupo 6 también registra valores altos cuando se mueve hacia abajo. El tungsteno es una vez más similar al molibdeno debido a sus configuraciones de electrones. Asimismo, también se atribuye al 3d-orbital completo en su configuración de electrones. Otra razón es la mitad llena de molibdeno 4d orbital debido a las energías del par de electrones violando el principio de aufbau.
- Grupos 7-12 Elementos del sexto período (rhenio, osmio, iridio, platino, oro y mercurio): Todos estos elementos tienen energías de ionización extremadamente altas en comparación con los elementos que les preceden en sus respectivos grupos. La esencia de esto se debe a la influencia de la contracción de lantanoide en los lantanoides post, además de la estabilización relativista de los 6s orbital.
- Grupo 13:
- El IE de Gallium es más alto que el de aluminio. Esto se debe una vez más a los d-orbitales, además de la contracción escandida, proporcionando un blindaje débil, y por lo tanto aumentan las cargas nucleares efectivas.
- El IE de Thallium, debido al mal blindaje de 4f electrones, además de la contracción de lantanoide, hace aumentar su IE en contraste con su indio precursor.
- Grupo 14: La energía de ionización inusualmente alta de Lead
82Pb
: 7.42 eV) es, al igual que el del talio del grupo 13, resultado de las subshelles 5d y 4f completas. La contracción de lantanoide y la detección ineficiente del núcleo por los electrones 4f resultan en un poco superior energía de ionización para plomo que para estaño (
50Sn
: 7.34 eV).
Modelo de Bohr para átomo de hidrógeno
La energía de ionización del átomo de hidrógeno (Z=1{displaystyle Z=1}) se puede evaluar en el modelo Bohr, que predice que el nivel de energía atómica n{displaystyle n} tiene energía
- E=− − 1n2Z2e22a0=− − Z2RHn2=− − Z213.6eVn2{displaystyle E=-{frac {1} {fn} {fn} {fn}} {fn}} {fn}} {fn}} {fn}} {fn}}}} {fn}}} {fn}} {fn}}} {fn}}} {fn}}}} {fn}}} {f}}}} {f}}} {f}}}}} {f}}}}}}}}}}}}}}}}}} {f} {f} {f} {f} {fn}}}}}}}}}} {f}} {f} {f} {f} {fn}}}}}}}}}}}}}}}}} {f}}}}f} {f} {f} {f} {fnfn}}}}}}}}}}}}}}}}}}}}}}}} {Z^{2}e^{2}{2a_{0}=-{frac} {Z^{2}R_{H} {n^{2}}={frac} {Z^{2}13.6 mathrm {eV} {n^{2}}}}}}
RH es la constante Rydberg para el átomo de hidrógeno. Para hidrógeno en el estado del suelo Z=1{displaystyle Z=1} y n=1{displaystyle n=1} para que la energía del átomo antes de la ionización sea simplemente E=− − 13.6eV{displaystyle E=-13.6mathrm {eV}
Después de la ionización, la energía es cero para un electrón inmóvil infinitamente lejos del protón, por lo que la energía de ionización es
- I=E()H+)− − E()H)=+13.6eV{displaystyle I=E(mathrm [H} ^{+})-E(mathrm {H})=+13.6\mathrm {eV}. Esto coincide con el valor experimental del átomo de hidrógeno.
Explicación mecánica cuántica
Según la teoría más completa de la mecánica cuántica, la ubicación de un electrón se describe mejor como una distribución de probabilidad dentro de una nube de electrones, es decir, un orbital atómico. La energía se puede calcular integrando sobre esta nube. La representación matemática subyacente de la nube es la función de onda, que se construye a partir de determinantes de Slater que consisten en orbitales de espín molecular. Estos están relacionados por el principio de exclusión de Pauli con los productos antisimetrizados de los orbitales atómicos o moleculares.
Hay dos formas principales de calcular la energía de ionización. En general, el cálculo para el Nla energía de ionización requiere calcular las energías de Z− − N+1{displaystyle Z-N+1} y Z− − N{displaystyle Z-N. Sistemas de electrones. Cálculo de estas energías exactamente no es posible excepto para los sistemas más simples (es decir, elementos de hidrógeno e hidrógeno), principalmente debido a dificultades para integrar los términos de correlación de electrones. Por lo tanto, los métodos de aproximación se emplean rutinariamente, con diferentes métodos que varían en complejidad (tiempo computacional) y precisión en comparación con los datos empíricos. Esto se ha convertido en un problema bien estudiado y se hace rutinariamente en la química computacional. La segunda manera de calcular las energías de ionización se utiliza principalmente en el nivel más bajo de la aproximación, donde la energía de ionización es proporcionada por el teorema de Koopmans, que implica la órbita molecular más alta ocupada o "HOMO" y la órbita molecular más baja no ocupada o "LUMO", y afirma que la energía de ionización de un átomo o molécula es igual a la energía de la órbita de la cual se expulsa el electrón. Esto significa que la energía de ionización es igual a la energía HOMO, que en una ecuación formal se puede escribir como: Ii=− − Ei{displaystyle I_{i}=-E_{i}.
Moléculas: energía de ionización vertical y adiabática

La ionización de moléculas a menudo conduce a cambios en la geometría molecular, y se definen dos tipos de (primera) energía de ionización: adiabático y vertical.
Energía de ionización adiabática
La energía de ionización adiabática de una molécula es la cantidad mínima de energía necesaria para extraer un electrón de una molécula neutra, es decir, la diferencia entre la energía del estado fundamental vibracional de las especies neutras (v& #34; = 0 nivel) y la del ion positivo (v' = 0). La geometría de equilibrio específica de cada especie no afecta este valor.
Energía de ionización vertical
Debido a los posibles cambios en la geometría molecular que pueden resultar de la ionización, pueden existir transiciones adicionales entre el estado fundamental vibratorio de las especies neutras y los estados vibratorios excitados del ion positivo. En otras palabras, la ionización va acompañada de excitación vibratoria. La intensidad de tales transiciones se explica por el principio de Franck-Condon, que predice que la transición más probable e intensa corresponde al estado vibracionalmente excitado del ion positivo que tiene la misma geometría que la molécula neutra. Esta transición se conoce como "vertical" energía de ionización ya que está representada por una línea completamente vertical en un diagrama de energía potencial (ver Figura).
Para una molécula diatómica, la geometría se define por la longitud de un enlace sencillo. La eliminación de un electrón de un orbital molecular enlazante debilita el enlace y aumenta la longitud del enlace. En la Figura 1, la curva de energía potencial inferior es para la molécula neutra y la superficie superior es para el ion positivo. Ambas curvas trazan la energía potencial en función de la longitud del enlace. Las líneas horizontales corresponden a los niveles de vibración con sus funciones de onda vibratoria asociadas. Dado que el ion tiene un enlace más débil, tendrá una longitud de enlace más larga. Este efecto se representa desplazando el mínimo de la curva de energía potencial hacia la derecha de la especie neutra. La ionización adiabática es la transición diagonal al estado fundamental vibracional del ion. La ionización vertical puede implicar una excitación vibratoria del estado iónico y, por lo tanto, requiere una mayor energía.
En muchas circunstancias, la energía de ionización adiabática suele ser una cantidad física más interesante, ya que describe la diferencia de energía entre las dos superficies de energía potencial. Sin embargo, debido a limitaciones experimentales, la energía de ionización adiabática suele ser difícil de determinar, mientras que la energía de desprendimiento vertical es fácilmente identificable y medible.
Análogos de la energía de ionización a otros sistemas
Si bien el término energía de ionización se usa principalmente solo para especies atómicas, catiónicas o moleculares en fase gaseosa, hay una serie de cantidades análogas que consideran la cantidad de energía necesaria para extraer un electrón de otros sistemas físicos.
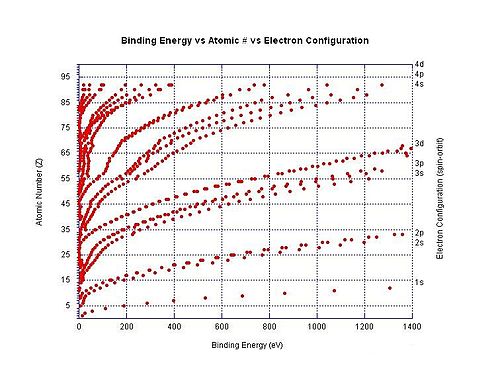
Energía de enlace de electrones
La energía de enlace de electrones es un término genérico para la energía mínima necesaria para eliminar un electrón de una capa de electrones particular para un átomo o ion, debido a que estos electrones cargados negativamente se mantienen en su lugar por la atracción electrostática del núcleo cargado positivamente. Por ejemplo, la energía de enlace de electrones para quitar un electrón 3p3/2 del ion cloruro es la cantidad mínima de energía requerida para quitar un electrón del átomo de cloro cuando tiene una carga de -1. En este ejemplo particular, la energía de enlace de electrones tiene la misma magnitud que la afinidad electrónica por el átomo de cloro neutro. En otro ejemplo, la energía de enlace de electrones se refiere a la cantidad mínima de energía requerida para eliminar un electrón del dianión de dicarboxilato −O2C(CH2)8CO−
2.
El gráfico de la derecha muestra la energía de enlace de los electrones en diferentes capas en átomos neutros. La energía de ionización es la energía de enlace más baja para un átomo en particular (aunque no se muestran todas en el gráfico).
Superficies sólidas: función de trabajo
La función de trabajo es la cantidad mínima de energía necesaria para extraer un electrón de una superficie sólida, donde la función de trabajo W para una superficie dada es definida por la diferencia
- W=− − eφ φ − − EF,{displaystyle ¿Qué?
donde −e es la carga de un electrón, ϕ es el potencial electrostático en el vacío cerca de la superficie, y EF es el nivel de Fermi (potencial electroquímico de electrones) dentro del material.
Nota
- ^ No obstante, aún es necesario seguir investigando para corroborar esta mera inferencia.
Contenido relacionado
Superparamagnetismo
Elemento del período 5
Grupo hidroxi