Ozono
El ozono, o trioxígeno, es una molécula inorgánica con la fórmula química O3. Es un gas de color azul pálido con un olor claramente acre. Es un alótropo de oxígeno que es mucho menos estable que el alótropo diatómico O2, descomponiéndose en la atmósfera inferior a O2(dioxígeno). El ozono se forma a partir del dioxígeno por la acción de la luz ultravioleta (UV) y las descargas eléctricas dentro de la atmósfera terrestre. Está presente en concentraciones muy bajas en todo este último, con su concentración más alta en la capa de ozono de la estratosfera, que absorbe la mayor parte de la radiación ultravioleta (UV) del Sol.
El olor del ozono recuerda al del cloro y es detectable por muchas personas en concentraciones de tan solo0,1 ppm en el aire. La estructura del O 3 del ozono se determinó en 1865. Más tarde se demostró que la molécula tenía una estructura doblada y que era débilmente diamagnética. En condiciones estándar, el ozono es un gas azul pálido que se condensa a temperaturas criogénicas en un líquido azul oscuro y finalmente en un sólido negro violeta. La inestabilidad del ozono con respecto al dioxígeno más común es tal que tanto el gas concentrado como el ozono líquido pueden descomponerse explosivamente a temperaturas elevadas, choque físico o calentamiento rápido hasta el punto de ebullición. Por lo tanto, se usa comercialmente solo en bajas concentraciones.
El ozono es un oxidante poderoso (mucho más que el dioxígeno) y tiene muchas aplicaciones industriales y de consumo relacionadas con la oxidación. Sin embargo, este mismo alto potencial oxidante hace que el ozono dañe las mucosas y los tejidos respiratorios de los animales, y también los tejidos de las plantas, por encima de las concentraciones de aproximadamente0,1 ppm. Si bien esto hace que el ozono sea un potente peligro respiratorio y contaminante cerca del nivel del suelo, una mayor concentración en la capa de ozono (de dos a ocho ppm) es beneficiosa, ya que evita que la dañina luz ultravioleta llegue a la superficie de la Tierra.
Nomenclatura
El nombre trivial de ozono es el nombre IUPAC más utilizado y preferido. Los nombres sistemáticos 2λ - trioxidieno y catena-trioxígeno, nombres IUPAC válidos, se construyen según las nomenclaturas sustitutiva y aditiva, respectivamente. El nombre ozono deriva de ozein (ὄζειν), el verbo griego para oler, que se refiere al olor característico del ozono.
En contextos apropiados, el ozono puede verse como trioxidano con dos átomos de hidrógeno eliminados y, como tal, trioxidanilideno puede usarse como un nombre sistemático, de acuerdo con la nomenclatura sustitutiva. Por defecto, estos nombres no tienen en cuenta la radicalidad de la molécula de ozono. En un contexto aún más específico, esto también puede denominar el estado fundamental de singlete no radical, mientras que el estado diradical se denomina trioxidanediyl.
Trioxidanediyl (u ozonide) se usa, de manera no sistemática, para referirse al grupo sustituyente (-OOO-). Se debe tener cuidado para evitar confundir el nombre del grupo con el nombre específico del contexto para el ozono dado anteriormente.
Historia
En 1785, el químico holandés Martinus van Marum estaba realizando experimentos con chispas eléctricas sobre el agua cuando notó un olor inusual, que atribuyó a las reacciones eléctricas, sin darse cuenta de que, de hecho, había creado ozono.
Medio siglo después, Christian Friedrich Schönbein notó el mismo olor acre y lo reconoció como el olor que suele seguir a un relámpago. En 1839, logró aislar el químico gaseoso y lo llamó "ozono", de la palabra griega ozein (ὄζειν) que significa "oler". Por esta razón, a Schönbein generalmente se le atribuye el descubrimiento del ozono. La fórmula del ozono, O 3, no fue determinada hasta 1865 por Jacques-Louis Soret y confirmada por Schönbein en 1867.
Durante gran parte de la segunda mitad del siglo XIX y hasta bien entrado el XX, los naturalistas y buscadores de salud consideraban que el ozono era un componente saludable del medio ambiente. Beaumont, California, tenía como lema oficial "Beaumont: Zone of Ozone", como se evidencia en las postales y el membrete de la Cámara de Comercio. Los naturalistas que trabajaban al aire libre a menudo consideraban beneficiosas las elevaciones más altas debido a su contenido de ozono. "Hay una atmósfera bastante diferente [a mayor altura] con suficiente ozono para sustentar la energía necesaria [para trabajar]", escribió el naturalista Henry Henshaw, que trabaja en Hawái. El aire de la costa se consideraba saludable debido a su supuesto contenido de ozono; pero el olor que da lugar a esta creencia es, de hecho, el de los metabolitos de algas marinas halogenadas.
Gran parte del atractivo del ozono parece deberse a su olor "fresco", que evocaba asociaciones con propiedades purificadoras. Los científicos, sin embargo, notaron sus efectos nocivos. En 1873, James Dewar y John Gray McKendrick documentaron que las ranas se volvían lentas, las aves jadeaban y la sangre de los conejos mostraba niveles reducidos de oxígeno después de la exposición al "aire ozonizado", que "ejerceba una acción destructiva". El propio Schönbein informó que, como resultado de la inhalación de ozono, se produjeron dolores en el pecho, irritación de las membranas mucosas y dificultad para respirar, y los pequeños mamíferos murieron. En 1911, Leonard Hill y Martin Flack declararon en Proceedings of the Royal Society Bque los efectos saludables del ozono "se han convertido, por mera iteración, en parte integrante de la creencia común; y, sin embargo, la evidencia fisiológica exacta a favor de sus buenos efectos ha faltado hasta ahora casi por completo... El único conocimiento completamente comprobado sobre el efecto fisiológico del ozono, alcanzado hasta ahora, es que causa irritación y edema de los pulmones, y la muerte si se inhala en concentraciones relativamente fuertes durante cualquier tiempo".
Durante la Primera Guerra Mundial, el ozono se probó en el Hospital Militar Queen Alexandra de Londres como posible desinfectante para heridas. El gas se aplicó directamente a las heridas durante 15 minutos. Esto resultó en daños tanto a las células bacterianas como al tejido humano. Se consideraron preferibles otras técnicas de desinfección, como la irrigación con antisépticos.
Hasta la década de 1920, todavía no estaba claro si pequeñas cantidades de oxozono, O4, también estuvieron presentes en muestras de ozono debido a la dificultad de aplicar técnicas de química analítica al químico concentrado explosivo. En 1923, Georg-Maria Schwab (trabajando en su tesis doctoral con Ernst Hermann Riesenfeld) fue el primero en solidificar con éxito el ozono y realizar un análisis preciso que refutó de manera concluyente la hipótesis del oxozono. En la década de 1920, el grupo de Riesenfeld determinó otras propiedades físicas del ozono concentrado puro que no se habían medido hasta ahora.
Propiedades físicas
El ozono es un gas incoloro o de color azul pálido, poco soluble en agua y mucho más soluble en disolventes no polares inertes como el tetracloruro de carbono o los fluorocarbonos, en los que forma una solución azul. A 161 K (-112 °C; -170 °F), se condensa para formar un líquido azul oscuro. Es peligroso dejar que este líquido se caliente hasta su punto de ebullición, porque tanto el ozono gaseoso concentrado como el ozono líquido pueden detonar. A temperaturas inferiores a 80 K (−193,2 °C; −315,7 °F), forma un sólido de color negro violeta.
La mayoría de las personas pueden detectar alrededor de 0,01 μmol/mol de ozono en el aire, donde tiene un olor fuerte muy específico que se parece un poco a la lejía con cloro. La exposición de 0,1 a 1 μmol/mol produce dolores de cabeza, ardor en los ojos e irritación de las vías respiratorias. Incluso las bajas concentraciones de ozono en el aire son muy destructivas para los materiales orgánicos como el látex, los plásticos y el tejido pulmonar animal.
El ozono es débilmente diamagnético.
Estructura
Según la evidencia experimental de la espectroscopia de microondas, el ozono es una molécula doblada, con simetría C 2v (similar a la molécula de agua). Las distancias O – O son 127,2 pm (1,272 Å). El ángulo O – O – O es 116,78°. El átomo central tiene hibridación sp² con un par solitario. El ozono es una molécula polar con un momento dipolar de 0,53 D. La molécula se puede representar como un híbrido de resonancia con dos estructuras contribuyentes, cada una con un enlace simple en un lado y un enlace doble en el otro. El arreglo posee un orden de enlace general de 1.5 para ambos lados. Es isoelectrónico con el anión nitrito. El ozono natural puede estar compuesto de isótopos sustituidos (O, O,O). Se ha predicho una forma cíclica pero no se ha observado.
 Estructuras de resonancia de Lewis de la molécula de ozono
Estructuras de resonancia de Lewis de la molécula de ozono
Reacciones
El ozono es uno de los agentes oxidantes más poderosos que se conocen, mucho más fuerte que el O 2. También es inestable a altas concentraciones, descomponiéndose en oxígeno diatómico ordinario. Su vida media varía con las condiciones atmosféricas como la temperatura, la humedad y el movimiento del aire. En condiciones de laboratorio, el tiempo de vida media (HLT) promediará ~1500 minutos (25 horas) en aire quieto a temperatura ambiente (24 °C), cero humedad con cero cambios de aire por hora (ACH). Como tal, en un ambiente típico de oficina o hogar, donde los cambios de aire por hora varían entre 5 y 8 ACH, el ozono tiene una vida media de tan solo treinta minutos.2 O3→ 3O2
Esta reacción procede más rápidamente al aumentar la temperatura. La deflagración del ozono puede ser provocada por una chispa y puede ocurrir en concentraciones de ozono del 10% en peso o más.
El ozono también se puede producir a partir del oxígeno en el ánodo de una celda electroquímica. Esta reacción puede crear cantidades más pequeñas de ozono para fines de investigación.O3(g) + 2H + 2e ⇌ O2(g) + H2O E °= 2.075V
Esto se puede observar como una reacción no deseada en un aparato de gas Hoffman durante la electrólisis del agua cuando el voltaje se establece por encima del voltaje necesario.
Con metales
El ozono oxidará la mayoría de los metales (excepto el oro, el platino y el iridio) a óxidos de los metales en su estado de oxidación más alto. Por ejemplo:Cu + O3→ CuO + O2Ag + O3→ AgO + O2
Con nitrógeno y compuestos de carbono
El ozono también oxida el óxido nítrico a dióxido de nitrógeno:NO + O3→ NO2+ O2
Esta reacción va acompañada de quimioluminiscencia. el NO2se puede oxidar aún más a radical nitrato:NO2+ O3→ NO3+ O2
el NO3formado puede reaccionar con NO2para formar N2O5.
El perclorato de nitronio sólido se puede hacer a partir de NO 2, ClO 2 y O3gases:NO2+ ClO2+ 2O3→ NO2Cl O4+ 2O2
El ozono no reacciona con las sales de amonio, pero oxida el amoníaco a nitrato de amonio:2 NH3+ 4O3→ NH4NO3+ 4O2+ H2O
El ozono reacciona con el carbono para formar dióxido de carbono, incluso a temperatura ambiente:C + 2O3→ CO2+ 2O2
Con compuestos de azufre
El ozono oxida los sulfuros a sulfatos. Por ejemplo, el sulfuro de plomo (II) se oxida a sulfato de plomo (II):PbS + 4 O 3 → PbSO 4 + 4 O 2
El ácido sulfúrico se puede producir a partir de ozono, agua y azufre elemental o dióxido de azufre:S + H 2 O + O 3 → H 2 SO 43 SO 2 + 3 H 2 O + O 3 → 3 H 2 SO 4
En la fase gaseosa, el ozono reacciona con el sulfuro de hidrógeno para formar dióxido de azufre:H 2 S + O 3 → SO 2 + H 2 O
En una solución acuosa, sin embargo, ocurren dos reacciones simultáneas en competencia, una para producir azufre elemental y otra para producir ácido sulfúrico:H 2 S + O 3 → S + O 2 + H 2 O3 H 2 S + 4 O 3 → 3 H 2 SO 4
Con alquenos y alquinos
Los alquenos se pueden escindir oxidativamente con ozono, en un proceso llamado ozonólisis, dando alcoholes, aldehídos, cetonas y ácidos carboxílicos, dependiendo del segundo paso del proceso.
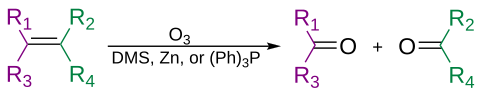
El ozono también puede escindir los alquinos para formar un producto de anhídrido ácido o dicetona. Si la reacción se realiza en presencia de agua, el anhídrido se hidroliza para dar dos ácidos carboxílicos.

Por lo general, la ozonólisis se lleva a cabo en una solución de diclorometano, a una temperatura de -78 °C. Después de una secuencia de escisión y reordenamiento, se forma un ozónido orgánico. Con el tratamiento reductor (p. ej., zinc en ácido acético o sulfuro de dimetilo), se formarán cetonas y aldehídos, con el tratamiento oxidativo (p. ej., peróxido de hidrógeno acuoso o alcohólico), se formarán ácidos carboxílicos.
Otros sustratos
Los tres átomos de ozono también pueden reaccionar, como en la reacción del cloruro de estaño (II) con ácido clorhídrico y ozono: 
El perclorato de yodo se puede hacer tratando el yodo disuelto en ácido perclórico anhidro frío con ozono: 
El ozono también podría reaccionar con el yoduro de potasio para dar oxígeno y yodo gaseoso que se puede valorar para la determinación cuantitativa: 
Combustión
El ozono se puede utilizar para reacciones de combustión y gases combustibles; el ozono proporciona temperaturas más altas que la combustión en dioxígeno (O 2). La siguiente es una reacción para la combustión de subnitruro de carbono que también puede causar temperaturas más altas:3C _4norte2+ 4O3→ 12 CO + 3 N2
El ozono puede reaccionar a temperaturas criogénicas. A 77 K (-196,2 °C; -321,1 °F), el hidrógeno atómico reacciona con el ozono líquido para formar un radical superóxido de hidrógeno, que se dimeriza:H+ O3→ HO 2 + O2 HO 2 → H2O4
Descomposición del ozono
Tipos de descomposición del ozono
El ozono es una sustancia tóxica, comúnmente encontrada o generada en entornos humanos (cabinas de aviones, oficinas con fotocopiadoras, impresoras láser, esterilizadores...) y su descomposición catalítica es muy importante para reducir la contaminación. Este tipo de descomposición es la más utilizada, especialmente con catalizadores sólidos, y tiene muchas ventajas como una mayor conversión a menor temperatura. Además, el producto y el catalizador pueden separarse instantáneamente, y de esta manera el catalizador puede recuperarse fácilmente sin utilizar ninguna operación de separación. Además, los materiales más utilizados en la descomposición catalítica del ozono en fase gaseosa son los metales nobles como Pt, Rh o Pd y los metales de transición como Mn, Co, Cu, Fe, Ni o Ag.
Existen otras dos posibilidades para la descomposición del ozono en fase gaseosa:
La primera es una descomposición térmica donde el ozono puede descomponerse utilizando únicamente la acción del calor. El problema es que este tipo de descomposición es muy lenta con temperaturas por debajo de los 250 °C. Sin embargo, la velocidad de descomposición se puede aumentar trabajando con temperaturas más altas, pero esto implicaría un alto costo de energía.
La segunda es una descomposición fotoquímica, que consiste en irradiar ozono con radiación ultravioleta (UV) y da lugar a oxígeno y peróxido radical.
Cinética de la descomposición del ozono en oxígeno molecular
El proceso de descomposición del ozono es una reacción compleja que involucra dos reacciones elementales que finalmente conducen al oxígeno molecular, y esto significa que el orden de reacción y la ley de velocidad no pueden determinarse mediante la estequiometría de la ecuación ajustada.
Reacción global: 2 O 3 → 3 O 2
Ley de velocidad (observada): V = K · [O 3 ] · [O 2 ]
Se ha determinado que la descomposición del ozono sigue una cinética de primer orden, y de la ley de velocidad anterior se puede determinar que el orden parcial respecto al oxígeno molecular es -1 y respecto al ozono es 2, por lo tanto el orden global de reacción es 1.
La descomposición del ozono consta de dos pasos elementales: El primero corresponde a una reacción unimolecular porque una sola molécula de ozono se descompone en dos productos (oxígeno molecular y oxígeno). Entonces, el oxígeno del primer paso es un intermedio porque participa como reactivo en el segundo paso, que es una reacción bimolecular porque hay dos reactivos diferentes (ozono y oxígeno) que dan lugar a un producto, que corresponde al oxígeno molecular. en fase gaseosa.
Paso 1: Reacción unimolecular O 3 → O 2 + O
Paso 2: reacción bimolecular O 3 + O → 2 O 2
Estos dos pasos tienen diferentes velocidades de reacción, la primera es reversible y más rápida que la segunda reacción, que es más lenta, por lo que el paso determinante es la segunda reacción y esta se usa para determinar la velocidad de reacción observada. Las leyes de velocidad de reacción para cada paso son las siguientes:
V 1 = K 1 · [O 3 ] V 2 = K 2 · [O] · [O 3 ]
El siguiente mecanismo permite explicar la ley de velocidad de descomposición del ozono observada experimentalmente, y también permite determinar los órdenes de reacción con respecto al ozono y al oxígeno, con lo cual se determinará el orden de reacción global. El paso más lento, la reacción bimolecular, es el que determina la velocidad de formación del producto, y considerando que este paso da lugar a dos moléculas de oxígeno, la ley de velocidad tiene esta forma:
V = 2 K 2 · [O] · [O 3 ]
Sin embargo, esta ecuación depende de la concentración de oxígeno (intermedio), que se puede determinar considerando el primer paso. Dado que el primer paso es más rápido y reversible y el segundo más lento, los reactivos y productos del primer paso están en equilibrio, por lo que la concentración del intermedio se puede determinar de la siguiente manera:
Luego, usando estas ecuaciones, la tasa de formación de oxígeno molecular es como se muestra a continuación:
Finalmente, el mecanismo presentado permite establecer la velocidad observada experimentalmente, con una velocidad constante (K obs) y correspondiente a una cinética de primer orden, como sigue:
donde
Reducción a ozónidos
La reducción del ozono da el anión ozónido, O3. Los derivados de este anión son explosivos y deben almacenarse a temperaturas criogénicas. Se conocen ozónidos para todos los metales alcalinos. KO 3, RbO 3 y CsO 3 se pueden preparar a partir de sus respectivos superóxidos:KO 2 + O 3 → KO 3 + O 2
Aunque el KO 3 se puede formar como se indicó anteriormente, también se puede formar a partir de hidróxido de potasio y ozono:2 KOH + 5 O 3 → 2 KO 3 + 5 O 2 + H 2 O
El NaO 3 y el LiO 3 deben prepararse por la acción del CsO 3 en NH 3 líquido sobre una resina de intercambio iónico que contenga iones Na o Li:CsO 3 + Na → Cs + NaO 3
Una solución de calcio en amoniaco reacciona con el ozono para dar ozonuro de amonio y no ozonuro de calcio:3 Ca + 10 NH 3 + 6 O3→ Ca·6NH 3 + Ca(OH) 2 + Ca(NO 3) 2 + 2 NH 4 O 3 + 2 O 2 + H 2
Aplicaciones
El ozono se puede utilizar para eliminar el hierro y el manganeso del agua, formando un precipitado que se puede filtrar:2 Fe + O 3 + 5 H 2 O → 2 Fe(OH) 3 (s) + O 2 + 4 H2 Mn + 2 O 3 + 4 H 2 O → 2 MnO(OH) 2 (s) + 2 O 2 + 4 H
El ozono también oxidará el sulfuro de hidrógeno disuelto en agua a ácido sulfuroso:3 O3+ H 2 S → H 2 SO 3 + 3 O 2
Estas tres reacciones son centrales en el uso del tratamiento de agua de pozo basado en ozono.
El ozono también desintoxicará los cianuros al convertirlos en cianatos.CN + O 3 → CNO+ O 2
El ozono también descompondrá completamente la urea:(NH 2) 2 CO + O 3 → N 2 + CO 2 + 2 H 2 O
Propiedades espectroscópicas
El ozono es una molécula triatómica doblada con tres modos de vibración: el estiramiento simétrico (1103,157 cm), la flexión (701,42 cm) y el estiramiento antisimétrico (1042,096 cm). El estiramiento y la curvatura simétricos son absorbentes débiles, pero el estiramiento antisimétrico es fuerte y responsable de que el ozono sea un importante gas de efecto invernadero menor. Esta banda IR también se usa para detectar ozono ambiental y atmosférico, aunque las mediciones basadas en UV son más comunes.
El espectro electromagnético del ozono es bastante complejo. Se puede ver una descripción general en MPI Mainz UV/VIS Spectral Atlas of Gaseous Molecules of Atmospheric Interest.
Todas las bandas son disociativas, lo que significa que la molécula se deshace en O + O 2 después de absorber un fotón. La absorción más importante es la banda de Hartley, que se extiende desde un poco más de 300 nm hasta un poco más de 200 nm. Es esta banda la responsable de absorber los rayos UV C en la estratosfera.
En el lado de la longitud de onda alta, la banda de Hartley pasa a la llamada banda de Huggins, que cae rápidamente hasta desaparecer en ~360 nm. Por encima de 400 nm, extendiéndose bien hacia el NIR, están las bandas de Chappius y Wulf. Allí, las bandas de absorción no estructuradas son útiles para detectar altas concentraciones ambientales de ozono, pero son tan débiles que no tienen mucho efecto práctico.
Hay bandas de absorción adicionales en el UV lejano, que aumentan lentamente desde 200 nm hasta alcanzar un máximo de ~120 nm.
Ozono en la atmósfera terrestre
La forma estándar de expresar los niveles totales de ozono (la cantidad de ozono en una columna vertical dada) en la atmósfera es usando unidades Dobson. Las mediciones puntuales se informan como fracciones molares en nmol/mol (partes por billón, ppb) o como concentraciones en μg/m. El estudio de la concentración de ozono en la atmósfera comenzó en la década de 1920.
Capa de ozono
Ubicación y producción
Los niveles más altos de ozono en la atmósfera se encuentran en la estratosfera, en una región también conocida como la capa de ozono, entre unos 10 km y 50 km sobre la superficie (o entre unas 6 y 31 millas). Sin embargo, incluso en esta "capa", las concentraciones de ozono son sólo de dos a ocho partes por millón, por lo que la mayor parte del oxígeno es dioxígeno, O 2, a unas 210 000 partes por millón en volumen.
El ozono en la estratosfera se produce principalmente a partir de rayos ultravioleta de onda corta entre 240 y 160 nm. El oxígeno comienza a absorberse débilmente a 240 nm en las bandas de Herzberg, pero la mayor parte del oxígeno se disocia por absorción en las fuertes bandas de Schumann-Runge entre 200 y 160 nm donde el ozono no absorbe. Si bien la luz de longitud de onda más corta, que se extiende incluso hasta el límite de rayos X, es lo suficientemente energética como para disociar el oxígeno molecular, hay relativamente poca y la fuerte emisión solar en Lyman-alfa, 121 nm, cae en un punto donde el oxígeno molecular la absorción es mínima.
El proceso de creación y destrucción del ozono se denomina ciclo de Chapman y comienza con la fotólisis del oxígeno molecular. 
seguido por la reacción del átomo de oxígeno con otra molécula de oxígeno para formar ozono.O + O2+ M → O3+ M
donde "M" denota el tercer cuerpo que se lleva el exceso de energía de la reacción. La molécula de ozono puede absorber un fotón UV-C y disociarO3→ O + O2+ energía cinética
El exceso de energía cinética calienta la estratosfera cuando los átomos de O y el oxígeno molecular se separan y chocan con otras moléculas. Esta conversión de luz ultravioleta en energía cinética calienta la estratosfera. Los átomos de oxígeno producidos en la fotólisis del ozono luego reaccionan con otra molécula de oxígeno como en el paso anterior para formar más ozono. En la atmósfera clara, con solo nitrógeno y oxígeno, el ozono puede reaccionar con el oxígeno atómico para formar dos moléculas de O 2O3+ O → 2 O2
Una estimación de la tasa de este paso de terminación del ciclo del oxígeno atómico de regreso al ozono se puede encontrar simplemente tomando las proporciones de la concentración de O 2 a O 3. La reacción de terminación está catalizada por la presencia de ciertos radicales libres, de los cuales los más importantes son el hidroxilo (OH), el óxido nítrico (NO) y el cloro atómico (Cl) y el bromo (Br). En la segunda mitad del siglo XX, se descubrió que la cantidad de ozono en la estratosfera estaba disminuyendo, principalmente debido al aumento de las concentraciones de clorofluorocarbonos (CFC) y moléculas orgánicas cloradas y bromadas similares. La preocupación por los efectos en la salud de la disminución condujo al Protocolo de Montreal de 1987, la prohibición de la producción de muchos productos químicos que agotan la capa de ozono y en la primera y segunda década del siglo XXI el comienzo de la recuperación de las concentraciones de ozono estratosférico.
Importancia para la vida que habita en la superficie de la Tierra
El ozono en la capa de ozono filtra las longitudes de onda de la luz solar desde aproximadamente 200 nm de rayos UV hasta 315 nm, con una absorción máxima de ozono de aproximadamente 250 nm.Esta absorción de UV por ozono es importante para la vida, ya que extiende la absorción de UV por el oxígeno y el nitrógeno ordinarios en el aire (que absorben todas las longitudes de onda < 200 nm) a través de la UV-C inferior (200–280 nm) y toda la UV-B. banda (280–315 nm). La pequeña parte no absorbida que queda de UV-B después de pasar a través del ozono causa quemaduras solares en humanos y daño directo al ADN en tejidos vivos tanto en plantas como en animales. El efecto del ozono sobre los rayos UV-B de rango medio se ilustra por su efecto sobre los rayos UV-B a 290 nm, que tiene una intensidad de radiación 350 millones de veces más poderosa en la parte superior de la atmósfera que en la superficie. Sin embargo, suficiente radiación UV-B a una frecuencia similar alcanza el suelo para causar algunas quemaduras solares, y estas mismas longitudes de onda también se encuentran entre las responsables de la producción de vitamina D en humanos.
La capa de ozono tiene poco efecto sobre las longitudes de onda UV más largas llamadas UV-A (315–400 nm), pero esta radiación no causa quemaduras solares ni daño directo al ADN, y aunque probablemente cause daño a largo plazo en la piel de ciertos humanos, no es tan peligroso para las plantas ni para la salud de los organismos que habitan en la superficie de la Tierra en general (ver ultravioleta para obtener más información sobre el ultravioleta cercano).
Ozono de bajo nivel
| Parte de una serie sobre |
| Contaminación |
|---|
 |
| showLa contaminación del aire |
| showContaminación biológica |
| showContaminación electromagnética |
| showContaminación natural |
| showLa contaminación acústica |
| showcontaminación por radiación |
| showLa contaminación del suelo |
| showContaminación por residuos sólidos |
| showContaminación espacial |
| showContaminación térmica |
| showContaminación visual |
| showContaminación de guerra |
| showLa contaminación del agua |
| showVarios |
| vtmi |
El ozono de bajo nivel (u ozono troposférico) es un contaminante atmosférico. No lo emiten directamente los motores de los automóviles ni las operaciones industriales, sino que se forma por la reacción de la luz solar en el aire que contiene hidrocarburos y óxidos de nitrógeno que reaccionan para formar ozono directamente en la fuente de contaminación o muchos kilómetros a favor del viento.
El ozono reacciona directamente con algunos hidrocarburos como los aldehídos y, por lo tanto, comienza su eliminación del aire, pero los productos son en sí mismos componentes clave del smog. La fotólisis del ozono por luz ultravioleta conduce a la producción del radical hidroxilo HO• y esto juega un papel en la eliminación de hidrocarburos del aire, pero también es el primer paso en la creación de componentes del smog como los nitratos de peroxiacilo, que pueden ser poderosos. irritantes oculares. El tiempo de vida atmosférico del ozono troposférico es de unos 22 días; sus principales mecanismos de remoción son por depósito al suelo, dando la reacción mencionada HO•, y por reacciones con OH y el radical peroxi HO 2 •.
Existe evidencia de una reducción significativa en los rendimientos agrícolas debido al aumento del ozono a nivel del suelo y la contaminación que interfiere con la fotosíntesis y atrofia el crecimiento general de algunas especies de plantas. La Agencia de Protección Ambiental de los Estados Unidos propone una regulación secundaria para reducir el daño a los cultivos, además de la regulación primaria diseñada para la protección de la salud humana.
Nivel bajo de ozono en áreas urbanas
Ciertos ejemplos de ciudades con lecturas de ozono elevadas son Denver, Colorado; Houston, Texas; y Ciudad de México, México. Houston tiene una lectura de alrededor de 41 nmol/mol, mientras que la Ciudad de México es mucho más peligrosa, con una lectura de alrededor de 125 nmol/mol.
El ozono de bajo nivel, u ozono troposférico, es el tipo de contaminación por ozono más preocupante en las zonas urbanas y, en general, está aumentando. La contaminación por ozono en áreas urbanas afecta a poblaciones más densas y se ve agravada por una gran cantidad de vehículos, que emiten contaminantes NO 2 y COV, los principales contribuyentes a los niveles problemáticos de ozono. La contaminación por ozono en las áreas urbanas es especialmente preocupante con el aumento de las temperaturas, lo que aumenta la mortalidad relacionada con el calor durante las olas de calor. Durante las olas de calor en las zonas urbanas, la contaminación por ozono a nivel del suelo puede ser un 20 % más alta de lo habitual. La contaminación por ozono en las áreas urbanas alcanza niveles más altos de superación en el verano y el otoño, lo que puede explicarse por los patrones climáticos y de tráfico.Es necesario realizar más investigaciones específicamente sobre qué poblaciones en áreas urbanas se ven más afectadas por el ozono, ya que las personas de color y las personas que viven en la pobreza se ven más afectadas por la contaminación en general, aunque es menos probable que estas poblaciones contribuyan a los niveles de contaminación.
Como se mencionó anteriormente, Denver, Colorado, es una de las muchas ciudades de los Estados Unidos que tienen altas cantidades de ozono. Según la Asociación Estadounidense del Pulmón, el área de Denver-Aurora es la decimocuarta área más contaminada con ozono en los Estados Unidos. El problema de los altos niveles de ozono no es nuevo en esta área. En 2004, "la Agencia de Protección Ambiental de EE. UU. designó a Denver Metro/North Front Range (Adams, Arapahoe, Boulder, Broomfield, Denver, Douglas, Jefferson y partes de los condados de Larimer y Weld) como incumplimiento del estándar de ozono de 8 horas de 1997 ",pero luego pospuso este estado de incumplimiento hasta 2007. El estándar de incumplimiento indica que un área no cumple con los estándares de calidad del aire de la EPA. El Plan de Acción del Ozono de Colorado se creó en respuesta y se implementaron numerosos cambios a partir de este plan. El primer cambio importante fue que las pruebas de emisiones de automóviles se ampliaron en todo el estado a más condados que anteriormente no exigían pruebas de emisiones, como las áreas de Larimer y el condado de Weld. También se han realizado cambios para disminuir las emisiones de óxidos de nitrógeno (NOx) y compuestos orgánicos volátiles (COV), lo que debería ayudar a reducir los niveles de ozono.
Un gran contribuyente a los altos niveles de ozono en el área es la industria del petróleo y el gas natural situada en la cuenca Denver-Julesburg (DJB), que se superpone con la mayoría de las áreas metropolitanas de Colorado. El ozono se crea naturalmente en la estratosfera de la Tierra, pero también se crea en la troposfera a partir de los esfuerzos humanos. Brevemente mencionado anteriormente, el NOx y los COV reaccionan con la luz solar para crear ozono a través de un proceso llamado fotoquímica. Los eventos de ozono elevado de una hora (<75 ppb) "ocurren entre junio y agosto, lo que indica que los niveles elevados de ozono son impulsados por la fotoquímica regional". Según un artículo de la Universidad de Colorado-Boulder, "las emisiones de COV del petróleo y el gas natural tienen un papel importante en la producción de ozono y tienen el potencial de contribuir a niveles elevados de O 3niveles elevados de O 3 en la Cordillera Frontal del Norte de Colorado (NCFR)". Usando análisis complejos para investigar patrones de viento y emisiones de grandes operaciones de petróleo y gas natural, los autores concluyeron que "los niveles elevados de O 3 en el NCFR están predominantemente correlacionados con el transporte aéreo desde N– ESE, que son los sectores upwind donde se ubican las operaciones de O&NG en el área Wattenberg Field del DJB”.
Contenido en el Plan de acción de ozono de Colorado, creado en 2008, existen planes para evaluar "controles de emisión para grandes fuentes industriales de NOx" y "requisitos de control estatales para nuevos tanques de condensado de petróleo y gas y válvulas neumáticas". En 2011, se publicó el Plan Regional Haze que incluía un plan más específico para ayudar a disminuir las emisiones de NOx. Estos esfuerzos son cada vez más difíciles de implementar y tardan muchos años en materializarse. Por supuesto, también hay otras razones por las que los niveles de ozono siguen siendo altos. Estos incluyen: una población en crecimiento que significa más emisiones de automóviles y las montañas a lo largo del NCFR que pueden atrapar emisiones. Si está interesado, puede encontrar lecturas diarias de la calidad del aire en el sitio web del Departamento de Salud Pública y Medio Ambiente de Colorado.Como se señaló anteriormente, Denver continúa experimentando altos niveles de ozono hasta el día de hoy. Se necesitarán muchos años y un enfoque de pensamiento sistémico para combatir este problema de los altos niveles de ozono en Front Range de Colorado.
Craqueo de ozono
El gas ozono ataca cualquier polímero que posea enlaces olefínicos o dobles dentro de su estructura de cadena, como el caucho natural, el caucho de nitrilo y el caucho de estireno-butadieno. Los productos fabricados con estos polímeros son especialmente susceptibles al ataque, lo que hace que las grietas crezcan más largas y más profundas con el tiempo; la tasa de crecimiento de las grietas depende de la carga transportada por el componente de caucho y la concentración de ozono en la atmósfera. Dichos materiales se pueden proteger agregando antiozonizantes, como ceras, que se adhieren a la superficie para crear una película protectora o se mezclan con el material y brindan protección a largo plazo. El agrietamiento por ozono solía ser un problema grave en los neumáticos de los automóviles,por ejemplo, pero no es un problema con los neumáticos modernos. Por otro lado, muchos productos críticos, como juntas y juntas tóricas, pueden ser atacados por el ozono producido dentro de los sistemas de aire comprimido. Las tuberías de combustible hechas de caucho reforzado también son susceptibles de sufrir ataques, especialmente dentro del compartimiento del motor, donde los componentes eléctricos producen algo de ozono. El almacenamiento de productos de caucho cerca de un motor eléctrico de CC puede acelerar el agrietamiento por ozono. El conmutador del motor genera chispas que a su vez producen ozono.
El ozono como gas de efecto invernadero
Aunque el ozono estaba presente a nivel del suelo antes de la Revolución Industrial, las concentraciones máximas ahora son mucho más altas que los niveles preindustriales, e incluso las concentraciones de fondo lejos de las fuentes de contaminación son sustancialmente más altas. El ozono actúa como un gas de efecto invernadero, absorbiendo parte de la energía infrarroja emitida por la tierra. Cuantificar la potencia del ozono como gas de efecto invernadero es difícil porque no está presente en concentraciones uniformes en todo el mundo. Sin embargo, las evaluaciones científicas más ampliamente aceptadas relacionadas con el cambio climático (por ejemplo, el Tercer Informe de Evaluación del Panel Intergubernamental sobre el Cambio Climático) sugieren que el forzamiento radiativo del ozono troposférico es aproximadamente un 25% del del dióxido de carbono.
El potencial de calentamiento global anual del ozono troposférico está entre 918 y 1022 toneladas equivalentes de dióxido de carbono/toneladas de ozono troposférico. Esto significa que, por molécula, el ozono en la troposfera tiene un efecto de forzamiento radiativo aproximadamente 1000 veces más fuerte que el dióxido de carbono. Sin embargo, el ozono troposférico es un gas de efecto invernadero de vida corta, que se descompone en la atmósfera mucho más rápido que el dióxido de carbono. Esto significa que, en un lapso de 20 años, el potencial de calentamiento global del ozono troposférico es mucho menor, aproximadamente de 62 a 69 toneladas equivalentes de dióxido de carbono/tonelada de ozono troposférico.
Debido a su naturaleza de vida corta, el ozono troposférico no tiene efectos globales fuertes, pero tiene efectos de forzamiento radiativo muy fuertes a escala regional. De hecho, hay regiones del mundo donde el ozono troposférico tiene un forzamiento radiativo de hasta el 150% del dióxido de carbono.
Efectos en la salud
Durante las últimas décadas, los científicos estudiaron los efectos de la exposición aguda y crónica al ozono en la salud humana. Cientos de estudios sugieren que el ozono es dañino para las personas en los niveles que actualmente se encuentran en las áreas urbanas. Se ha demostrado que el ozono afecta el sistema nervioso central, cardiovascular y respiratorio. También se ha demostrado que la muerte prematura y los problemas en la salud reproductiva y el desarrollo están asociados con la exposición al ozono.
Poblaciones vulnerables
La American Lung Association ha identificado cinco poblaciones que son especialmente vulnerables a los efectos de respirar ozono:
- Niños y adolescentes
- Personas de 65 años en adelante
- Personas que trabajan o hacen ejercicio al aire libre.
- Personas con enfermedades pulmonares existentes, como asma y enfermedad pulmonar obstructiva crónica (también conocida como EPOC, que incluye enfisema y bronquitis crónica)
- Personas con enfermedades cardiovasculares
Evidencia adicional sugiere que las mujeres, las personas con obesidad y las poblaciones de bajos ingresos también pueden enfrentar un mayor riesgo por el ozono, aunque se necesita más investigación.
Exposición aguda al ozono
La exposición aguda al ozono varía de horas a unos pocos días. Debido a que el ozono es un gas, afecta directamente los pulmones y todo el sistema respiratorio. El ozono inhalado causa inflamación y cambios agudos, pero reversibles, en la función pulmonar, así como hiperreactividad de las vías respiratorias. Estos cambios provocan dificultad para respirar, sibilancias y tos que pueden exacerbar las enfermedades pulmonares, como el asma o la enfermedad pulmonar obstructiva crónica (EPOC), lo que provoca la necesidad de recibir tratamiento médico. Se ha demostrado que la exposición aguda y crónica al ozono causa un mayor riesgo de infecciones respiratorias, debido al siguiente mecanismo.
Se han realizado múltiples estudios para determinar el mecanismo detrás de los efectos dañinos del ozono, particularmente en los pulmones. Estos estudios han demostrado que la exposición al ozono provoca cambios en la respuesta inmunitaria dentro del tejido pulmonar, lo que provoca la interrupción de la respuesta inmunitaria tanto innata como adaptativa, así como la alteración de la función protectora de las células epiteliales pulmonares. Se cree que estos cambios en la respuesta inmunitaria y la respuesta inflamatoria relacionada son factores que probablemente contribuyan al aumento del riesgo de infecciones pulmonares y al empeoramiento o desencadenamiento del asma y vías respiratorias reactivas después de la exposición a la contaminación por ozono troposférico.
El sistema inmunitario innato (celular) consta de varias señales químicas y tipos de células que funcionan ampliamente y contra múltiples tipos de patógenos, generalmente bacterias o cuerpos/sustancias extraños en el huésped. Las células del sistema innato incluyen fagocitos, neutrófilos, y se cree que ambos contribuyen al mecanismo de la patología del ozono en los pulmones, ya que se ha demostrado que el funcionamiento de estos tipos de células cambia después de la exposición al ozono. Se ha demostrado que los macrófagos, células que tienen el propósito de eliminar patógenos o material extraño a través del proceso de "fagocitosis", cambian el nivel de señales inflamatorias que liberan en respuesta al ozono, ya sea regulando al alza y dando como resultado una respuesta inflamatoria en el pulmón, o regular a la baja y reducir la protección inmunológica.Los neutrófilos, otro tipo de célula importante del sistema inmunitario innato que se dirige principalmente a los patógenos bacterianos, están presentes en las vías respiratorias dentro de las 6 horas posteriores a la exposición a niveles altos de ozono. Sin embargo, a pesar de los altos niveles en los tejidos pulmonares, su capacidad para eliminar las bacterias parece verse afectada por la exposición al ozono.
El sistema inmunitario adaptativo es la rama de la inmunidad que brinda protección a largo plazo a través del desarrollo de anticuerpos dirigidos a patógenos específicos y también se ve afectado por la alta exposición al ozono. Los linfocitos, un componente celular de la respuesta inmunitaria adaptativa, producen una mayor cantidad de sustancias químicas inflamatorias llamadas "citoquinas" después de la exposición al ozono, lo que puede contribuir a la hiperreactividad de las vías respiratorias y al empeoramiento de los síntomas del asma.
Las células epiteliales de las vías respiratorias también juegan un papel importante en la protección de las personas contra los patógenos. En el tejido normal, la capa epitelial forma una barrera protectora y también contiene estructuras ciliares especializadas que funcionan para eliminar los cuerpos extraños, la mucosidad y los patógenos de los pulmones. Cuando se exponen al ozono, los cilios se dañan y se reduce la eliminación mucociliar de patógenos. Además, la barrera epitelial se debilita, lo que permite que los patógenos atraviesen la barrera, proliferen y se extiendan a tejidos más profundos. Juntos, estos cambios en la barrera epitelial ayudan a que las personas sean más susceptibles a las infecciones pulmonares.
La inhalación de ozono no solo afecta el sistema inmunológico y los pulmones, sino que también puede afectar el corazón. El ozono provoca un desequilibrio autonómico a corto plazo que provoca cambios en la frecuencia cardíaca y una reducción de la variabilidad de la frecuencia cardíaca; y la exposición a altos niveles durante tan solo una hora da como resultado una arritmia supraventricular en los ancianos, ambos aumentan el riesgo de muerte prematura y accidente cerebrovascular. El ozono también puede conducir a la vasoconstricción que resulta en un aumento de la presión arterial sistémica que contribuye a un mayor riesgo de morbilidad y mortalidad cardíaca en pacientes con enfermedades cardíacas preexistentes.
Exposición crónica al ozono
Respirar ozono por períodos de más de ocho horas seguidas durante semanas, meses o años define la exposición crónica. Numerosos estudios sugieren un grave impacto en la salud de varias poblaciones a partir de esta exposición.
Un estudio encuentra asociaciones positivas significativas entre el ozono crónico y la mortalidad por todas las causas, circulatoria y respiratoria con aumentos del 2 %, 3 % y 12 % en el riesgo por cada 10 ppb e informa una asociación (IC del 95 %) del ozono anual y todos los niveles de mortalidad. causan mortalidad con un cociente de riesgos instantáneos de 1,02 (1,01-1,04), y con una mortalidad cardiovascular de 1,03 (1,01-1,05). Un estudio similar encuentra asociaciones similares con la mortalidad por todas las causas e incluso efectos mayores para la mortalidad cardiovascular. Un mayor riesgo de mortalidad por causas respiratorias está asociado con la exposición crónica a largo plazo al ozono.
El ozono crónico tiene efectos perjudiciales en los niños, especialmente en aquellos con asma. El riesgo de hospitalización en niños con asma aumenta con la exposición crónica al ozono; los niños más pequeños y aquellos con bajos ingresos corren un riesgo aún mayor.
Los adultos que padecen enfermedades respiratorias (asma, EPOC, cáncer de pulmón) tienen un mayor riesgo de mortalidad y morbilidad y los pacientes en estado crítico también tienen un mayor riesgo de desarrollar síndrome de dificultad respiratoria aguda con exposición crónica al ozono.
Ozono producido por filtros de aire
Los generadores de ozono que se venden como purificadores de aire producen intencionalmente el gas ozono. Estos a menudo se comercializan para controlar la contaminación del aire interior y utilizan términos engañosos para describir el ozono. Algunos ejemplos lo describen como "oxígeno energizado" o "aire puro", lo que sugiere que el ozono es un tipo de oxígeno saludable o "mejor". Sin embargo, según la EPA, " el ozono no es eficaz para eliminar muchos productos químicos que causan olores " y " no elimina eficazmente virus, bacterias, moho u otros contaminantes biológicos ". Además, otro informe afirma que "
La Junta de Recursos del Aire de California tiene una página que enumera los filtros de aire (muchos con ionizadores) que alcanzan su límite de ozono interior de 0,050 partes por millón. De ese artículo:
| Todos los dispositivos portátiles de limpieza de aire interior vendidos en California deben estar certificados por la Junta de Recursos del Aire de California (CARB). Para obtener la certificación, los purificadores de aire deben someterse a pruebas de seguridad eléctrica y emisiones de ozono, y cumplir con un límite de concentración de emisión de ozono de 0,050 partes por millón. Para obtener más información sobre la regulación, visite la regulación del filtro de aire. |
Contaminación del aire por ozono
Los precursores de ozono son un grupo de contaminantes, predominantemente los emitidos durante la combustión de combustibles fósiles. La contaminación por ozono a nivel del suelo (ozono troposférico) se crea cerca de la superficie de la Tierra por la acción de los rayos ultravioleta de la luz del día sobre estos precursores. El ozono a nivel del suelo proviene principalmente de precursores de combustibles fósiles, pero el metano es un precursor natural, y el muy bajo nivel de fondo natural de ozono a nivel del suelo se considera seguro. Esta sección examina los impactos en la salud de la quema de combustibles fósiles, que eleva el nivel de ozono a nivel del suelo muy por encima de los niveles de fondo.
Existe una gran cantidad de evidencia que muestra que el ozono troposférico puede dañar la función pulmonar e irritar el sistema respiratorio. La exposición al ozono (ya los contaminantes que lo producen) está relacionada con muerte prematura, asma, bronquitis, infarto de miocardio y otros problemas cardiopulmonares.
Se ha demostrado que la exposición a largo plazo al ozono aumenta el riesgo de muerte por enfermedades respiratorias. Un estudio de 450 000 personas que viven en ciudades de los Estados Unidos observó una correlación significativa entre los niveles de ozono y las enfermedades respiratorias durante el período de seguimiento de 18 años. El estudio reveló que las personas que vivían en ciudades con altos niveles de ozono, como Houston o Los Ángeles, tenían un riesgo 30 % mayor de morir a causa de una enfermedad pulmonar.
Las pautas de calidad del aire como las de la Organización Mundial de la Salud, la Agencia de Protección Ambiental de los Estados Unidos (EPA) y la Unión Europea se basan en estudios detallados diseñados para identificar los niveles que pueden causar efectos nocivos para la salud medibles.
Según los científicos de la EPA de EE. UU., las personas susceptibles pueden verse afectadas negativamente por niveles de ozono tan bajos como 40 nmol/mol. En la UE, el valor objetivo actual para las concentraciones de ozono es de 120 µg/m3, que es de unos 60 nmol/mol. Este objetivo se aplica a todos los estados miembros de acuerdo con la Directiva 2008/50/EC. La concentración de ozono se mide como una media diaria máxima de promedios de 8 horas y el objetivo no debe excederse en más de 25 días calendario por año, a partir de enero de 2010. Si bien la directiva exige en el futuro un estricto cumplimiento del límite de 120 µg/m (es decir, la concentración media de ozono que no debe superarse en ningún día del año), no se ha fijado una fecha para este requisito y se trata como un objetivo a largo plazo.
En los EE. UU., la Ley de Aire Limpio ordena a la EPA que establezca Estándares Nacionales de Calidad del Aire Ambiental para varios contaminantes, incluido el ozono a nivel del suelo, y los condados que no cumplan con estos estándares deben tomar medidas para reducir sus niveles. En mayo de 2008, por orden judicial, la EPA redujo su estándar de ozono de 80 nmol/mol a 75 nmol/mol. La medida resultó controvertida, ya que los propios científicos y el consejo asesor de la Agencia habían recomendado reducir el estándar a 60 nmol/mol. Muchos grupos ambientales y de salud pública también apoyaron el estándar de 60 nmol/mol, y la Organización Mundial de la Salud recomienda 100 µg/m (51 nmol/mol).
El 7 de enero de 2010, la Agencia de Protección Ambiental de EE. UU. (EPA) anunció revisiones propuestas al Estándar Nacional de Calidad del Aire Ambiental (NAAQS) para el contaminante ozono, el componente principal del smog:
... La EPA propone que el nivel del estándar primario de 8 horas, que se fijó en 0,075 μmol/mol en la regla final de 2008, debería establecerse en cambio en un nivel más bajo dentro del rango de 0,060 a 0,070 μmol/mol, para proporcionar una mayor protección para los niños y otras poblaciones en riesgo contra una variedad de O3– efectos adversos para la salud relacionados que van desde la disminución de la función pulmonar y el aumento de los síntomas respiratorios hasta indicadores graves de morbilidad respiratoria, incluidas las visitas al servicio de urgencias y los ingresos hospitalarios por causas respiratorias, y posiblemente la morbilidad relacionada con enfermedades cardiovasculares, así como la mortalidad total no accidental y cardiopulmonar..
El 26 de octubre de 2015, la EPA publicó una regla final con fecha de vigencia del 28 de diciembre de 2015 que revisó el NAAQS primario de 8 horas de 0,075 ppm a 0,070 ppm.
La EPA ha desarrollado un índice de calidad del aire (AQI) para ayudar a explicar los niveles de contaminación del aire al público en general. Según los estándares actuales, las fracciones molares de ozono promedio de ocho horas de 85 a 104 nmol/mol se describen como "poco saludables para los grupos sensibles", 105 nmol/mol a 124 nmol/mol como "poco saludables" y 125 nmol/mol a 404 nmol/mol como "muy poco saludable".
El ozono también puede estar presente en la contaminación del aire interior, en parte como resultado de equipos electrónicos como las fotocopiadoras. También se sabe que existe una conexión entre el aumento de polen, las esporas de hongos y el ozono causado por las tormentas eléctricas y los ingresos hospitalarios de los enfermos de asma.
En la era victoriana, un mito popular británico sostenía que el olor del mar era causado por el ozono. De hecho, el característico "olor a mar" es causado por el sulfuro de dimetilo, una sustancia química generada por el fitoplancton. Los británicos victorianos consideraron que el olor resultante era "vigorizante".
Olas de calor
Una investigación para evaluar los efectos conjuntos del ozono y el calor en la mortalidad durante las olas de calor europeas en 2003 concluyó que estos parecen ser aditivos.
Fisiología
El ozono, junto con las formas reactivas de oxígeno como el superóxido, el oxígeno singlete, el peróxido de hidrógeno y los iones de hipoclorito, es producido por los glóbulos blancos y otros sistemas biológicos (como las raíces de las caléndulas) como medio para destruir cuerpos extraños. El ozono reacciona directamente con los dobles enlaces orgánicos. Además, cuando el ozono se descompone en dioxígeno, da lugar a radicales libres de oxígeno, que son altamente reactivos y capaces de dañar muchas moléculas orgánicas. Además, se cree que las poderosas propiedades oxidantes del ozono pueden ser un factor que contribuye a la inflamación. La relación de causa y efecto de cómo se crea el ozono en el cuerpo y lo que hace todavía está bajo consideración y aún está sujeta a varias interpretaciones, ya que otros procesos químicos del cuerpo pueden desencadenar algunas de las mismas reacciones. Hay pruebas que relacionan la vía de oxidación del agua catalizada por anticuerpos de la respuesta inmunitaria humana con la producción de ozono. En este sistema, el ozono se produce mediante la producción catalizada por anticuerpos de trioxidano a partir de agua y oxígeno singulete producido por neutrófilos.
Cuando se inhala, el ozono reacciona con los compuestos que recubren los pulmones para formar metabolitos específicos derivados del colesterol que se cree que facilitan la acumulación y la patogénesis de las placas ateroscleróticas (una forma de enfermedad cardíaca). Se ha confirmado que estos metabolitos ocurren naturalmente en las arterias ateroscleróticas humanas y se clasifican en una clase de secosteroles denominados ateronales, generados por ozonólisis del doble enlace del colesterol para formar un 5,6 secosterol, así como un producto de condensación secundaria a través de la aldolización.
Impacto en el crecimiento de las plantas y el rendimiento de los cultivos
Se ha implicado que el ozono tiene un efecto adverso en el crecimiento de las plantas: "... el ozono redujo la concentración total de clorofilas, carotenoides y carbohidratos, y aumentó el contenido de ácido 1-aminociclopropano-1-carboxílico (ACC) y la producción de etileno. En las plantas tratadas, el La reserva de hojas de ascorbato disminuyó, mientras que la peroxidación de lípidos y la fuga de solutos fueron significativamente más altas que en los controles sin ozono. Los datos indicaron que el ozono desencadenó mecanismos protectores contra el estrés oxidativo en los cítricos". Los estudios que han utilizado plantas de pimiento como modelo han demostrado que el ozono disminuyó el rendimiento de la fruta y cambió la calidad de la fruta. Además, también se observó una disminución en los niveles de clorofilas y defensas antioxidantes en las hojas, así como un aumento en los niveles de especies reactivas de oxígeno (ROS) y daños en lípidos y proteínas.
Un estudio de 2022 concluye que Asia oriental pierde 63 000 millones de dólares en cultivos al año debido a la contaminación por ozono, un subproducto de la quema de combustibles fósiles. China pierde alrededor de un tercio de su producción potencial de trigo y un cuarto de su producción de arroz.
Regulaciones de seguridad
Debido a las propiedades fuertemente oxidantes del ozono, el ozono es un irritante primario que afecta especialmente a los ojos y al sistema respiratorio y puede ser peligroso incluso en concentraciones bajas. El Centro Canadiense para la Seguridad y Salud en el Trabajo informa que:
Incluso concentraciones muy bajas de ozono pueden ser dañinas para el tracto respiratorio superior y los pulmones. La gravedad de la lesión depende tanto de la concentración de ozono como de la duración de la exposición. Una lesión pulmonar grave y permanente o la muerte podría resultar incluso de una exposición a muy corto plazo a concentraciones relativamente bajas".
Para proteger a los trabajadores potencialmente expuestos al ozono, la Administración de Salud y Seguridad Ocupacional de EE. UU. ha establecido un límite de exposición permisible (PEL) de 0,1 μmol/mol (29 CFR 1910.1000 tabla Z-1), calculado como un promedio ponderado de tiempo de 8 horas. Las concentraciones más altas son especialmente peligrosas y NIOSH ha establecido un límite de peligro inmediato para la vida y la salud (IDLH) de 5 μmol/mol. Los ambientes de trabajo donde se usa ozono o donde es probable que se produzca deben tener una ventilación adecuada y es prudente tener un monitor de ozono que emita una alarma si la concentración excede el PEL de OSHA. Los monitores continuos de ozono están disponibles de varios proveedores.
La exposición elevada al ozono puede ocurrir en aviones de pasajeros, con niveles que dependen de la altitud y la turbulencia atmosférica. Las regulaciones de la Administración Federal de Aviación de los Estados Unidos establecen un límite de 250 nmol/mol con un promedio máximo de cuatro horas de 100 nmol/mol. Algunos aviones están equipados con convertidores de ozono en el sistema de ventilación para reducir la exposición de los pasajeros.
Producción
Los generadores de ozono, u ozonizadores, se utilizan para producir ozono para limpiar el aire o eliminar los olores de humo en habitaciones desocupadas. Estos generadores de ozono pueden producir más de 3 g de ozono por hora. El ozono a menudo se forma en la naturaleza en condiciones en las que el O 2 no reacciona. El ozono utilizado en la industria se mide en μmol/mol (ppm, partes por millón), nmol/mol (ppb, partes por billón), μg/m, mg/h (miligramos por hora) o porcentaje en peso. El régimen de concentraciones aplicadas oscila entre el 1 % y el 5 % (en aire) y entre el 6 % y el 14 % (en oxígeno) para los métodos de generación más antigua. Los nuevos métodos electrolíticos pueden lograr concentraciones de ozono disuelto del 20 % al 30 % en el agua de salida.
La temperatura y la humedad juegan un papel importante en la cantidad de ozono que se produce utilizando los métodos de generación tradicionales (como la descarga de corona y la luz ultravioleta). Los métodos de generación anterior producirán menos del 50 % de la capacidad nominal si funcionan con aire ambiental húmedo, a diferencia del aire muy seco. Los nuevos generadores, que utilizan métodos electrolíticos, pueden lograr una mayor pureza y disolución mediante el uso de moléculas de agua como fuente de producción de ozono.
Método de descarga coronal
Este es el tipo más común de generador de ozono para la mayoría de los usos industriales y personales. Si bien existen variaciones del método de producción de ozono de descarga coronal de "chispa caliente", incluidos los generadores de ozono de grado médico e industrial, estas unidades generalmente funcionan por medio de un tubo de descarga de corona o una placa de ozono.Por lo general, son rentables y no requieren una fuente de oxígeno que no sea el aire ambiente para producir concentraciones de ozono de 3 a 6 %. Las fluctuaciones en el aire ambiental, debido al clima u otras condiciones ambientales, causan variabilidad en la producción de ozono. Sin embargo, también producen óxidos de nitrógeno como subproducto. El uso de un secador de aire puede reducir o eliminar la formación de ácido nítrico al eliminar el vapor de agua y aumentar la producción de ozono. A temperatura ambiente, el ácido nítrico formará un vapor que es peligroso si se inhala. Los síntomas pueden incluir dolor en el pecho, dificultad para respirar, dolores de cabeza y sequedad en la nariz y la garganta que causan una sensación de ardor. El uso de un concentrador de oxígeno puede aumentar aún más la producción de ozono y reducir aún más el riesgo de formación de ácido nítrico al eliminar no solo el vapor de agua, sino también la mayor parte del nitrógeno.
Luz ultravioleta
Los generadores de ozono UV, o generadores de ozono ultravioleta al vacío (VUV), emplean una fuente de luz que genera una luz ultravioleta de banda estrecha, un subconjunto de la producida por el sol. Los rayos ultravioleta del Sol sostienen la capa de ozono en la estratosfera de la Tierra.
Los generadores de ozono UV utilizan aire ambiental para la producción de ozono, no se utilizan sistemas de preparación de aire (secador de aire o concentrador de oxígeno), por lo que estos generadores tienden a ser menos costosos. Sin embargo, los generadores de ozono UV normalmente producen ozono con una concentración de alrededor del 0,5 % o menos, lo que limita la tasa potencial de producción de ozono. Otra desventaja de este método es que requiere que el aire ambiental (oxígeno) esté expuesto a la fuente de UV durante un período de tiempo más largo, y cualquier gas que no esté expuesto a la fuente de UV no será tratado. Esto hace que los generadores UV no sean prácticos para su uso en situaciones en las que se manejan corrientes de aire o agua que se mueven rápidamente (esterilización de aire en conductos, por ejemplo). La producción de ozono es uno de los peligros potenciales de la irradiación germicida ultravioleta. Los generadores de ozono VUV se utilizan en piscinas y aplicaciones de spa que alcanzan millones de galones de agua. Los generadores de ozono VUV, a diferencia de los generadores de descarga de corona, no producen subproductos de nitrógeno nocivos y, a diferencia de los sistemas de descarga de corona, los generadores de ozono VUV funcionan muy bien en entornos de aire húmedo. Normalmente tampoco hay necesidad de costosos mecanismos de escape de gases, ni de secadores de aire o concentradores de oxígeno que requieran costes y mantenimiento adicionales.
Plasma frio
En el método de plasma frío, el gas de oxígeno puro se expone a un plasma creado por DBD. El oxígeno diatómico se divide en átomos individuales, que luego se recombinan en tripletes para formar ozono. Es común en la industria etiquetar erróneamente algunos generadores de ozono DBD como generadores de descarga CD Corona. Por lo general, todos los generadores de ozono de electrodos de metal plano sólido producen ozono utilizando el método de descarga de barrera dieléctrica. Las máquinas de plasma frío utilizan oxígeno puro como fuente de entrada y producen una concentración máxima de alrededor del 24 % de ozono. Producen cantidades mucho mayores de ozono en un tiempo determinado en comparación con la producción ultravioleta que tiene una eficiencia de alrededor del 2%. Las descargas se manifiestan como transferencia filamentaria de electrones (microdescargas) en un espacio entre dos electrodos. Para distribuir uniformemente las microdescargas,
Electrolítico
La generación de ozono electrolítico (EOG) divide las moléculas de agua en H 2, O 2 y O 3. En la mayoría de los métodos EOG, el hidrógeno gaseoso se eliminará para dejar oxígeno y ozono como los únicos productos de reacción. Por lo tanto, EOG puede lograr una mayor disolución en agua sin otros gases competidores que se encuentran en el método de descarga de corona, como los gases de nitrógeno presentes en el aire ambiente. Este método de generación puede alcanzar concentraciones de 20 a 30 % y es independiente de la calidad del aire porque se usa agua como material de origen. La producción de ozono electrolíticamente suele ser desfavorable debido al alto sobrepotencial requerido para producir ozono en comparación con el oxígeno. Esta es la razón por la que no se produce ozono durante la electrólisis típica del agua. Sin embargo, es posible aumentar el sobrepotencial del oxígeno mediante una selección cuidadosa del catalizador, de modo que el ozono se produzca preferentemente bajo electrólisis.
La proporción de ozono a oxígeno se mejora aumentando la densidad de corriente en el ánodo, enfriando el electrolito alrededor del ánodo cerca de 0 °C, usando un electrolito ácido (como ácido sulfúrico diluido) en lugar de una solución básica y aplicando corriente pulsada en su lugar. de CC.
Consideraciones Especiales
El ozono no puede almacenarse ni transportarse como otros gases industriales (porque se descompone rápidamente en oxígeno diatómico) y, por lo tanto, debe producirse in situ. Los generadores de ozono disponibles varían en la disposición y el diseño de los electrodos de alto voltaje. Con capacidades de producción superiores a 20 kg por hora, se puede utilizar un intercambiador de calor de tubos de gas/agua como electrodo de tierra y ensamblarse con electrodos tubulares de alto voltaje en el lado del gas. El régimen de presiones típicas de los gases es de alrededor de 2 bares (200 kPa) absolutos en oxígeno y 3 bares (300 kPa) absolutos en aire. Se pueden instalar varios megavatios de energía eléctrica en grandes instalaciones, aplicados como corriente alterna monofásica de 50 a 8000 Hz y voltajes máximos entre 3000 y 20 000 voltios. El voltaje aplicado generalmente está inversamente relacionado con la frecuencia aplicada.
El parámetro dominante que influye en la eficiencia de generación de ozono es la temperatura del gas, que se controla mediante la temperatura del agua de refrigeración y/o la velocidad del gas. Cuanto más fría esté el agua, mejor será la síntesis de ozono. Cuanto menor sea la velocidad del gas, mayor será la concentración (pero menor será el ozono neto producido). En condiciones industriales típicas, casi el 90 % de la potencia efectiva se disipa en forma de calor y debe eliminarse mediante un flujo suficiente de agua de refrigeración.
Debido a la alta reactividad del ozono, solo se pueden usar algunos materiales como acero inoxidable (calidad 316L), titanio, aluminio (siempre que no haya humedad), vidrio, politetrafluoretileno o fluoruro de polivinilideno. Viton se puede usar con la restricción de fuerzas mecánicas constantes y ausencia de humedad (se aplican limitaciones de humedad según la formulación). Hypalon se puede utilizar con la restricción de que el agua no entre en contacto con él, excepto en los niveles atmosféricos normales. La fragilización o contracción es el modo común de falla de los elastómeros con la exposición al ozono. El agrietamiento por ozono es el modo común de falla de los sellos de elastómero como las juntas tóricas.
Los cauchos de silicona suelen ser adecuados para su uso como juntas en concentraciones de ozono por debajo del 1% en peso, como en equipos para el envejecimiento acelerado de muestras de caucho.
Producción incidental
El ozono se puede formar a partir de O2por descargas eléctricas y por acción de radiaciones electromagnéticas de alta energía. El arco no suprimido en contactos eléctricos, escobillas de motor o interruptores mecánicos rompe los enlaces químicos del oxígeno atmosférico que rodea los contactos [ O2→ 2O]. Los radicales libres de oxígeno dentro y alrededor del arco se recombinan para crear ozono [ O3]. Ciertos equipos eléctricos generan niveles significativos de ozono. Esto es especialmente cierto en el caso de los dispositivos que utilizan altos voltajes, como los purificadores de aire iónicos, las impresoras láser, las fotocopiadoras, las pistolas Taser y las soldadoras de arco. Los motores eléctricos que utilizan escobillas pueden generar ozono a partir de chispas repetidas dentro de la unidad. Los motores grandes que usan escobillas, como los que usan los ascensores o las bombas hidráulicas, generarán más ozono que los motores más pequeños.
El ozono se forma de manera similar en el fenómeno de las tormentas eléctricas Catatumbo en el río Catatumbo en Venezuela, aunque la inestabilidad del ozono hace que sea dudoso que tenga algún efecto sobre la ozonosfera. Es el generador natural de ozono más grande del mundo, lo que exige que sea designado Patrimonio de la Humanidad por la UNESCO.
Producción de laboratorio
En el laboratorio, el ozono se puede producir por electrólisis usando una batería de 9 voltios, un cátodo de barra de grafito de lápiz, un ánodo de alambre de platino y un electrolito de ácido sulfúrico 3 molar. Las reacciones de semicelda que tienen lugar son:3 H 2 O → O 3 + 6 H + 6 e (Δ E ° = −1,53 V)6 H + 6 e → 3 H 2 (Δ E ° = 0 V)2 H 2 O → O 2 + 4 H + 4 e (Δ E ° = 1,23 V)
En la reacción neta, tres equivalentes de agua se convierten en un equivalente de ozono y tres equivalentes de hidrógeno. La formación de oxígeno es una reacción competitiva.
También puede ser generado por un arco de alto voltaje. En su forma más simple, la CA de alto voltaje, como la salida de un transformador de letrero de neón, se conecta a dos varillas de metal con los extremos colocados lo suficientemente cerca uno del otro para permitir un arco. El arco resultante convertirá el oxígeno atmosférico en ozono.
A menudo es deseable contener el ozono. Esto se puede hacer con un aparato que consta de dos tubos de vidrio concéntricos sellados en la parte superior con puertos de gas en la parte superior e inferior del tubo exterior. El núcleo interno debe tener un trozo de lámina metálica insertada en él conectado a un lado de la fuente de alimentación. El otro lado de la fuente de alimentación debe conectarse a otra pieza de papel de aluminio envuelta alrededor del tubo exterior. Una fuente de O seco2se aplica al puerto inferior. Cuando se aplica alto voltaje a los cables de lámina, la electricidad se descargará entre el dioxígeno seco en el medio y forma O3y O2que saldrá por el puerto superior. Esto se llama ozonizador de Siemens. La reacción se puede resumir de la siguiente manera: 
Aplicaciones
Industria
El mayor uso del ozono es en la preparación de productos farmacéuticos, lubricantes sintéticos y muchos otros compuestos orgánicos comercialmente útiles, donde se usa para romper los enlaces carbono-carbono. También se puede usar para blanquear sustancias y para matar microorganismos en fuentes de aire y agua. Muchos sistemas municipales de agua potable matan las bacterias con ozono en lugar del cloro más común. El ozono tiene un potencial de oxidación muy alto.El ozono no forma compuestos organoclorados, ni permanece en el agua después del tratamiento. El ozono puede formar el presunto cancerígeno bromato en fuentes de agua con altas concentraciones de bromuro. La Ley de Agua Potable Segura de EE. UU. exige que estos sistemas introduzcan una cantidad de cloro para mantener un mínimo de 0,2 μmol/mol de cloro libre residual en las tuberías, según los resultados de las pruebas periódicas. Donde la energía eléctrica es abundante, el ozono es un método rentable para tratar el agua, ya que se produce según la demanda y no requiere transporte ni almacenamiento de productos químicos peligrosos. Una vez que se ha descompuesto, no deja sabor ni olor en el agua potable.
Aunque se ha anunciado que los niveles bajos de ozono tienen algún uso desinfectante en viviendas residenciales, la concentración de ozono en el aire seco requerida para tener un efecto rápido y sustancial sobre los patógenos transportados por el aire supera los niveles seguros recomendados por la Administración de Seguridad y Salud Ocupacional de EE. Agencia de Protección. El control de la humedad puede mejorar enormemente tanto el poder letal del ozono como la velocidad a la que se descompone en oxígeno (más humedad permite una mayor eficacia). Las formas de esporas de la mayoría de los patógenos son muy tolerantes al ozono atmosférico en concentraciones en las que los pacientes con asma comienzan a tener problemas.
En 1908 se introdujo la ozonización artificial de la Línea Central del Metro de Londres como desinfectante aéreo. Se descubrió que el proceso valía la pena, pero se eliminó gradualmente en 1956. Sin embargo, el efecto beneficioso se mantuvo gracias al ozono creado incidentalmente a partir de las descargas eléctricas de los motores del tren (ver arriba: Producción incidental).
Los generadores de ozono se pusieron a disposición de las escuelas y universidades de Gales durante el período de otoño de 2021, para desinfectar las aulas después de los brotes de COVID-19.
Industrialmente, el ozono se utiliza para:
- Desinfectar la ropa en hospitales, fábricas de alimentos, residencias de ancianos, etc.;
- Desinfectar el agua en lugar de cloro
- Desodoriza el aire y los objetos, como después de un incendio. Este proceso se utiliza ampliamente en la restauración de tejidos.
- Mata las bacterias en los alimentos o en las superficies de contacto;
- Las industrias que consumen mucha agua, como las cervecerías y las plantas lácteas, pueden hacer un uso efectivo del ozono disuelto como reemplazo de los desinfectantes químicos como el ácido peracético, el hipoclorito o el calor.
- Desinfecte las torres de refrigeración y controle la legionela con un consumo reducido de productos químicos, purga de agua y un mayor rendimiento.
- Desinfectar piscinas y spas
- Matar insectos en granos almacenados
- Limpiar las esporas de levadura y moho del aire en las plantas de procesamiento de alimentos;
- Lave las frutas y verduras frescas para eliminar la levadura, el moho y las bacterias;
- Atacan químicamente los contaminantes en el agua (hierro, arsénico, sulfuro de hidrógeno, nitritos y compuestos orgánicos complejos agrupados como "color");
- Proporcionar una ayuda para la floculación (aglomeración de moléculas, que ayuda en la filtración, donde se eliminan el hierro y el arsénico);
- Fabricar compuestos químicos mediante síntesis química.
- Limpiar y blanquear telas (el primer uso se utiliza en la restauración de telas; el segundo uso está patentado);
- Actuar como anticloro en el blanqueo a base de cloro;
- Asistir en el procesamiento de plásticos para permitir la adhesión de tintas;
- Envejecer muestras de caucho para determinar la vida útil de un lote de caucho;
- Erradicar parásitos transmitidos por el agua como Giardia lamblia y Cryptosporidium en plantas de tratamiento de aguas superficiales.
El ozono es un reactivo en muchas reacciones orgánicas en el laboratorio y en la industria. La ozonolisis es la ruptura de un alqueno en compuestos carbonílicos.
Muchos hospitales de todo el mundo utilizan grandes generadores de ozono para descontaminar los quirófanos entre cirugías. Las habitaciones se limpian y luego se sellan herméticamente antes de llenarlas con ozono, que mata o neutraliza de manera efectiva todas las bacterias restantes.
El ozono se utiliza como alternativa al cloro o al dióxido de cloro en el blanqueo de la pulpa de madera. A menudo se usa junto con oxígeno y peróxido de hidrógeno para eliminar la necesidad de compuestos que contienen cloro en la fabricación de papel blanco de alta calidad.
El ozono se puede usar para desintoxicar los desechos de cianuro (por ejemplo, de la minería de oro y plata) al oxidar el cianuro a cianato y, finalmente, a dióxido de carbono.
Desinfección de agua
Desde la invención de los reactores de plasma de descarga de barrera dieléctrica (DBD), se ha empleado para el tratamiento de agua con ozono. Sin embargo, con desinfectantes alternativos más baratos como el cloro, tales aplicaciones de descontaminación de agua con ozono DBD se han visto limitadas por el alto consumo de energía y los equipos voluminosos. A pesar de esto, con investigaciones que revelan los impactos negativos de los desinfectantes comunes como el cloro con respecto a los residuos tóxicos y la ineficacia para matar ciertos microorganismos,La descontaminación con ozono basada en plasma DBD es de interés en las tecnologías disponibles actualmente. Aunque la ozonización del agua con una alta concentración de bromuro conduce a la formación de subproductos de desinfección bromados indeseables, a menos que el agua potable se produzca mediante desalinización, la ozonización generalmente se puede aplicar sin preocuparse por estos subproductos. Las ventajas del ozono incluyen un alto potencial de oxidación termodinámica, menor sensibilidad a la materia orgánica y mejor tolerancia a las variaciones de pH, al tiempo que conserva la capacidad de matar bacterias, hongos, virus, así como esporas y quistes. Aunque el ozono ha sido ampliamente aceptado en Europa durante décadas, se usa con moderación para la descontaminación en los EE. UU. debido a las limitaciones del alto consumo de energía, la instalación voluminosa y el estigma asociado con la toxicidad del ozono.Teniendo esto en cuenta, los esfuerzos de investigación recientes se han dirigido hacia el estudio de sistemas efectivos de tratamiento de agua con ozono. Los investigadores han investigado reactores DBD de superficie de baja potencia ligeros y compactos, reactores DBD de volumen eficientes energéticamente y reactores DBD de microescala de baja potencia. Dichos estudios pueden ayudar a allanar el camino para volver a aceptar la descontaminación del agua con ozono basada en plasma DBD, especialmente en los EE. UU.
Consumidores
Los dispositivos que generan altos niveles de ozono, algunos de los cuales utilizan ionización, se utilizan para desinfectar y desodorizar edificios, habitaciones, conductos, leñeras, barcos y otros vehículos deshabitados.
El agua ozonizada se utiliza para lavar la ropa y desinfectar los alimentos, el agua potable y las superficies del hogar. Según la Administración de Drogas y Alimentos de EE. UU. (FDA), está "modificando las regulaciones de aditivos alimentarios para proporcionar el uso seguro de ozono en fases gaseosas y acuosas como agente antimicrobiano en alimentos, incluidas carnes y aves". Los estudios de la Universidad Politécnica de California demostraron que los niveles de 0,3 μmol/mol de ozono disuelto en agua del grifo filtrada pueden producir una reducción de más del 99,99 % en microorganismos transmitidos por los alimentos como la salmonella, E. coli 0157:H7 y Campylobacter. Esta cantidad es 20.000 veces los límites recomendados por la OMS indicados anteriormente. El ozono se puede utilizar para eliminar residuos de pesticidas de frutas y verduras.
El ozono se usa en casas y jacuzzis para matar bacterias en el agua y para reducir la cantidad de cloro o bromo requerida al reactivarlos a su estado libre. Dado que el ozono no permanece en el agua el tiempo suficiente, el ozono por sí solo no es efectivo para prevenir la contaminación cruzada entre los bañistas y debe usarse junto con halógenos. El ozono gaseoso creado por luz ultravioleta o por descarga de corona se inyecta en el agua.
El ozono también se usa ampliamente en el tratamiento del agua en acuarios y estanques de peces. Su uso puede minimizar el crecimiento bacteriano, controlar los parásitos, eliminar la transmisión de algunas enfermedades y reducir o eliminar el "amarilleo" del agua. El ozono no debe entrar en contacto con las estructuras branquiales de los peces. El agua salada natural (con formas de vida) proporciona suficiente "demanda instantánea" para que cantidades controladas de ozono activen los iones de bromuro en ácido hipobromoso, y el ozono se descomponga por completo en unos pocos segundos o minutos. Si se utiliza ozono alimentado con oxígeno, el agua tendrá más oxígeno disuelto y las estructuras branquiales de los peces se atrofiarán, haciéndolos dependientes del agua enriquecida con oxígeno.
Acuicultura
La ozonización, un proceso de infusión de agua con ozono, se puede utilizar en la acuicultura para facilitar la descomposición orgánica. El ozono también se agrega a los sistemas de recirculación para reducir los niveles de nitrito a través de la conversión en nitrato. Si los niveles de nitrito en el agua son altos, los nitritos también se acumularán en la sangre y los tejidos de los peces, donde interfieren con el transporte de oxígeno (causan la oxidación del grupo hemo de la hemoglobina ferrosa (Fe) a férrico (Fe), lo que hace que la hemoglobina no pueda unirse al O2). A pesar de estos aparentes efectos positivos, el uso de ozono en los sistemas de recirculación se ha relacionado con la reducción del nivel de yodo biodisponible en los sistemas de agua salada, lo que provoca síntomas de deficiencia de yodo, como bocio y disminución del crecimiento de las larvas del lenguado senegalés (Solea senegalensis).
El agua de mar con ozono se utiliza para la desinfección de la superficie de los huevos de eglefino y halibut del Atlántico contra el nodavirus. El nodavirus es un virus letal y de transmisión vertical que provoca una grave mortalidad en los peces. Los huevos de eglefino no deben tratarse con un nivel alto de ozono, ya que los huevos así tratados no eclosionan y mueren después de 3 o 4 días.
Agricultura
La aplicación de ozono en piñas y plátanos recién cortados muestra un aumento en los contenidos de flavonoides y fenoles totales cuando la exposición es de hasta 20 minutos. Se observa una disminución en el contenido de ácido ascórbico (una forma de vitamina C), pero el efecto positivo sobre el contenido total de fenoles y flavonoides puede superar el efecto negativo. Los tomates tras el tratamiento con ozono muestran un aumento de β-caroteno, luteína y licopeno. Sin embargo, la aplicación de ozono en fresas en el período previo a la cosecha muestra una disminución en el contenido de ácido ascórbico.
El ozono facilita la extracción de algunos metales pesados del suelo utilizando EDTA. El EDTA forma fuertes compuestos de coordinación solubles en agua con algunos metales pesados (Pb, Zn), lo que permite disolverlos del suelo contaminado. Si el suelo contaminado se trata previamente con ozono, la eficacia de extracción de Pb, Am y Pu aumenta en un 11,0–28,9 %, 43,5 % y 50,7 % respectivamente.
Medicina alternativa
El uso de ozono para el tratamiento de condiciones médicas no está respaldado por evidencia de alta calidad y generalmente se considera medicina alternativa.
Contenido relacionado
Teoría atómica
Agroquímico
Butilhidroxianisol
![{displaystyle K_{1}={K_{1} sobre K_{-1}}={[O_{2}]cdot [O] sobre [O_{3}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/790e2ee894cf7ce231dd072be28e6e51e8340ac6)
![{displaystyle [O]={K_{1}cdot [O_{3}] over K_{-1}cdot [O_{2}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e2379ad127a03a4bf3ca94183a20b5fa3fc00e11)
![{displaystyle V={2K_{2}cdot K_{1}cdot [O_{3}]^{2} over K_{-1}cdot [O_{2}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d1395af6c802f7969c8c5d37d0a2a5cc4b9cd371)
![{displaystyle V={K_{obs}cdot [O_{3}]^{2} over [O_{2}]}=K_{obs}cdot [O_{3}]^{2}cdot [O_{2}]^{-1}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/66b7f62c5f8599754ba525ce4adf754150878cf8)
