Mioglobina
La mioglobina es una proteína fijadora de hierro y oxígeno que se encuentra en el tejido muscular cardíaco y esquelético de los vertebrados en general y en casi todos los mamíferos. La mioglobina está lejanamente relacionada con la hemoglobina. En comparación con la hemoglobina, la mioglobina tiene una mayor afinidad por el oxígeno y no tiene una unión cooperativa con el oxígeno como lo hace la hemoglobina. En los humanos, la mioglobina solo se encuentra en el torrente sanguíneo después de una lesión muscular.
Las altas concentraciones de mioglobina en las células musculares permiten que los organismos contengan la respiración durante un período de tiempo más largo. Los mamíferos buceadores, como las ballenas y las focas, tienen músculos con una abundancia particularmente alta de mioglobina. La mioglobina se encuentra en el músculo tipo I, tipo II A y tipo II B, pero la mayoría de los textos consideran que la mioglobina no se encuentra en el músculo liso.
La mioglobina fue la primera proteína en tener su estructura tridimensional revelada por cristalografía de rayos X. Este logro fue informado en 1958 por John Kendrew y asociados. Por este descubrimiento, Kendrew compartió el Premio Nobel de Química de 1962 con Max Perutz. A pesar de ser una de las proteínas más estudiadas en biología, su función fisiológica aún no está establecida de manera concluyente: los ratones modificados genéticamente para que carezcan de mioglobina pueden ser viables y fértiles, pero muestran muchas adaptaciones celulares y fisiológicas para superar la pérdida. A través de la observación de estos cambios en ratones con depleción de mioglobina, se plantea la hipótesis de que la función de la mioglobina se relaciona con un mayor transporte de oxígeno al músculo y con el almacenamiento de oxígeno; además, sirve como un eliminador de especies reactivas de oxígeno.
En humanos, la mioglobina está codificada por el gen MB.
La mioglobina puede tomar las formas de oximioglobina (MbO 2), carboximioglobina (MbCO) y metamioglobina (met-Mb), de manera análoga a la hemoglobina que toma las formas oxihemoglobina (HbO 2), carboxihemoglobina (HbCO) y metahemoglobina (met-Hb).
Diferencias de la hemoglobina
Al igual que la hemoglobina, la mioglobina es una proteína citoplasmática que se une al oxígeno en un grupo hemo. Alberga solo un grupo de globulina, mientras que la hemoglobina tiene cuatro. Aunque su grupo hemo es idéntico al de la Hb, la Mb tiene una mayor afinidad por el oxígeno que la hemoglobina. Esta diferencia está relacionada con su función diferente: mientras que la hemoglobina transporta oxígeno, la función de la mioglobina es almacenar oxígeno.
Papel en la cocina
La mioglobina contiene hemos, pigmentos responsables del color de la carne roja. El color que toma la carne está determinado en parte por el grado de oxidación de la mioglobina. En la carne fresca el átomo de hierro se encuentra en estado de oxidación ferroso (+2) unido a una molécula de oxígeno (O 2). La carne bien cocida es de color marrón porque el átomo de hierro se encuentra ahora en estado de oxidación férrico (+3), habiendo perdido un electrón. Si la carne ha estado expuesta a nitritos, permanecerá rosada porque el átomo de hierro está unido a NO, óxido nítrico (como ocurre, por ejemplo, con la carne en conserva o los jamones curados). Las carnes a la parrilla también pueden adquirir un "anillo de humo" de color rosa rojizo que proviene del centro del hemo que se une al monóxido de carbono.La carne cruda envasada en una atmósfera de monóxido de carbono también muestra este mismo "anillo de humo" rosa debido a los mismos principios. En particular, la superficie de esta carne cruda también muestra el color rosa, que generalmente se asocia en la mente de los consumidores con la carne fresca. Este color rosa inducido artificialmente puede persistir, según se informa, hasta un año. Se informa que Hormel y Cargill (compañías de procesamiento de carne en los EE. UU.) usan este proceso de empaque de carne, y la carne tratada de esta manera ha estado en el mercado de consumo desde 2003.
Papel en la enfermedad
La mioglobina se libera del tejido muscular dañado (rabdomiolisis), que tiene concentraciones muy altas de mioglobina. La mioglobina liberada es filtrada por los riñones, pero es tóxica para el epitelio tubular renal y, por lo tanto, puede causar lesión renal aguda. No es la mioglobina en sí misma la que es tóxica (es una protoxina), sino la porción de ferrihemato que se disocia de la mioglobina en ambientes ácidos (p. ej., orina ácida, lisosomas).
La mioglobina es un marcador sensible de lesión muscular, lo que la convierte en un marcador potencial de ataque cardíaco en pacientes con dolor torácico. Sin embargo, la mioglobina elevada tiene poca especificidad para el infarto agudo de miocardio (IAM) y, por lo tanto, se deben tener en cuenta la CK-MB, la troponina cardíaca, el ECG y los signos clínicos para hacer el diagnóstico.
Estructura y unión
La mioglobina pertenece a la superfamilia de proteínas de las globinas y, al igual que otras globinas, consta de ocho hélices alfa conectadas por bucles. La mioglobina contiene 153 aminoácidos.
La mioglobina contiene un anillo de porfirina con un hierro en su centro. Un grupo de histidina proximal (His-93) está unido directamente al hierro y un grupo de histidina distal (His-64) flota cerca de la cara opuesta. El imidazol distal no está unido al hierro pero está disponible para interactuar con el sustrato O 2. Esta interacción favorece la unión del O 2, pero no del monóxido de carbono (CO), que todavía se une unas 240 veces más fuerte que el O 2.
La unión de O 2 provoca un cambio estructural sustancial en el centro de Fe, que se contrae en radio y se mueve hacia el centro de la bolsa de N4. La unión de O2 induce el "emparejamiento de espín": la forma desoxirroja ferrosa de cinco coordenadas es de alto espín y la forma oxi de seis coordenadas es de bajo espín y diamagnética.
 Descripción orbital molecular de la interacción Fe-O 2 en la mioglobina.
Descripción orbital molecular de la interacción Fe-O 2 en la mioglobina.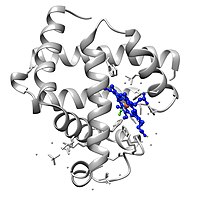 Esta es una imagen de una molécula de mioglobina oxigenada. La imagen muestra el cambio estructural cuando el oxígeno se une al átomo de hierro del grupo prostético hemo. Los átomos de oxígeno están coloreados en verde, el átomo de hierro está coloreado en rojo y el grupo hemo está coloreado en azul.
Esta es una imagen de una molécula de mioglobina oxigenada. La imagen muestra el cambio estructural cuando el oxígeno se une al átomo de hierro del grupo prostético hemo. Los átomos de oxígeno están coloreados en verde, el átomo de hierro está coloreado en rojo y el grupo hemo está coloreado en azul.
Análogos sintéticos
Se han sintetizado muchos modelos de mioglobina como parte de un amplio interés en los complejos de dioxígeno de metales de transición. Un ejemplo bien conocido es la porfirina de valla de piquete, que consiste en un complejo ferroso de un derivado estéricamente voluminoso de tetrafenilporfirina. En presencia de un ligando imidazol, este complejo ferroso se une reversiblemente al O 2. El sustrato de O 2 adopta una geometría doblada, ocupando la sexta posición del centro de hierro. Una propiedad clave de este modelo es la formación lenta del dímero μ-oxo, que es un estado diférrico inactivo. En la naturaleza, tales vías de desactivación son suprimidas por la matriz proteica que impide el acercamiento cercano de los ensamblajes de Fe-porfirina.
 Un complejo de porfirina de valla de piquete de Fe, con sitios de coordinación axial ocupados por metilimidazol (verde) y dioxígeno. Los grupos R flanquean el sitio de unión de O
Un complejo de porfirina de valla de piquete de Fe, con sitios de coordinación axial ocupados por metilimidazol (verde) y dioxígeno. Los grupos R flanquean el sitio de unión de O
2.
Contenido relacionado
Migración genética
Gimnospermas
Celacanto