Líquido

Un líquido es un fluído casi incompresible que se adapta a la forma de su recipiente pero retiene un volumen (casi) constante independientemente de la presión. Como tal, es uno de los cuatro estados fundamentales de la materia (los otros son sólido, gas y plasma), y es el único estado con un volumen definido pero sin forma fija. Un líquido está formado por diminutas partículas vibrantes de materia, como átomos, unidas por enlaces intermoleculares. Al igual que un gas, un líquido puede fluir y tomar la forma de un recipiente. La mayoría de los líquidos resisten la compresión, aunque otros pueden comprimirse. A diferencia de un gas, un líquido no se dispersa para llenar todos los espacios de un recipiente y mantiene una densidad bastante constante. Una propiedad distintiva del estado líquido es la tensión superficial, que conduce a fenómenos de humectación. El agua es, con mucho, el líquido más común en la Tierra.
La densidad de un líquido suele ser cercana a la de un sólido y mucho mayor que la de un gas. Por lo tanto, tanto el líquido como el sólido se denominan materia condensada. Por otro lado, como los líquidos y los gases comparten la capacidad de fluir, ambos se denominan fluidos. Aunque el agua líquida es abundante en la Tierra, este estado de la materia es en realidad el menos común en el universo conocido, porque los líquidos requieren un rango de temperatura/presión relativamente estrecho para existir. La mayor parte de la materia conocida en el universo está en forma gaseosa (con rastros de materia sólida detectable) como nubes interestelares o en plasma desde el interior de las estrellas.
Introducción
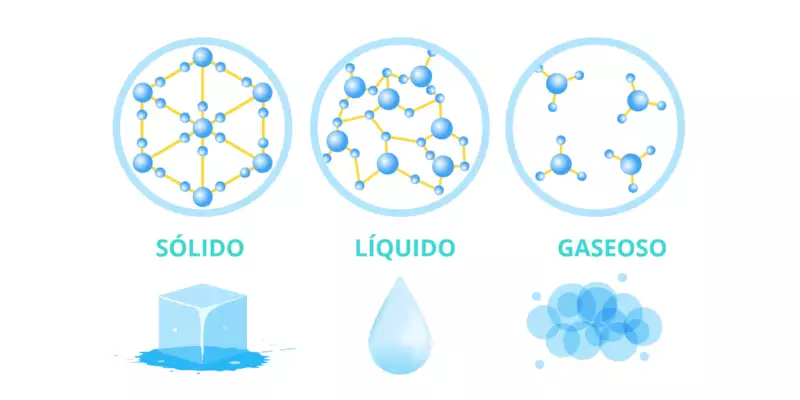
El líquido es uno de los cuatro estados primarios de la materia, siendo los otros sólido, gas y plasma. Un líquido es un fluido. A diferencia de un sólido, las moléculas de un líquido tienen una libertad de movimiento mucho mayor. Las fuerzas que unen las moléculas en un sólido son solo temporales en un líquido, lo que permite que un líquido fluya mientras que un sólido permanece rígido.
Un líquido, como un gas, muestra las propiedades de un fluido. Un líquido puede fluir, adoptar la forma de un recipiente y, si se coloca en un recipiente sellado, distribuirá la presión aplicada de manera uniforme a todas las superficies del recipiente. Si el líquido se coloca en una bolsa, se puede exprimir en cualquier forma. A diferencia de un gas, un líquido es casi incompresible, lo que significa que ocupa un volumen casi constante en una amplia gama de presiones; por lo general, no se expande para llenar el espacio disponible en un recipiente, sino que forma su propia superficie y es posible que no siempre se mezcle fácilmente con otro líquido. Estas propiedades hacen que un líquido sea adecuado para aplicaciones como la hidráulica.
Las partículas líquidas están unidas firmemente pero no rígidamente. Pueden moverse entre sí libremente, lo que da como resultado un grado limitado de movilidad de partículas. A medida que aumenta la temperatura, el aumento de las vibraciones de las moléculas hace que aumenten las distancias entre las moléculas. Cuando un líquido alcanza su punto de ebullición, las fuerzas cohesivas que unen las moléculas muy juntas se rompen y el líquido cambia a su estado gaseoso (a menos que ocurra un sobrecalentamiento). Si la temperatura disminuye, las distancias entre las moléculas se hacen más pequeñas. Cuando el líquido alcanza su punto de congelación, las moléculas generalmente se fijan en un orden muy específico, llamado cristalización, y los enlaces entre ellas se vuelven más rígidos, cambiando el líquido a su estado sólido (a menos que ocurra un sobreenfriamiento).
Ejemplos
Solo dos elementos son líquidos en condiciones estándar de temperatura y presión: el mercurio y el bromo. Cuatro elementos más tienen puntos de fusión ligeramente por encima de la temperatura ambiente: francio, cesio, galio y rubidio. Las aleaciones metálicas que son líquidas a temperatura ambiente incluyen NaK, una aleación metálica de sodio y potasio, galinstan, una aleación líquida fusible y algunas amalgamas (aleaciones que contienen mercurio).
Las sustancias puras que son líquidas en condiciones normales incluyen agua, etanol y muchos otros solventes orgánicos. El agua líquida es de vital importancia en química y biología; se cree que es una necesidad para la existencia de la vida.
Los líquidos inorgánicos incluyen agua, magma, solventes inorgánicos no acuosos y muchos ácidos.
Los líquidos cotidianos importantes incluyen soluciones acuosas como lejía doméstica, otras mezclas de diferentes sustancias como aceite mineral y gasolina, emulsiones como vinagreta o mayonesa, suspensiones como sangre y coloides como pintura y leche.
Muchos gases pueden licuarse por enfriamiento, produciendo líquidos como oxígeno líquido, nitrógeno líquido, hidrógeno líquido y helio líquido. Sin embargo, no todos los gases pueden licuarse a presión atmosférica. El dióxido de carbono, por ejemplo, solo se puede licuar a presiones superiores a 5,1 atm.
Algunos materiales no pueden clasificarse dentro de los tres estados clásicos de la materia. Por ejemplo, los cristales líquidos (utilizados en pantallas de cristal líquido) poseen propiedades tanto sólidas como líquidas, y pertenecen a su propio estado de la materia distinto de líquido o sólido.
Aplicaciones
Los líquidos tienen una variedad de usos, como lubricantes, solventes y refrigerantes.
En tribología, los líquidos se estudian por sus propiedades como lubricantes. Los lubricantes como el aceite se eligen por sus características de viscosidad y flujo que son adecuadas en todo el rango de temperatura de funcionamiento del componente. Los aceites se utilizan a menudo en motores, cajas de engranajes, metalurgia y sistemas hidráulicos por sus buenas propiedades de lubricación.
Muchos líquidos se utilizan como disolventes, para disolver otros líquidos o sólidos. Las soluciones se encuentran en una amplia variedad de aplicaciones, incluidas pinturas, selladores y adhesivos. La nafta y la acetona se utilizan con frecuencia en la industria para limpiar aceite, grasa y alquitrán de piezas y maquinaria. Los fluidos corporales son soluciones a base de agua.
Los surfactantes se encuentran comúnmente en jabones y detergentes. Los solventes como el alcohol se usan a menudo como antimicrobianos. Se encuentran en cosméticos, tintas y láseres de colorante líquido. Se utilizan en la industria alimentaria, en procesos como la extracción de aceite vegetal.
Los líquidos tienden a tener una mejor conductividad térmica que los gases, y la capacidad de fluir hace que un líquido sea adecuado para eliminar el exceso de calor de los componentes mecánicos. El calor se puede eliminar canalizando el líquido a través de un intercambiador de calor, como un radiador, o se puede eliminar con el líquido durante la evaporación. Los refrigerantes de agua o glicol se utilizan para evitar que los motores se sobrecalienten. Los refrigerantes utilizados en los reactores nucleares incluyen agua o metales líquidos, como sodio o bismuto. Las películas de propelente líquido se utilizan para enfriar las cámaras de empuje de los cohetes.En el mecanizado, se utilizan agua y aceites para eliminar el exceso de calor generado, que puede arruinar rápidamente tanto la pieza de trabajo como el utillaje. Durante la transpiración, el sudor elimina el calor del cuerpo humano al evaporarse. En la industria de calefacción, ventilación y aire acondicionado (HVAC), se utilizan líquidos como el agua para transferir calor de un área a otra.
De manera similar, los líquidos se usan a menudo para cocinar por sus mejores propiedades de transferencia de calor. Además de una mejor conductividad, debido a que los fluidos más cálidos se expanden y ascienden mientras que las áreas más frías se contraen y se hunden, los líquidos con baja viscosidad cinemática tienden a transferir calor por convección a una temperatura bastante constante, lo que los convierte en líquidos adecuados para escaldar, hervir o freír. Incluso se pueden lograr tasas más altas de transferencia de calor al condensar un gas en un líquido. En el punto de ebullición del líquido, toda la energía térmica se utiliza para provocar el cambio de fase de líquido a gas, sin un aumento de temperatura que lo acompañe, y se almacena como energía potencial química. Cuando el gas se condensa de nuevo en líquido, este exceso de energía térmica se libera a una temperatura constante. Este fenómeno se utiliza en procesos como la cocción al vapor. Dado que los líquidos a menudo tienen diferentes puntos de ebullición, las mezclas o soluciones de líquidos o gases normalmente se pueden separar por destilación, utilizando calor, frío, vacío, presión u otros medios. La destilación se puede encontrar en todo, desde la producción de bebidas alcohólicas hasta las refinerías de petróleo y la destilación criogénica de gases como argón, oxígeno, nitrógeno, neón o xenón por licuefacción (enfriándolos por debajo de sus puntos de ebullición individuales).
El líquido es el componente principal de los sistemas hidráulicos, que aprovechan la ley de Pascal para proporcionar energía fluida. Dispositivos como bombas y ruedas hidráulicas se han utilizado para cambiar el movimiento líquido en trabajo mecánico desde la antigüedad. Los aceites son forzados a través de bombas hidráulicas, que transmiten esta fuerza a los cilindros hidráulicos. La hidráulica se puede encontrar en muchas aplicaciones, como frenos y transmisiones de automóviles, equipos pesados y sistemas de control de aviones. Varias prensas hidráulicas se utilizan ampliamente en reparación y fabricación, para levantar, prensar, sujetar y formar.
Los líquidos se utilizan a veces en dispositivos de medición. Un termómetro a menudo usa la expansión térmica de líquidos, como el mercurio, combinada con su capacidad de fluir para indicar la temperatura. Un manómetro usa el peso del líquido para indicar la presión del aire.
Propiedades mecánicas
Volumen
Las cantidades de líquidos se miden en unidades de volumen. Estos incluyen la unidad SI metro cúbico (m ) y sus divisiones, en particular el decímetro cúbico, más comúnmente llamado litro (1 dm = 1 L = 0.001 m ), y el centímetro cúbico, también llamado mililitro (1 cm = 1 mL = 0,001 L = 10 m ).
El volumen de una cantidad de líquido está fijado por su temperatura y presión. Los líquidos generalmente se expanden cuando se calientan y se contraen cuando se enfrían. El agua entre 0 °C y 4 °C es una notable excepción.
Por otro lado, los líquidos tienen poca compresibilidad. El agua, por ejemplo, se comprimirá solo 46,4 partes por millón por cada unidad de aumento en la presión atmosférica (bar). A alrededor de 4000 bar (400 megapascales o 58 000 psi) de presión a temperatura ambiente, el agua experimenta solo una disminución del 11 % en volumen. La incompresibilidad hace que los líquidos sean aptos para transmitir potencia hidráulica, porque un cambio de presión en un punto de un líquido se transmite sin disminución a cualquier otra parte del líquido y se pierde muy poca energía en forma de compresión.
Sin embargo, la compresibilidad insignificante conduce a otros fenómenos. El golpeteo de las tuberías, llamado golpe de ariete, ocurre cuando una válvula se cierra repentinamente, creando un enorme pico de presión en la válvula que viaja hacia atrás a través del sistema justo por debajo de la velocidad del sonido. Otro fenómeno causado por la incompresibilidad del líquido es la cavitación. Debido a que los líquidos tienen poca elasticidad, literalmente pueden separarse en áreas de alta turbulencia o cambios dramáticos en la dirección, como el borde de salida de la hélice de un bote o una esquina afilada en una tubería. Un líquido en un área de baja presión (vacío) se vaporiza y forma burbujas, que luego colapsan al entrar en áreas de alta presión. Esto hace que el líquido llene las cavidades dejadas por las burbujas con una tremenda fuerza localizada, erosionando cualquier superficie sólida adyacente.
Presión y flotabilidad
En un campo gravitatorio, los líquidos ejercen presión sobre los lados de un recipiente, así como sobre cualquier cosa dentro del propio líquido. Esta presión se transmite en todas las direcciones y aumenta con la profundidad. Si un líquido está en reposo en un campo gravitatorio uniforme, la presión 





Para un cuerpo de agua abierto al aire, 
Los líquidos estáticos en campos gravitatorios uniformes también exhiben el fenómeno de flotabilidad, donde los objetos sumergidos en el líquido experimentan una fuerza neta debido a la variación de presión con la profundidad. La magnitud de la fuerza es igual al peso del líquido desplazado por el objeto, y la dirección de la fuerza depende de la densidad promedio del objeto sumergido. Si la densidad es menor que la del líquido, la fuerza de flotación apunta hacia arriba y el objeto flota, mientras que si la densidad es mayor , la fuerza de flotación apunta hacia abajo y el objeto se hunde. Esto se conoce como el principio de Arquímedes.
Superficies
A menos que el volumen de un líquido coincida exactamente con el volumen de su recipiente, se observan una o más superficies. La presencia de una superficie introduce nuevos fenómenos que no están presentes en un líquido a granel. Esto se debe a que una molécula en una superficie posee enlaces con otras moléculas líquidas solo en el lado interno de la superficie, lo que implica una fuerza neta que tira de las moléculas de la superficie hacia adentro. De manera equivalente, esta fuerza se puede describir en términos de energía: hay una cantidad fija de energía asociada con la formación de una superficie de un área determinada. Esta cantidad es una propiedad material llamada tensión superficial, en unidades de energía por unidad de área (unidades SI: J/m). Los líquidos con fuertes fuerzas intermoleculares tienden a tener grandes tensiones superficiales.
Una implicación práctica de la tensión superficial es que los líquidos tienden a minimizar su área superficial, formando gotas esféricas y burbujas a menos que existan otras limitaciones. La tensión superficial también es responsable de una variedad de otros fenómenos, incluidas las ondas superficiales, la acción capilar, la humectación y las ondas. En los líquidos bajo confinamiento a nanoescala, los efectos superficiales pueden desempeñar un papel dominante ya que, en comparación con una muestra macroscópica de líquido, una fracción mucho mayor de moléculas se encuentra cerca de una superficie.
La tensión superficial de un líquido afecta directamente su humectabilidad. Los líquidos más comunes tienen tensiones que varían en decenas de mJ/m , por lo que las gotas de aceite, agua o pegamento pueden fusionarse fácilmente y adherirse a otras superficies, mientras que los metales líquidos como el mercurio pueden tener tensiones que varían en cientos de mJ/m . por lo tanto, las gotas no se combinan fácilmente y las superficies solo pueden mojarse bajo condiciones específicas.
Las tensiones superficiales de los líquidos comunes ocupan un rango de valores relativamente estrecho, lo que contrasta fuertemente con la enorme variación observada en otras propiedades mecánicas, como la viscosidad.
Fluir
Una propiedad física importante que caracteriza el flujo de líquidos es la viscosidad. Intuitivamente, la viscosidad describe la resistencia de un líquido a fluir.
Más técnicamente, la viscosidad mide la resistencia de un líquido a la deformación a una velocidad determinada, como cuando se corta a una velocidad finita. Un ejemplo específico es un líquido que fluye a través de una tubería: en este caso, el líquido sufre deformación por cortante ya que fluye más lentamente cerca de las paredes de la tubería que cerca del centro. Como resultado, exhibe una resistencia viscosa al flujo. Para mantener el flujo, se debe aplicar una fuerza externa, como una diferencia de presión entre los extremos de la tubería.
La viscosidad de los líquidos disminuye al aumentar la temperatura.
El control preciso de la viscosidad es importante en muchas aplicaciones, particularmente en la industria de la lubricación. Una forma de lograr dicho control es mezclando dos o más líquidos de diferentes viscosidades en proporciones precisas. Además, existen varios aditivos que pueden modular la dependencia de la temperatura de la viscosidad de los aceites lubricantes. Esta capacidad es importante ya que la maquinaria a menudo opera en un rango de temperaturas (ver también índice de viscosidad).
El comportamiento viscoso de un líquido puede ser newtoniano o no newtoniano. Un líquido newtoniano exhibe una curva lineal de deformación/esfuerzo, lo que significa que su viscosidad es independiente del tiempo, la velocidad de corte o la historia de la velocidad de corte. Los ejemplos de líquidos newtonianos incluyen agua, glicerina, aceite de motor, miel o mercurio. Un líquido no newtoniano es aquel en el que la viscosidad no es independiente de estos factores y se espesa (aumenta la viscosidad) o se diluye (disminuye la viscosidad) bajo cizallamiento. Los ejemplos de líquidos no newtonianos incluyen ketchup, mayonesa, geles para el cabello, Play-Doh o soluciones de almidón.
Elasticidad bajo confinamiento
Los líquidos confinados pueden exhibir diferentes propiedades mecánicas en comparación con los líquidos a granel. Por ejemplo, los líquidos bajo confinamiento submilimétrico (p. ej., en el espacio entre paredes rígidas) muestran una respuesta mecánica similar a la de un sólido y poseen un módulo de cizallamiento elástico de baja frecuencia sorprendentemente grande, que escala con la potencia cúbica inversa de la longitud de confinamiento.
Propagación del sonido
La velocidad del sonido en un líquido está dada por 


Termodinámica
Transiciones de fase
A una temperatura por debajo del punto de ebullición, cualquier materia en forma líquida se evaporará hasta alcanzar el equilibrio con el proceso inverso de condensación de su vapor. En este punto, el vapor se condensará a la misma velocidad que se evapora el líquido. Por lo tanto, un líquido no puede existir permanentemente si el líquido evaporado se elimina continuamente. Un líquido en su punto de ebullición o por encima de él normalmente hervirá, aunque el sobrecalentamiento puede evitarlo en determinadas circunstancias.
A una temperatura por debajo del punto de congelación, un líquido tenderá a cristalizar, cambiando a su forma sólida. A diferencia de la transición a gas, no hay equilibrio en esta transición bajo presión constante, por lo que, a menos que ocurra un sobreenfriamiento, el líquido eventualmente cristalizará por completo. Sin embargo, esto solo es cierto bajo presión constante, por lo que (por ejemplo) el agua y el hielo en un recipiente cerrado y resistente pueden alcanzar un equilibrio en el que coexistan ambas fases. Para la transición opuesta de sólido a líquido, vea fusión.
Líquidos en el espacio
El diagrama de fase explica por qué los líquidos no existen en el espacio ni en ningún otro vacío. Dado que la presión es cero (excepto en superficies o interiores de planetas y lunas), el agua y otros líquidos expuestos al espacio hervirán o se congelarán inmediatamente según la temperatura. En regiones del espacio cercanas a la tierra, el agua se congelará si el sol no brilla directamente sobre ella y se vaporizará (sublime) tan pronto como esté expuesta a la luz del sol. Si el agua existe como hielo en la luna, solo puede existir en agujeros sombreados donde el sol nunca brilla y donde la roca circundante no la calienta demasiado. En algún punto cerca de la órbita de Saturno, la luz del sol es demasiado débil para sublimar el hielo en vapor de agua. Esto es evidente por la longevidad del hielo que compone los anillos de Saturno.
Soluciones
Los líquidos pueden formar soluciones con gases, sólidos y otros líquidos.
Se dice que dos líquidos son miscibles si pueden formar una solución en cualquier proporción; de lo contrario, son inmiscibles. Por ejemplo, el agua y el etanol (alcohol para beber) son miscibles mientras que el agua y la gasolina son inmiscibles. En algunos casos, una mezcla de líquidos que de otro modo serían inmiscibles se puede estabilizar para formar una emulsión, donde un líquido se dispersa en el otro como gotas microscópicas. Por lo general, esto requiere la presencia de un tensioactivo para estabilizar las gotas. Un ejemplo familiar de una emulsión es la mayonesa, que consiste en una mezcla de agua y aceite que se estabiliza con lecitina, una sustancia que se encuentra en las yemas de huevo.
Descripción microscópica
Las moléculas que componen los líquidos están desordenadas y interactúan fuertemente, lo que hace que los líquidos sean difíciles de describir rigurosamente a nivel molecular. Esto contrasta con las otras dos fases comunes de la materia, gases y sólidos. Aunque los gases están desordenados, están lo suficientemente diluidos como para ignorar las interacciones de muchos cuerpos y, en cambio, las interacciones moleculares se pueden modelar en términos de eventos de colisión binaria bien definidos. Por el contrario, aunque los sólidos son densos y interactúan fuertemente, su estructura regular a nivel molecular (por ejemplo, una red cristalina) permite simplificaciones teóricas significativas. Por estas razones, la teoría microscópica de los líquidos está menos desarrollada que la de los gases y los sólidos.
Factor de estructura estática
En un líquido, los átomos no forman una red cristalina, ni muestran ninguna otra forma de orden de largo alcance. Esto se evidencia por la ausencia de picos de Bragg en la difracción de rayos X y de neutrones. En condiciones normales, el patrón de difracción tiene simetría circular, expresando la isotropía del líquido. En dirección radial, la intensidad de difracción oscila suavemente. Esto generalmente se describe mediante el factor de estructura estática S(q) , con el número de onda q =(4π/λ)sen θ dado por la longitud de onda λ de la sonda (fotón o neutrón) y el ángulo de Bragg θ. Las oscilaciones de S(q) expresan el orden cercano del líquido, es decir, las correlaciones entre un átomo y unas pocas capas de los vecinos más cercanos, segundos más cercanos....
La función de distribución radial g(r) , que es básicamente la transformada de Fourier de S(q) , proporciona una descripción más intuitiva de estas correlaciones . Representa un promedio espacial de una instantánea temporal de correlaciones de pares en el líquido.
Dispersión del sonido y relajación estructural
La expresión anterior para la velocidad del sonido 


En frecuencias inferiores a GHz, un líquido normal no puede soportar ondas de corte: el límite de frecuencia cero del módulo de corte es 


Según la relación de Kramers-Kronig, la dispersión en la velocidad del sonido (dada por la parte real de K o G ) va acompañada de un máximo en la atenuación del sonido (disipación, dada por la parte imaginaria de K o G ). Según la teoría de la respuesta lineal, la transformada de Fourier de K o G describe cómo el sistema vuelve al equilibrio después de una perturbación externa; por esta razón, el paso de dispersión en la región de GHz..THz también se denomina relajación estructural. De acuerdo con el teorema de fluctuación-disipación, la relajación hacia el equilibrio está íntimamente relacionada con las fluctuaciones enequilibrio. Las fluctuaciones de densidad asociadas con las ondas de sonido se pueden observar experimentalmente mediante la dispersión de Brillouin.
Al sobreenfriar un líquido hacia la transición vítrea, el cruce de la respuesta de líquido a sólido se mueve de GHz a MHz, kHz, Hz, ...; de manera equivalente, el tiempo característico de relajación estructural aumenta de ns a µs, ms, s, ... Esta es la explicación microscópica del comportamiento viscoelástico mencionado anteriormente de los líquidos formadores de vidrio.
Efectos de la asociación
Los mecanismos de difusión atómica/molecular (o desplazamiento de partículas) en sólidos están estrechamente relacionados con los mecanismos de flujo viscoso y solidificación en materiales líquidos. Las descripciones de la viscosidad en términos de "espacio libre" molecular dentro del líquido se modificaron según fue necesario para tener en cuenta los líquidos cuyas moléculas se sabe que están "asociadas" en estado líquido a temperaturas ordinarias. Cuando varias moléculas se combinan para formar una molécula asociada, encierran dentro de un sistema semirrígido una cierta cantidad de espacio que antes estaba disponible como espacio libre para moléculas móviles. Por lo tanto, aumenta la viscosidad al enfriarse debido a la tendencia de la mayoría de las sustancias a asociarse al enfriarse.
Se podrían usar argumentos similares para describir los efectos de la presión sobre la viscosidad, donde se puede suponer que la viscosidad es principalmente una función del volumen para líquidos con una compresibilidad finita. Por lo tanto, se espera una viscosidad creciente con el aumento de la presión. Además, si el volumen se expande por el calor pero se reduce nuevamente por la presión, la viscosidad permanece igual.
La tendencia local a la orientación de las moléculas en pequeños grupos le da al líquido (como se mencionó anteriormente) un cierto grado de asociación. Esta asociación da como resultado una "presión interna" considerable dentro de un líquido, que se debe casi por completo a aquellas moléculas que, debido a sus bajas velocidades temporales (siguiendo la distribución de Maxwell) se han fusionado con otras moléculas. La presión interna entre varias de estas moléculas podría corresponder a la existente entre un grupo de moléculas en forma sólida.
| ADesde | Sólido | Líquido | Gas | Plasma |
|---|---|---|---|---|
| Sólido | Derritiendo | Sublimación | ||
| Líquido | Congelación | Vaporización | ||
| Gas | Declaración | Condensación | ionización | |
| Plasma | recombinación |
Contenido relacionado
Constante física
Partículas sin Masa
Masa
ArXiv
Constante cosmológica