Lactasa
La lactasa es una enzima producida por muchos organismos. Se encuentra en el borde en cepillo del intestino delgado de humanos y otros mamíferos. La lactasa es esencial para la digestión completa de la leche entera; descompone la lactosa, un azúcar que le da a la leche su dulzura. Las personas que tienen deficiencia de lactasa y consumen productos lácteos pueden experimentar los síntomas de intolerancia a la lactosa. La lactasa se puede comprar como suplemento alimenticio y se agrega a la leche para producir leche "sin lactosa" productos lacteos.
La lactasa (también conocida como lactasa-florizina hidrolasa o LPH), parte de la familia de enzimas β-galactosidasa, es una glucósido hidrolasa implicada en la hidrólisis del disacárido lactosa en monómeros constituyentes de galactosa y glucosa. La lactasa está presente predominantemente a lo largo de la membrana del borde en cepillo de los enterocitos diferenciados que recubren las vellosidades del intestino delgado. En humanos, la lactasa está codificada por el gen LCT en el cromosoma 2.
Usos
Uso alimentario
La lactasa es una enzima que algunas personas no pueden producir en el intestino delgado. La tecnología para producir leche, helado y yogur sin lactosa fue desarrollada por el Servicio de Investigación Agrícola del USDA en 1985. Esta tecnología se usa para agregar lactasa a la leche, hidrolizando así la lactosa que se encuentra naturalmente en la leche, dejándola ligeramente dulce pero digerible por todo el mundo. Sin lactasa, las personas intolerantes a la lactosa pasan la lactosa sin digerir al colon, donde las bacterias la descomponen, creando dióxido de carbono y eso provoca hinchazón y flatulencia.
Uso médico
Los suplementos de lactasa a veces se usan para tratar la intolerancia a la lactosa.
Uso industrial
La lactasa producida comercialmente se puede extraer tanto de levaduras como Kluyveromyces fragilis y Kluyveromyces lactis como de mohos, como Aspergillus niger y Aspergillus oryzae. Su principal uso comercial, en suplementos y productos como los de Lacteeze y Lactaid, es descomponer la lactosa en la leche para que sea apta para personas con intolerancia a la lactosa. La Administración de Drogas y Alimentos de los EE. UU. no ha evaluado estos productos de forma independiente.
La lactasa (o una forma similar de beta-galactosidasa) también se usa para detectar colonias de color blanco azulado en los múltiples sitios de clonación de varios vectores plasmídicos en Escherichia coli u otras bacterias.
Mecanismo
La temperatura óptima para la lactasa humana es de unos 37 °C y el pH óptimo es de 6.
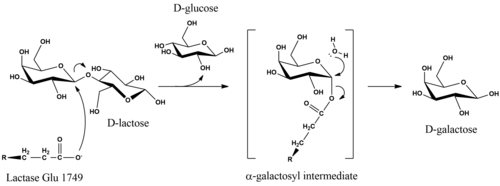
En el metabolismo, el enlace β-glucosídico en la D-lactosa se hidroliza para formar D-galactosa y D-glucosa, que pueden ser absorbido a través de las paredes intestinales y al torrente sanguíneo. La reacción global que cataliza la lactasa es C12H22O11 + H2O → C 6H12O6 + C6H12O6 + calor.
El mecanismo catalítico de la hidrólisis de D-lactosa retiene la configuración anomérica del sustrato en los productos. Si bien los detalles del mecanismo son inciertos, la retención estereoquímica se logra mediante una reacción de doble desplazamiento. Estudios de E. coli lactasa han propuesto que la hidrólisis se inicia cuando un nucleófilo de glutamato en la enzima ataca desde el lado axial del carbono galactosilo en el enlace β-glucosídico. La eliminación del grupo saliente D-glucosa puede facilitarse mediante catálisis ácida dependiente de Mg. La enzima se libera del resto α-galactosilo tras el ataque nucleofílico ecuatorial del agua, que produce D-galactosa.
Los estudios de modificación del sustrato han demostrado que los restos 3′-OH y 2′-OH en el anillo de galactopiranosa son esenciales para el reconocimiento enzimático y la hidrólisis. El grupo 3'-hidroxi participa en la unión inicial al sustrato, mientras que el grupo 2' no es necesario para el reconocimiento, pero sí en los pasos posteriores. Esto se demuestra por el hecho de que un análogo 2-desoxi es un inhibidor competitivo eficaz (Ki = 10 mM). La eliminación de grupos hidroxilo específicos en el resto de glucopiranosa no elimina la catálisis.
La lactasa también cataliza la conversión de florizina en floretina y glucosa.
Estructura y biosíntesis
La preprolactasa, el producto de traducción principal, tiene una estructura primaria polipeptídica única que consta de 1927 aminoácidos. Puede dividirse en cinco dominios: (i) una secuencia señal escindida de 19 aminoácidos; (ii) un gran dominio de prosecuencia que no está presente en la lactasa madura; (iii) el segmento de lactasa madura; (iv) un ancla hidrófoba que atraviesa la membrana; y (v) un extremo carboxilo hidrofílico corto. La secuencia señal se escinde en el retículo endoplásmico y la pro-LPH de 215 kDa resultante se envía al aparato de Golgi, donde se glucosila intensamente y se procesa proteolíticamente hasta su forma madura. Se ha demostrado que el prodominio actúa como una chaperona intramolecular en el ER, evitando la escisión de la tripsina y permitiendo que la LPH adopte la estructura tridimensional necesaria para ser transportada al aparato de Golgi.
La lactasa humana madura consta de una única cadena polipeptídica de 160 kDa que se localiza en la membrana del borde en cepillo de las células epiteliales intestinales. Está orientado con el extremo N fuera de la célula y el extremo C en el citosol. LPH contiene dos sitios catalíticos de ácido glutámico. En la enzima humana, la actividad de la lactasa se ha relacionado con Glu-1749, mientras que Glu-1273 es el sitio de la función de hidrolasa de florizina.
Expresión y regulación genética
La lactasa está codificada por un solo locus genético en el cromosoma 2. Se expresa exclusivamente en los enterocitos del intestino delgado de los mamíferos y en niveles muy bajos en el colon durante el desarrollo fetal. Los humanos nacen con altos niveles de expresión de lactasa. En la mayor parte de la población mundial, la transcripción de lactasa se regula a la baja después del destete, lo que resulta en una disminución de la expresión de lactasa en el intestino delgado, lo que causa los síntomas comunes de hipolactasia de tipo adulto o intolerancia a la lactosa.
Algunos segmentos de la población exhiben persistencia de lactasa como resultado de una mutación que se postula que ocurrió hace entre 5000 y 10 000 años, coincidiendo con el auge de la domesticación del ganado. Esta mutación ha permitido que casi la mitad de la población mundial metabolice la lactosa sin síntomas. Los estudios han relacionado la aparición de la persistencia de la lactasa con dos polimorfismos diferentes de un solo nucleótido aproximadamente 14 y 22 kilobases aguas arriba del extremo 5' del gen LPH. Ambas mutaciones, C→T en la posición -13910 y G→A en la posición -22018, se han relacionado de forma independiente con la persistencia de la lactasa.
El promotor de la lactasa tiene una longitud de 150 pares de bases y está ubicado aguas arriba del sitio de inicio de la transcripción. La secuencia está muy conservada en los mamíferos, lo que sugiere que los reguladores transcripcionales cis críticos se encuentran cerca. Cdx-2, HNF-1α y GATA se han identificado como factores de transcripción. Los estudios de aparición de hipolactasia han demostrado que, a pesar de los polimorfismos, existe poca diferencia en la expresión de lactasa en los lactantes, lo que demuestra que las mutaciones se vuelven cada vez más relevantes durante el desarrollo. Las proteínas de unión al ADN reguladas por el desarrollo pueden regular a la baja la transcripción o desestabilizar las transcripciones de ARNm, lo que provoca una disminución de la expresión de LPH después del destete.
Contenido relacionado
Tecnología de asistencia
Medicina de la obesidad
Liposucción