Ley de Graham
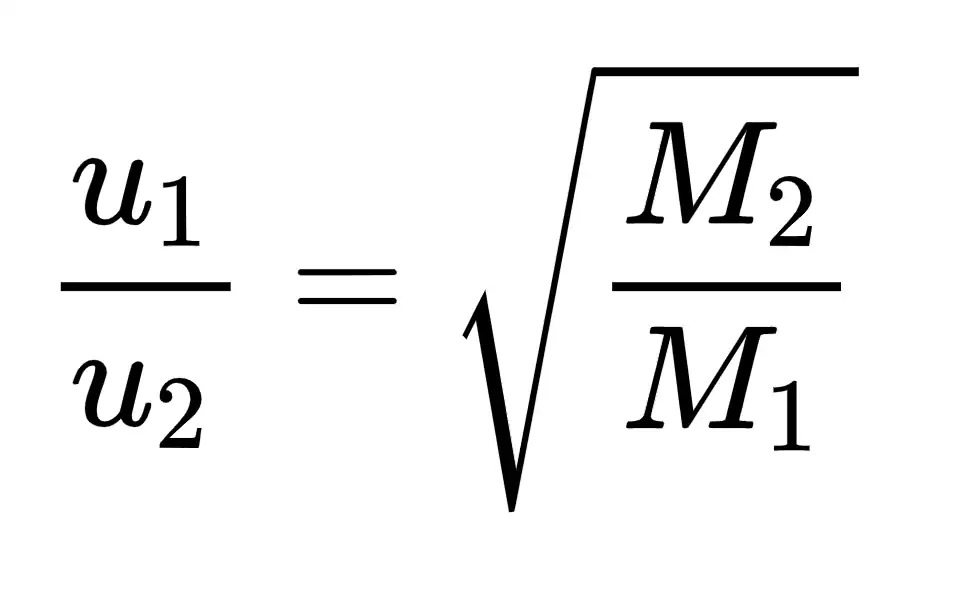
La Ley de Graham es un principio de la física de los gases, este principio establece que la velocidad de difusión y efusión de un gas, es inversamente proporcional a la raíz cuadrada de su masa molar. Esta Ley toma su nombre del físico-químico escocés Thomas Graham, quien formuló este fenómeno en 1848. La Ley se conoce también como Ley de difusión de Graham o Ley de efusión de Graham.
Graham descubrió experimentalmente que los gases más ligeros escapan a través de orificios más rápidamente que gases más pesados, de donde dedujo la proporcionalidad inversa entre masa molar y tasa de difusión/efusión.
La Ley de Graham se enuncia de la siguiente manera:
"La velocidad de difusión y efusión de un gas es inversamente proporcional a la raíz cuadrada de su peso molecular"
Enunciado de la Ley de Graham
La fórmula de la Ley de Graham es:
Tasa1 / Tasa2 = √( Masa2 / Masa1 )
Donde:
- Tasa1 y Tasa2 son las tasas de efusión de dos gases diferentes, medidas en volumen o cantidad de moles por unidad de tiempo.
- Masa1 y Masa2 representan las masas molares de estos gases.
Así, por ejemplo, si el peso molecular de un gas es cuatro veces mayor al de otro, este se difundiría a través de un tapón poroso o escaparía a través de un pequeño orificio en un recipiente, a la mitad de la velocidad del otro (los gases más pesados se difunden más lentamente). Años más tarde, la teoría cinética de los gases explicó teóricamente, de forma más completa, cómo funciona la Ley de Graham.
Una aplicación significativa en la química-física, es por ejemplo en la separación de isótopos por difusión, entendimiento necesario para el desarrollo de la bomba atómica.
Debe mencionarse que la Ley de Graham es más precisa en situaciones de efusión molecular (cuando un gas se mueve a través de un orificio) y su precisión disminuye en procesos de difusión molecular (cuando un gas se difunde en otro o en el aire) ya que esto involucra el movimiento de más de un gas.
En condiciones iguales de temperatura y presión, la masa molar es proporcional a la densidad del gas. Por lo tanto, las tasas de difusión de diferentes gases también son inversamente proporcionales a las raíces cuadradas de sus densidades de masa. Esto amplía la utilidad de la Ley de Graham en diversos campos de la química y la física.
- r∝ ∝ 1d{displaystyle {mbox{r}}propto {mbox{1}over {sqrt {d}}}}
Donde d es la densidad.
HSD
Ejemplos
Primer ejemplo: Sea el gas 1 H2 y el gas 2 sea O2. (Este ejemplo está resolviendo la relación entre las tasas de los dos gases)
- Tasa H2Tasa O2=M()O2)M()H2)=322=16=4{displaystyle {mbox{ccH00FF} H}_{2} over {mbox{Rate O}_{2}={sqrt {M(O_{2}) over M(H_{2}}={sqrt {32}}over {sqrt {2}={sqrt {16}=4}
Por lo tanto, las moléculas de hidrógeno se derraman cuatro veces más rápido que las de oxígeno.
La ley de Graham también se puede usar para encontrar el peso molecular aproximado de un gas si un gas es una especie conocida y si existe una relación específica entre las tasas de dos gases (como en el ejemplo anterior). La ecuación se puede resolver para el peso molecular desconocido.
- M2=M1Tasa12Tasa22{displaystyle {M_{2}={M_{1} {mbox{Rate}} {2}} {mbox{Rate}_{2}}}}} {2}}}}} {c}}} {c}}} {c}}}} {c}}}}} {c}}}}}} {c}}}}}}}} {c}} {}}}}}}}}}}}}} {}}}}}}}}}}}} {c}}}}}}}}}}}}} {c}}}}}}}}}}} {c}}}}}}}}}} {c}}}}}}}}}}}}}}} {c}}}}}}}}}}}} {c}}}}}}}}}}}}}}}}}}}}}}} {c}}}}}}}}}}}}}}}}}}}}}}}
La ley de Graham fue la base para separar el uranio-235 del uranio-238 que se encuentra en la uraninita natural (mineral de uranio) durante el Proyecto Manhattan para construir la primera bomba atómica. El gobierno de los Estados Unidos construyó una planta de difusión gaseosa en Clinton Engineer Works en Oak Ridge, Tennessee, a un costo de $ 479 millones (equivalente a $ 5,8 mil millones en 2021). En esta planta, el uranio del mineral de uranio se convirtió primero en hexafluoruro de uranio y luego se obligó repetidamente a difundirse a través de barreras porosas, enriqueciéndose cada vez un poco más en el isótopo uranio-235, un poco más liviano.
Segundo ejemplo: un gas desconocido se difunde 0,25 veces más rápido que el He. ¿Cuál es la masa molar del gas desconocido?
Usando la fórmula de difusión gaseosa, podemos establecer esta ecuación.
- RateunknownRateHe=4M2{displaystyle {frac {mathrm} {Rate} _{mathrm {unknown} # {mathrm {Rate} _{mathrm {He} - Sí. {4}{sqrt {M_{2}}}}
Que es lo mismo que lo siguiente porque el problema establece que la velocidad de difusión del gas desconocido en relación con el gas helio es 0,25.
- 0,25=4M2{displaystyle 0,25={frac {sqrt {4}{sqrt {M_{2}}}}
Reorganizar la ecuación da como resultado
- M=()40,25)2=64gmol{displaystyle M=({frac {sqrt {4}{0.25}}{2}={frac {mathrm {64g} {mathrm {mol}} {m}} {m}}} {m}}} {m}}}}} {m}}}}} {m} }
Historia
La investigación de Graham sobre la difusión de gases se desencadenó por su lectura sobre la observación del químico alemán Johann Döbereiner de que el gas de hidrógeno se difundió a través de una pequeña grieta en una botella de vidrio más rápido que el aire circundante se difundió para reemplazarlo.. Graham midió la velocidad de difusión de los gases a través de tapones de yeso, a través de tubos muy finos ya través de pequeños orificios. De esta manera ralentizó el proceso para que pudiera estudiarse cuantitativamente. Primero afirmó en 1831 que la tasa de efusión de un gas es inversamente proporcional a la raíz cuadrada de su densidad, y luego en 1848 demostró que esta tasa es inversamente proporcional a la raíz cuadrada de la masa molar. Graham pasó a estudiar la difusión de sustancias en solución y en el proceso descubrió que algunas soluciones aparentes en realidad son suspensiones de partículas demasiado grandes para pasar a través de un filtro de pergamino. Llamó a estos materiales coloides, un término que ha llegado a denotar una clase importante de materiales finamente divididos.
Alrededor de la época en que Graham hizo su trabajo, el concepto de peso molecular se estaba estableciendo en gran parte a través de las mediciones de gases. Daniel Bernoulli sugirió en 1738 en su libro Hydrodynamica que el calor aumenta en proporción a la velocidad y, por lo tanto, a la energía cinética de las partículas de gas. El físico italiano Amedeo Avogadro también sugirió en 1811 que volúmenes iguales de diferentes gases contienen el mismo número de moléculas. Así, los pesos moleculares relativos de dos gases son iguales a la relación de pesos de volúmenes iguales de los gases. La idea de Avogadro, junto con otros estudios sobre el comportamiento de los gases, sirvieron de base para el trabajo teórico posterior del físico escocés James Clerk Maxwell para explicar las propiedades de los gases como conjuntos de pequeñas partículas que se mueven a través de un espacio mayormente vacío.
Quizás el mayor éxito de la teoría cinética de los gases, como se la llamó, fue el descubrimiento de que, para los gases, la temperatura medida en la escala de temperatura Kelvin (absoluta) es directamente proporcional a la energía cinética promedio del moléculas de gas La ley de Graham para la difusión podría entonces entenderse como una consecuencia de que las energías cinéticas moleculares son iguales a la misma temperatura.
La razón de lo anterior se puede resumir de la siguiente manera:
La energía cinética de cada tipo de partícula (en este ejemplo, hidrógeno y oxígeno, como se indicó anteriormente) dentro del sistema es igual, según lo define la temperatura termodinámica:
- 12mH2vH22=12mO2vO22{fnMicroc} {1}{2}m_{rm} {H_{2}v_{rm} {H_{2}}{2}={frac} {1}{2}m_{rm} {fnK}v_{rm} {fnK}}} {2}}}}
Que se puede simplificar y reorganizar para:
- vH22vO22=mO2mH2{displaystyle {frac {fn\fnMicrosoft {fnMicrosoft {\fnMicrosoft {\\fn\\\\\\\\\fn\\\\\fnMicrosoft\\\\\\\\\\\\\\\\\\\\\\\\fnMicrom\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\fnMinMin {H_{2}}} {v_{rm} {cH}} {cH}} {cH}} {c}} {c}} {c}}}} {c}} {cH_}}}} {c}}} {c}} {c}}}}} {c}}}}}}} {c}}}}}}}} {c}}}}}} {c}}} {cccc}}}}}} {c}}}}}}}}}}}}} {cc}}}}}}}}}}}}} {cccccccccccccccccccccH_}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}} {c {fnK}} {fnMicroc}}} {fnMicroc}}}}} {f}}} {f}}}} {fn}}}}}}} {fnMicroc}}}}}} {f}}}}} {fnf}}}}}}}} {fnfnfnfnf}}}}}}}}}}}}}}}}}}}} {f}}}}}}} {f} {f} {f}f} {f} {fnf}f}f}f}f}f}}}}f}f}fnf}fnfnf}fnf}}fnfnfnf}fnfnfnfnfnfnfnfnfnfnf}}}}}}} {m_{rm} {fnK} {fnMicrosoft}} {fnMicrosoft}}} {fnfn}} {fn}} {fnfn}}}} {fnfn}}}} {fnfn}}} {fnf}}}}}}} {fnf}}}}}}}}} {m}}} {m}}}}} {m}} {m} {m} {m} {m} {m}}} {m} {m}} {m}}}} {m}}}}}}}}} {m}}}}} {m} {m}} {m} {m} {m}}} {m} {m} {m}} {m}}}}}}} {m} {m} {m}}} {m}}}}}}}}}} {m} { {}}}
o:
- vH2vO2=mO2mH2{displaystyle {frac {fn\fnMicrosoft {fnMicrosoft {\fnMicrosoft {\\fn\\\\\\\\\fn\\\\\fnMicrosoft\\\\\\\\\\\\\\\\\\\\\\\\fnMicrom\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\fnMinMin {H_{2}}{v_{rm} {fnK}}= {fnK}} {fnK}}}}= {fnK}}} {f}}} {fn}}}}}}} {f}}}}}}}} {fnf}}}}}}} {f}}}}}}}}} {fnfnfnf}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}} {\ sq\\ sq\\\ sq\\\\f}}}}}}}}}}}}}}}}}}}}} { sq\ sq\\\\\\ sq\\\\\\\\\\\fn\\\\\\\\\\\\ {fnMicroc {m_{rm} {fnK} {fnMicrosoft}} {fnMicrosoft}}} {fnfn}} {fn}} {fnfn}}}} {fnfn}}}} {fnfn}}} {fnf}}}}}}} {fnf}}}}}}}}} {m}}} {m}}}}} {m}} {m} {m} {m} {m} {m}}} {m} {m}} {m}}}} {m}}}}}}}}} {m}}}}} {m} {m}} {m} {m} {m}}} {m} {m} {m}} {m}}}}}}} {m} {m} {m}}} {m}}}}}}}}}} {m} { {H_{2}}}}}
Ergo, al restringir el sistema al paso de partículas a través de un área, la Ley de Graham aparece como está escrita al comienzo de este artículo.
Contenido relacionado
Ley de las proporciones múltiples
Agente reductor
Constante de faraday








