Howard Florey
(leer más)
La inflamación (del latín: inflammatio) es parte de la compleja respuesta biológica de los tejidos corporales a estímulos dañinos, como patógenos, células dañadas o irritantes, y es una respuesta protectora que involucra células inmunitarias, vasos sanguíneos y mediadores moleculares. La función de la inflamación es eliminar la causa inicial de la lesión celular, eliminar las células necróticas y los tejidos dañados por la lesión original y el proceso inflamatorio e iniciar la reparación del tejido.
Los cinco signos cardinales son calor, dolor, enrojecimiento, hinchazón y pérdida de función (del latín calor, dolor, rubor, tumor y functio laesa). La inflamación es una respuesta genérica, por lo que se considera un mecanismo de inmunidad innata, frente a la inmunidad adaptativa, que es específica para cada patógeno. Muy poca inflamación podría conducir a la destrucción progresiva del tejido por el estímulo dañino (por ejemplo, bacterias) y comprometer la supervivencia del organismo. Por el contrario, demasiada inflamación, en forma de inflamación crónica, se asocia con diversas enfermedades, como la fiebre del heno, la enfermedad periodontal, la aterosclerosis y la osteoartritis.
La inflamación se puede clasificar como aguda o crónica. La inflamación aguda es la respuesta inicial del cuerpo a los estímulos nocivos y se logra mediante el aumento del movimiento del plasma y los leucocitos (en particular, los granulocitos) desde la sangre hacia los tejidos lesionados. Una serie de eventos bioquímicos propaga y madura la respuesta inflamatoria, involucrando el sistema vascular local, el sistema inmunológico y varias células dentro del tejido lesionado. La inflamación prolongada, conocida como inflamación crónica, conduce a un cambio progresivo en el tipo de células presentes en el sitio de la inflamación, como las células mononucleares, y se caracteriza por la destrucción y curación simultáneas del tejido del proceso inflamatorio.
La inflamación también se ha clasificado como tipo 1 y tipo 2 según el tipo de citoquinas y células T auxiliares (Th1 y Th2) involucradas.
Inflamación no es sinónimo de infección. La infección describe la interacción entre la acción de la invasión microbiana y la reacción de la respuesta inflamatoria del cuerpo; los dos componentes se consideran juntos cuando se habla de una infección, y la palabra se usa para implicar una causa invasiva microbiana para la reacción inflamatoria observada. La inflamación, por otro lado, describe puramente la respuesta inmunovascular del cuerpo, cualquiera que sea la causa. Pero debido a la frecuencia con la que los dos se correlacionan, las palabras que terminan en el sufijo -itis (que se refiere a la inflamación) a veces se describen informalmente como una referencia a la infección. Por ejemplo, la palabra uretritissignifica estrictamente solo "inflamación de la uretra", pero los proveedores de atención médica suelen hablar de la uretritis como una infección de la uretra porque la invasión microbiana de la uretra es la causa más común de uretritis.
Sin embargo, la distinción inflamación-infección se vuelve crucial para situaciones en patología y diagnóstico médico donde la inflamación no es impulsada por una invasión microbiana, como los casos de aterosclerosis, trauma, isquemia y enfermedades autoinmunes (incluida la hipersensibilidad tipo III).
Físico:
Biológico:
Químico:
Psicológico:
| ApendicitisBursitisColitisCistitisDermatitisepididimitisEncefalitisGingivitisMeningitisMielitisNefritisNeuritispancreatitisperiodontitis | FaringitisFlebitisProstatitisDSR/CRPSRinitisSinusitistendinitisAmigdalitisuretritisvasculitisvaginitis |
| Agudo | Crónico | |
|---|---|---|
| Agente causal | Patógenos bacterianos, tejidos dañados | Inflamación aguda persistente debido a patógenos no degradables, infección viral, cuerpos extraños persistentes o reacciones autoinmunes |
| Principales células involucradas | neutrófilos (principalmente), basófilos (respuesta inflamatoria) y eosinófilos (respuesta a helmintos y parásitos), células mononucleares (monocitos, macrófagos) | Células mononucleares (monocitos, macrófagos, linfocitos, células plasmáticas), fibroblastos |
| mediadores primarios | Aminas vasoactivas, eicosanoides | IFN-γ y otras citocinas, factores de crecimiento, especies reactivas de oxígeno, enzimas hidrolíticas |
| Comienzo | Inmediato | Demorado |
| Duración | Pocos diás | Hasta muchos meses o años |
| Resultados | Resolución, formación de abscesos, inflamación crónica | Destrucción tisular, fibrosis, necrosis |
La inflamación aguda ocurre inmediatamente después de la lesión y dura solo unos pocos días. Las citocinas y las quimiocinas promueven la migración de neutrófilos y macrófagos al sitio de la inflamación. Los patógenos, los alérgenos, las toxinas, las quemaduras y las congelaciones son algunas de las causas típicas de la inflamación aguda. Los receptores tipo Toll (TLR) reconocen patógenos microbianos. La inflamación aguda puede ser un mecanismo defensivo para proteger los tejidos contra lesiones. La inflamación que dura de 2 a 6 semanas se denomina inflamación subaguda.
La inflamación crónica es una inflamación que dura meses o años. Los macrófagos, linfocitos y células plasmáticas predominan en la inflamación crónica, en contraste con los neutrófilos que predominan en la inflamación aguda. La diabetes, las enfermedades cardiovasculares, las alergias y la enfermedad pulmonar obstructiva crónica (EPOC) son ejemplos de enfermedades mediadas por inflamación crónica. La obesidad, el tabaquismo, el estrés y una dieta insuficiente son algunos de los factores que favorecen la inflamación crónica. Un estudio de 2014 informó que el 60 % de los estadounidenses tenía al menos una afección inflamatoria crónica, mientras que el 42 % tenía más de una.
| inglés | latín |
|---|---|
| Enrojecimiento | rubor |
| Hinchazón | Tumor |
| Calor | Calor |
| Dolor | Dolor |
| Pérdida de función | funcion laesa |
La inflamación aguda es un proceso a corto plazo, que suele aparecer en unos pocos minutos u horas y comienza a cesar con la eliminación del estímulo nocivo. Implica una respuesta de movilización coordinada y sistémica a nivel local de diversos mediadores inmunitarios, endocrinos y neurológicos de la inflamación aguda. En una respuesta saludable normal, se activa, elimina el patógeno y comienza un proceso de reparación y luego cesa. Se caracteriza por cinco signos cardinales:
Los nombres tradicionales de los signos de inflamación provienen del latín:
Los primeros cuatro (signos clásicos) fueron descritos por Celso (ca. 30 a. C.-38 d. C.), mientras que Galeno probablemente agregó más tarde la pérdida de función. Sin embargo, la adición de este quinto signo también se ha atribuido a Thomas Sydenham y Virchow.
El enrojecimiento y el calor se deben al aumento del flujo sanguíneo a la temperatura central del cuerpo hacia el sitio inflamado; la hinchazón es causada por la acumulación de líquido; el dolor se debe a la liberación de sustancias químicas como la bradicinina y la histamina que estimulan las terminaciones nerviosas. La pérdida de función tiene múltiples causas.
La inflamación aguda del pulmón (generalmente como en respuesta a la neumonía) no causa dolor a menos que la inflamación involucre la pleura parietal, que tiene terminaciones nerviosas sensibles al dolor.
El proceso de inflamación aguda es iniciado por células inmunitarias residentes ya presentes en el tejido afectado, principalmente macrófagos residentes, células dendríticas, histiocitos, células de Kupffer y mastocitos. Estas células poseen receptores de superficie conocidos como receptores de reconocimiento de patrones (PRR), que reconocen (es decir, se unen) a dos subclases de moléculas: patrones moleculares asociados a patógenos (PAMP) y patrones moleculares asociados a daños (DAMP). Los PAMP son compuestos que están asociados con varios patógenos, pero que se distinguen de las moléculas huésped. Los DAMP son compuestos que están asociados con lesiones relacionadas con el huésped y daño celular.
Al inicio de una infección, quemadura u otras lesiones, estas células se activan (uno de los PRR reconoce un PAMP o DAMP) y liberan mediadores inflamatorios responsables de los signos clínicos de inflamación. La vasodilatación y el aumento del flujo sanguíneo resultante causan enrojecimiento (rubor) y aumento del calor (calor). El aumento de la permeabilidad de los vasos sanguíneos da como resultado una exudación (fuga) de proteínas plasmáticas y líquido hacia el tejido (edema), que se manifiesta como hinchazón (tumor). Algunos de los mediadores liberados, como la bradicinina, aumentan la sensibilidad al dolor (hiperalgesia, dolor). Las moléculas mediadoras también alteran los vasos sanguíneos para permitir la migración de leucocitos, principalmente neutrófilos y macrófagos, para salir de los vasos sanguíneos (extravasación) y entrar en el tejido. Los neutrófilos migran a lo largo de un gradiente quimiotáctico creado por las células locales para llegar al sitio de la lesión. La pérdida de función (functio laesa) es probablemente el resultado de un reflejo neurológico en respuesta al dolor.
Además de los mediadores derivados de células, varios sistemas en cascada bioquímicos acelulares, que consisten en proteínas plasmáticas preformadas, actúan en paralelo para iniciar y propagar la respuesta inflamatoria. Estos incluyen el sistema del complemento activado por bacterias y los sistemas de coagulación y fibrinólisis activados por necrosis (p. ej., quemadura, traumatismo).
La inflamación aguda puede considerarse como la primera línea de defensa contra las lesiones. La respuesta inflamatoria aguda requiere una estimulación constante para mantenerse. Los mediadores inflamatorios tienen una vida corta y se degradan rápidamente en el tejido. Por lo tanto, la inflamación aguda comienza a cesar una vez que se ha eliminado el estímulo.
Como se define, la inflamación aguda es una respuesta inmunovascular a estímulos inflamatorios. Esto significa que la inflamación aguda se puede dividir ampliamente en una fase vascular que ocurre primero, seguida de una fase celular que involucra células inmunitarias (más específicamente, granulocitos mieloides en el contexto agudo). El componente vascular de la inflamación aguda implica el movimiento de líquido plasmático, que contiene proteínas importantes como fibrina e inmunoglobulinas (anticuerpos), hacia el tejido inflamado.
Al entrar en contacto con los PAMP, los macrófagos y mastocitos tisulares liberan aminas vasoactivas como histamina y serotonina, así como eicosanoides como prostaglandina E2 y leucotrieno B4 para remodelar la vasculatura local. Los macrófagos y las células endoteliales liberan óxido nítrico. Estos mediadores vasodilatan y permeabilizan los vasos sanguíneos, lo que da como resultado la distribución neta del plasma sanguíneo desde el vaso al espacio tisular. El aumento de la acumulación de líquido en el tejido hace que se hinche (edema). Este fluido tisular exudado contiene varios mediadores antimicrobianos del plasma, como complemento, lisozima, anticuerpos, que pueden dañar inmediatamente a los microbios y opsonizar a los microbios en preparación para la fase celular. Si el estímulo inflamatorio es una herida lacerante, exudado de plaquetas, coagulantes, la plasmina y las cininas pueden coagular el área herida y proporcionar hemostasia en primera instancia. Estos mediadores de la coagulación también proporcionan un marco de estadificación estructural en el sitio del tejido inflamatorio en forma de red de fibrina, como lo harían los andamios de construcción en un sitio de construcción, con el fin de ayudar al desbridamiento fagocítico y la reparación de heridas más adelante. Parte del líquido tisular exudado también es canalizado por los vasos linfáticos hacia los ganglios linfáticos regionales, lo que hace que las bacterias comiencen la fase de reconocimiento y ataque del sistema inmunitario adaptativo. Estos mediadores de la coagulación también proporcionan un marco de estadificación estructural en el sitio del tejido inflamatorio en forma de red de fibrina, como lo harían los andamios de construcción en un sitio de construcción, con el fin de ayudar al desbridamiento fagocítico y la reparación de heridas más adelante. Parte del líquido tisular exudado también es canalizado por los vasos linfáticos hacia los ganglios linfáticos regionales, lo que hace que las bacterias comiencen la fase de reconocimiento y ataque del sistema inmunitario adaptativo. Estos mediadores de la coagulación también proporcionan un marco de estadificación estructural en el sitio del tejido inflamatorio en forma de red de fibrina, como lo harían los andamios de construcción en un sitio de construcción, con el fin de ayudar al desbridamiento fagocítico y la reparación de heridas más adelante. Parte del líquido tisular exudado también es canalizado por los vasos linfáticos hacia los ganglios linfáticos regionales, lo que hace que las bacterias comiencen la fase de reconocimiento y ataque del sistema inmunitario adaptativo.
La inflamación aguda se caracteriza por cambios vasculares marcados, que incluyen vasodilatación, aumento de la permeabilidad y aumento del flujo sanguíneo, que son inducidos por las acciones de varios mediadores inflamatorios. La vasodilatación se produce primero a nivel de las arteriolas, progresando a nivel de los capilares, y provoca un aumento neto de la cantidad de sangre presente, provocando el enrojecimiento y el calor de la inflamación. El aumento de la permeabilidad de los vasos da como resultado el movimiento del plasma hacia los tejidos, con estasis resultante debido al aumento en la concentración de células dentro de la sangre, una condición caracterizada por vasos agrandados llenos de células. La estasis permite que los leucocitos se marginen (se muevan) a lo largo del endotelio, un proceso crítico para su reclutamiento en los tejidos. La sangre que fluye normalmente previene esto,
* lista no exhaustiva
| Nombre | Producido por | Descripción |
|---|---|---|
| bradicinina | sistema de cinina | Proteína vasoactiva capaz de inducir vasodilatación, aumentar la permeabilidad vascular, provocar la contracción del músculo liso e inducir dolor. |
| C3 | Sistema complementario | Se escinde para producir C3a y C3b. C3a estimula la liberación de histamina por parte de los mastocitos, lo que produce vasodilatación. C3b es capaz de unirse a las paredes celulares bacterianas y actuar como opsonina, lo que marca al invasor como un objetivo para la fagocitosis. |
| C5a | Sistema complementario | Estimula la liberación de histamina por parte de los mastocitos, produciendo así vasodilatación. También es capaz de actuar como un quimioatrayente para dirigir las células a través de la quimiotaxis al sitio de la inflamación. |
| Factor XII (Factor Hageman) | Hígado | Una proteína que circula inactivamente, hasta que es activada por colágeno, plaquetas o membranas basales expuestas a través de un cambio conformacional. Cuando se activa, a su vez es capaz de activar tres sistemas plasmáticos involucrados en la inflamación: el sistema de cininas, el sistema de fibrinólisis y el sistema de coagulación. |
| Complejo de ataque de membrana | Sistema complementario | Un complejo de las proteínas del complemento C5b, C6, C7, C8 y múltiples unidades de C9. La combinación y activación de esta gama de proteínas del complemento forma el complejo de ataque a la membrana, que puede insertarse en las paredes celulares bacterianas y provocar la lisis celular con la consiguiente muerte bacteriana. |
| plasmina | sistema de fibrinólisis | Capaz de descomponer los coágulos de fibrina, escindir la proteína C3 del complemento y activar el factor XII. |
| trombina | Sistema de coagulación | Escinde la proteína plasmática fibrinógeno soluble para producir fibrina insoluble, que se agrega para formar un coágulo de sangre. La trombina también puede unirse a las células a través del receptor PAR1 para desencadenar otras respuestas inflamatorias, como la producción de quimiocinas y óxido nítrico. |
El componente celular involucra leucocitos, que normalmente residen en la sangre y deben moverse hacia el tejido inflamado a través de la extravasación para ayudar en la inflamación. Algunos actúan como fagocitos, ingiriendo bacterias, virus y desechos celulares. Otros liberan gránulos enzimáticos que dañan a los invasores patógenos. Los leucocitos también liberan mediadores inflamatorios que desarrollan y mantienen la respuesta inflamatoria. En general, la inflamación aguda está mediada por granulocitos, mientras que la inflamación crónica está mediada por células mononucleares como monocitos y linfocitos.
Varios leucocitos, particularmente los neutrófilos, están involucrados críticamente en el inicio y mantenimiento de la inflamación. Estas células deben poder moverse al sitio de la lesión desde su ubicación habitual en la sangre, por lo que existen mecanismos para reclutar y dirigir leucocitos al lugar apropiado. El proceso de movimiento de los leucocitos de la sangre a los tejidos a través de los vasos sanguíneos se conoce como extravasación y se puede dividir en varios pasos:
Los neutrófilos extravasados en la fase celular entran en contacto con microbios en el tejido inflamado. Los fagocitos expresan receptores de reconocimiento de patrones endocíticos (PRR) en la superficie celular que tienen afinidad y eficacia contra patrones moleculares asociados a microbios no específicos (PAMP). La mayoría de los PAMP que se unen a los PRR endocíticos e inician la fagocitosis son componentes de la pared celular, incluidos carbohidratos complejos como mananos y β-glucanos, lipopolisacáridos (LPS), peptidoglucanos y proteínas de superficie. Los PRR endocíticos en los fagocitos reflejan estos patrones moleculares, con receptores de lectina de tipo C que se unen a mananos y β-glucanos, y receptores depuradores que se unen a LPS.
Tras la unión endocítica de PRR, se produce un reordenamiento del citoesqueleto de actina-miosina adyacente a la membrana plasmática de una manera que endocitosis la membrana plasmática que contiene el complejo PRR-PAMP y el microbio. Las vías de señalización de fosfatidilinositol y Vps34-Vps15-Beclin1 se han implicado en el tráfico del fagosoma endocitosado a los lisosomas intracelulares, donde la fusión del fagosoma y el lisosoma produce un fagolisosoma. Las especies reactivas de oxígeno, los superóxidos y el blanqueador de hipoclorito dentro de los fagolisosomas luego matan los microbios dentro del fagocito.
La eficacia fagocítica puede mejorarse mediante la opsonización. El complemento C3b derivado del plasma y los anticuerpos que exudan en el tejido inflamado durante la fase vascular se unen a los antígenos microbianos y los recubren. Además de los PRR endocíticos, los fagocitos también expresan receptores de opsonina Fc receptor y complemento receptor 1 (CR1), que se unen a anticuerpos y C3b, respectivamente. La coestimulación del PRR endocítico y el receptor de opsonina aumenta la eficacia del proceso fagocítico, potenciando la eliminación lisosomal del agente infeccioso.
* lista no exhaustiva
| Nombre | Tipo | Fuente | Descripción |
|---|---|---|---|
| Gránulos de lisosoma | Enzimas | Granulocitos | Estas células contienen una gran variedad de enzimas que realizan una serie de funciones. Los gránulos se pueden clasificar como específicos o azurofílicos según el contenido, y pueden descomponer una serie de sustancias, algunas de las cuales pueden ser proteínas derivadas del plasma que permiten que estas enzimas actúen como mediadores inflamatorios. |
| GM-CSF | glicoproteína | Macrófagos, monocitos, células T, células B y células residentes en tejidos | Se ha demostrado que el GM-CSF elevado contribuye a la inflamación en la artritis inflamatoria, la osteoartritis, la colitis, el asma, la obesidad y la COVID-19. |
| histamina | monoamina | Mastocitos y basófilos | Almacenada en gránulos preformados, la histamina se libera en respuesta a una serie de estímulos. Provoca dilatación de las arteriolas, aumento de la permeabilidad venosa y una amplia variedad de efectos específicos de órganos. |
| IFN-γ | citocina | Células T, células NK | Propiedades antivirales, inmunorreguladoras y antitumorales. Este interferón se denominó originalmente factor activador de macrófagos y es especialmente importante en el mantenimiento de la inflamación crónica. |
| IL-6 | Citoquinas y Mioquinas | Macrófagos, osteoblastos, adipocitos y células de músculo liso (citocina) Células de músculo esquelético (miocina) | Citocina proinflamatoria secretada por macrófagos en respuesta a patrones moleculares asociados a patógenos (PAMP); citocina proinflamatoria secretada por los adipocitos, especialmente en la obesidad; miocina antiinflamatoria secretada por las células del músculo esquelético en respuesta al ejercicio. |
| IL-8 | quimiocina | Principalmente macrófagos | Activación y quimioatracción de neutrófilos, con débil efecto sobre monocitos y eosinófilos. |
| Leucotrieno B4 | eicosanoide | Leucocitos, células cancerosas | Capaz de mediar en la adhesión y activación de los leucocitos, permitiéndoles unirse al endotelio y migrar a través de él. En los neutrófilos, también es un potente quimioatrayente y es capaz de inducir la formación de especies reactivas de oxígeno y la liberación de enzimas lisosomales por parte de estas células. |
| LTC4, LTD4 | eicosanoide | eosinófilos, mastocitos, macrófagos | Estos tres leucotrienos que contienen cisteína contraen las vías respiratorias de los pulmones, aumentan la permeabilidad microvascular, estimulan la secreción de moco y promueven la inflamación basada en eosinófilos en los pulmones, la piel, la nariz, los ojos y otros tejidos. |
| ácido 5-oxo-eicosatetraenoico | eicosanoide | leucocitos, células cancerosas | Estimulador potente de la quimiotaxis de neutrófilos, liberación de enzimas lisosomales y formación de especies reactivas de oxígeno; quimiotaxis de monocitos; y con una quimiotaxis de eosinófilos de potencia aún mayor, liberación de enzimas lisosomales y formación de especies reactivas de oxígeno. |
| 5-HETE | eicosanoide | leucocitos | Precursor metabólico del ácido 5-oxo-eicosatetraenoico, es un estimulador menos potente de la quimiotaxis de neutrófilos, la liberación de enzimas lisosomales y la formación de especies reactivas de oxígeno; quimiotaxis de monocitos; y quimiotaxis de eosinófilos, liberación de enzimas lisosomales y formación de especies reactivas de oxígeno. |
| prostaglandinas | eicosanoide | mastocitos | Un grupo de lípidos que pueden causar vasodilatación, fiebre y dolor. |
| Óxido nítrico | gas soluble | Macrófagos, células endoteliales, algunas neuronas | Potente vasodilatador, relaja el músculo liso, reduce la agregación plaquetaria, ayuda en el reclutamiento de leucocitos, actividad antimicrobiana directa en altas concentraciones. |
| TNF-α e IL-1 | citocinas | Principalmente macrófagos | Ambos afectan a una amplia variedad de células para inducir muchas reacciones inflamatorias similares: fiebre, producción de citoquinas, regulación de genes endoteliales, quimiotaxis, adherencia de leucocitos, activación de fibroblastos. Responsable de los efectos sistémicos de la inflamación, como pérdida de apetito y aumento del ritmo cardíaco. TNF-α inhibe la diferenciación de osteoblastos. |
| triptasa | Enzimas | mastocitos | Se cree que esta serina proteasa se almacena exclusivamente en los mastocitos y se secreta, junto con la histamina, durante la activación de los mastocitos. |
Se observan patrones específicos de inflamación aguda y crónica durante situaciones particulares que surgen en el cuerpo, como cuando la inflamación ocurre en una superficie epitelial o cuando están involucradas bacterias piógenas.
Las anomalías inflamatorias son un gran grupo de trastornos que subyacen a una gran variedad de enfermedades humanas. El sistema inmunitario a menudo está involucrado en los trastornos inflamatorios, como se demuestra tanto en las reacciones alérgicas como en algunas miopatías, y muchos trastornos del sistema inmunitario provocan una inflamación anormal. Las enfermedades no inmunes con orígenes causales en los procesos inflamatorios incluyen el cáncer, la aterosclerosis y la cardiopatía isquémica.
Los ejemplos de trastornos asociados con la inflamación incluyen:
La aterosclerosis, anteriormente considerada una enfermedad de almacenamiento de lípidos blandos, en realidad implica una respuesta inflamatoria continua. Avances recientes en la ciencia básica han establecido un papel fundamental para la inflamación en la mediación de todas las etapas de la aterosclerosis desde el inicio hasta la progresión y, en última instancia, las complicaciones trombóticas de la misma. Estos nuevos hallazgos proporcionan vínculos importantes entre los factores de riesgo y los mecanismos de aterogénesis. Los estudios clínicos han demostrado que esta biología emergente de la inflamación en la aterosclerosis se aplica directamente a los pacientes humanos. La elevación de los marcadores de inflamación predice los resultados de los pacientes con síndromes coronarios agudos, independientemente del daño miocárdico. Además, la inflamación crónica de bajo grado, como lo indican los niveles del marcador inflamatorio proteína C reactiva, define prospectivamente el riesgo de complicaciones ateroscleróticas, lo que se suma a la información pronóstica proporcionada por los factores de riesgo tradicionales. Además, ciertos tratamientos que reducen el riesgo coronario también limitan la inflamación. En el caso de los hipolipemiantes con estatinas, el efecto antiinflamatorio no parece correlacionarse con la reducción de los niveles de lipoproteínas de baja densidad. Estos nuevos conocimientos sobre la inflamación contribuyen a la etiología de la aterosclerosis y las aplicaciones clínicas prácticas en la estratificación del riesgo y la orientación de la terapia para la aterosclerosis. el efecto antiinflamatorio no parece correlacionarse con la reducción de los niveles de lipoproteínas de baja densidad. Estos nuevos conocimientos sobre la inflamación contribuyen a la etiología de la aterosclerosis y las aplicaciones clínicas prácticas en la estratificación del riesgo y la orientación de la terapia para la aterosclerosis. el efecto antiinflamatorio no parece correlacionarse con la reducción de los niveles de lipoproteínas de baja densidad. Estos nuevos conocimientos sobre la inflamación contribuyen a la etiología de la aterosclerosis y las aplicaciones clínicas prácticas en la estratificación del riesgo y la orientación de la terapia para la aterosclerosis.
Una reacción alérgica, conocida formalmente como hipersensibilidad tipo 1, es el resultado de una respuesta inmunitaria inapropiada que provoca inflamación, vasodilatación e irritación nerviosa. Un ejemplo común es la fiebre del heno, que es causada por una respuesta hipersensible de los mastocitos a los alérgenos. Los mastocitos presensibilizados responden desgranulándose y liberando sustancias químicas vasoactivas como la histamina. Estos productos químicos propagan una respuesta inflamatoria excesiva caracterizada por la dilatación de los vasos sanguíneos, la producción de moléculas proinflamatorias, la liberación de citoquinas y el reclutamiento de leucocitos. La respuesta inflamatoria severa puede madurar en una respuesta sistémica conocida como anafilaxia.
Las miopatías inflamatorias son causadas por el ataque inapropiado del sistema inmunitario a los componentes del músculo, lo que provoca signos de inflamación muscular. Pueden ocurrir junto con otros trastornos inmunitarios, como la esclerosis sistémica, e incluyen dermatomiositis, polimiositis y miositis por cuerpos de inclusión.
Debido al papel central de los leucocitos en el desarrollo y la propagación de la inflamación, los defectos en la funcionalidad de los leucocitos a menudo resultan en una disminución de la capacidad de defensa inflamatoria con la subsiguiente vulnerabilidad a la infección. Es posible que los leucocitos disfuncionales no puedan unirse correctamente a los vasos sanguíneos debido a mutaciones en los receptores de superficie, digerir bacterias (síndrome de Chédiak-Higashi) o producir microbicidas (enfermedad granulomatosa crónica). Además, las enfermedades que afectan la médula ósea pueden resultar en leucocitos anormales o escasos.
Se sabe que ciertos fármacos o compuestos químicos exógenos afectan la inflamación. La deficiencia de vitamina A, por ejemplo, provoca un aumento en las respuestas inflamatorias, y los medicamentos antiinflamatorios funcionan específicamente al inhibir las enzimas que producen los eicosanoides inflamatorios. Además, ciertas drogas ilícitas como la cocaína y el éxtasis pueden ejercer algunos de sus efectos perjudiciales al activar factores de transcripción íntimamente relacionados con la inflamación (p. ej., NF-κB).
La inflamación orquesta el microambiente alrededor de los tumores, contribuyendo a la proliferación, supervivencia y migración. Las células cancerosas utilizan selectinas, quimiocinas y sus receptores para la invasión, migración y metástasis. Por otro lado, muchas células del sistema inmunitario contribuyen a la inmunología del cáncer, suprimiendo el cáncer. La intersección molecular entre los receptores de las hormonas esteroides, que tienen efectos importantes en el desarrollo celular, y los factores de transcripción que juegan un papel clave en la inflamación, como NF-κB, pueden mediar algunos de los efectos más críticos de los estímulos inflamatorios en las células cancerosas.Es muy probable que esta capacidad de un mediador de la inflamación para influir en los efectos de las hormonas esteroides en las células afecte a la carcinogénesis. Por otro lado, debido a la naturaleza modular de muchos receptores de hormonas esteroides, esta interacción puede ofrecer formas de interferir con la progresión del cáncer, al dirigirse a un dominio de proteína específico en un tipo de célula específico. Tal enfoque puede limitar los efectos secundarios que no están relacionados con el tumor de interés y puede ayudar a preservar funciones homeostáticas vitales y procesos de desarrollo en el organismo.
Según una revisión de 2009, datos recientes sugieren que la inflamación relacionada con el cáncer (IRC) puede conducir a la acumulación de alteraciones genéticas aleatorias en las células cancerosas.
En 1863, Rudolf Virchow planteó la hipótesis de que el origen del cáncer estaba en los sitios de inflamación crónica. En la actualidad, se estima que la inflamación crónica contribuye a aproximadamente del 15% al 25% de los cánceres humanos.
Un mediador inflamatorio es un mensajero que actúa sobre los vasos sanguíneos y/o las células para promover una respuesta inflamatoria. Los mediadores inflamatorios que contribuyen a la neoplasia incluyen prostaglandinas, citoquinas inflamatorias como IL-1β, TNF-α, IL-6 e IL-15 y quimioquinas como IL-8 y GRO-alfa. Estos mediadores inflamatorios, y otros, orquestan un entorno que fomenta la proliferación y la supervivencia.
La inflamación también causa daños en el ADN debido a la inducción de especies reactivas de oxígeno (ROS) por varios mediadores inflamatorios intracelulares. Además, los leucocitos y otras células fagocíticas atraídas al sitio de la inflamación inducen daños en el ADN de las células en proliferación a través de su generación de ROS y especies reactivas de nitrógeno (RNS). Estas células normalmente producen ROS y RNS para combatir infecciones. Las ROS, por sí solas, causan más de 20 tipos de daños en el ADN. Los daños oxidativos en el ADN provocan tanto mutaciones como alteraciones epigenéticas. RNS también causa daños mutagénicos en el ADN.
Una célula normal puede sufrir carcinogénesis para convertirse en una célula cancerosa si se somete con frecuencia a daños en el ADN durante largos períodos de inflamación crónica. Los daños en el ADN pueden causar mutaciones genéticas debido a una reparación incorrecta. Además, los errores en el proceso de reparación del ADN pueden provocar alteraciones epigenéticas. Las mutaciones y alteraciones epigenéticas que se replican y proporcionan una ventaja selectiva durante la proliferación de células somáticas pueden ser cancerígenas.
Los análisis de todo el genoma de los tejidos cancerosos humanos revelan que una sola célula cancerosa típica puede poseer aproximadamente 100 mutaciones en las regiones codificantes, de las cuales 10 a 20 son "mutaciones impulsoras" que contribuyen al desarrollo del cáncer. Sin embargo, la inflamación crónica también provoca cambios epigenéticos como la metilación del ADN, que suele ser más común que las mutaciones. Por lo general, varios cientos o miles de genes se metilan en una célula cancerosa (ver Metilación del ADN en el cáncer). Los sitios de daño oxidativo en la cromatina pueden reclutar complejos que contienen ADN metiltransferasas (DNMT), una histona desacetilasa (SIRT1) y una histona metiltransferasa (EZH2), y así inducir la metilación del ADN.La metilación del ADN de una isla CpG en una región promotora puede provocar el silenciamiento de su gen aguas abajo (consulte Sitio CpG y regulación de la transcripción en el cáncer). Los genes de reparación del ADN, en particular, se inactivan con frecuencia por metilación en varios tipos de cáncer (ver hipermetilación de los genes de reparación del ADN en el cáncer). Un informe de 2018 evaluó la importancia relativa de las mutaciones y las alteraciones epigenéticas en la progresión de dos tipos diferentes de cáncer. Este informe mostró que las alteraciones epigenéticas eran mucho más importantes que las mutaciones en la generación de cánceres gástricos (asociados a la inflamación). Sin embargo, las mutaciones y las alteraciones epigenéticas tuvieron aproximadamente la misma importancia en la generación de cánceres de células escamosas de esófago (asociados con las sustancias químicas del tabaco y el acetaldehído, un producto del metabolismo del alcohol).
Durante mucho tiempo se ha reconocido que la infección por el VIH se caracteriza no solo por el desarrollo de una inmunodeficiencia profunda, sino también por una inflamación sostenida y una activación inmunitaria. Un cuerpo sustancial de evidencia implica que la inflamación crónica es un impulsor crítico de la disfunción inmunológica, la aparición prematura de enfermedades relacionadas con el envejecimiento y la deficiencia inmunológica. Muchos ahora consideran la infección por VIH no solo como una inmunodeficiencia inducida por virus en evolución, sino también como una enfermedad inflamatoria crónica.Incluso después de la introducción de la terapia antirretroviral (TAR) eficaz y la supresión eficaz de la viremia en las personas infectadas por el VIH, persiste la inflamación crónica. Los estudios en animales también respaldan la relación entre la activación inmunitaria y la inmunodeficiencia celular progresiva: la infección por SIVsm de sus huéspedes primates no humanos naturales, el mangabey negro, causa una replicación viral de alto nivel pero evidencia limitada de enfermedad. Esta falta de patogenicidad va acompañada de una falta de inflamación, activación inmunitaria y proliferación celular. En marcado contraste, la infección experimental por SIVsm del macaco rhesus produce una activación inmunitaria y una enfermedad similar al SIDA con muchos paralelismos con la infección humana por el VIH.
Delinear cómo se agotan las células T CD4 y cómo se inducen la inflamación crónica y la activación inmunitaria se encuentra en el centro de la comprensión de la patogénesis del VIH, una de las principales prioridades para la investigación del VIH de la Oficina de Investigación del SIDA de los Institutos Nacionales de Salud. Estudios recientes demostraron que la piroptosis mediada por caspasa-1, una forma altamente inflamatoria de muerte celular programada, impulsa el agotamiento de las células T CD4 y la inflamación por el VIH.Estos son los dos eventos distintivos que impulsan la progresión de la enfermedad del VIH al SIDA. La piroptosis parece crear un círculo vicioso patógeno en el que las células T CD4 moribundas y otras células inmunitarias (incluidos los macrófagos y los neutrófilos) liberan señales inflamatorias que reclutan más células en los tejidos linfoides infectados para morir. La naturaleza de avance de esta respuesta inflamatoria produce inflamación crónica y daño tisular.Identificar la piroptosis como el mecanismo predominante que causa el agotamiento de las células T CD4 y la inflamación crónica brinda nuevas oportunidades terapéuticas, a saber, la caspasa-1 que controla la vía piroptósica. En este sentido, la piroptosis de las células T CD4 y la secreción de citoquinas proinflamatorias como IL-1β e IL-18 pueden bloquearse en tejidos linfoides humanos infectados con VIH mediante la adición del inhibidor de caspasa-1 VX-765, que ya ha Se ha demostrado que es seguro y bien tolerado en ensayos clínicos en humanos de fase II.Estos hallazgos podrían impulsar el desarrollo de una clase completamente nueva de terapias "anti-SIDA" que actúan dirigiéndose al huésped en lugar del virus. Es casi seguro que tales agentes se usarían en combinación con ART. Al promover la "tolerancia" del virus en lugar de suprimir su replicación, el VX-765 o los medicamentos relacionados pueden imitar las soluciones evolutivas que ocurren en múltiples huéspedes de monos (p. ej., el mangabey negro) infectados con lentivirus específicos de especie que han llevado a la ausencia de la enfermedad., sin disminución en los recuentos de células T CD4 y sin inflamación crónica.
La respuesta inflamatoria debe terminarse activamente cuando ya no se necesite para evitar daños innecesarios a los tejidos por parte de "espectadores". De lo contrario, se produce inflamación crónica y destrucción celular. La resolución de la inflamación ocurre por diferentes mecanismos en diferentes tejidos. Los mecanismos que sirven para terminar la inflamación incluyen:
La inflamación aguda normalmente se resuelve por mecanismos que han permanecido algo esquivos. La evidencia emergente ahora sugiere que un programa activo y coordinado de resolución se inicia en las primeras horas después de que comienza una respuesta inflamatoria. Después de ingresar a los tejidos, los granulocitos promueven el cambio de prostaglandinas y leucotrienos derivados del ácido araquidónico a lipoxinas, que inician la secuencia de terminación. Por lo tanto, cesa el reclutamiento de neutrófilos y se activa la muerte programada por apoptosis. Estos eventos coinciden con la biosíntesis, a partir de ácidos grasos poliinsaturados omega-3, de resolvinas y protectinas, que acortan críticamente el período de infiltración de neutrófilos al iniciar la apoptosis. Como consecuencia, los neutrófilos apoptóticos sufren fagocitosis por macrófagos, lo que conduce a la eliminación de neutrófilos y la liberación de citocinas antiinflamatorias y reparadoras, como el factor de crecimiento transformante-β1. El programa antiinflamatorio termina con la salida de los macrófagos a través de los linfáticos.—Charles Serhan
Existe evidencia de un vínculo entre la inflamación y la depresión. Los procesos inflamatorios pueden desencadenarse por cogniciones negativas o sus consecuencias, como el estrés, la violencia o la privación. Por lo tanto, las cogniciones negativas pueden causar inflamación que, a su vez, puede conducir a la depresión. Además, cada vez hay más pruebas de que la inflamación puede causar depresión debido al aumento de citocinas, lo que pone al cerebro en un "modo de enfermedad". Los síntomas clásicos de estar físicamente enfermo, como el letargo, muestran una gran superposición en los comportamientos que caracterizan la depresión. Los niveles de citocinas tienden a aumentar considerablemente durante los episodios depresivos de las personas con trastorno bipolar y disminuyen durante la remisión.Además, se ha demostrado en ensayos clínicos que los medicamentos antiinflamatorios tomados además de los antidepresivos no solo mejoran significativamente los síntomas sino que también aumentan la proporción de sujetos que responden positivamente al tratamiento. Las inflamaciones que conducen a una depresión grave pueden ser causadas por infecciones comunes como las causadas por virus, bacterias o incluso parásitos.
Existe evidencia de un vínculo entre la inflamación y el delirio según los resultados de un estudio longitudinal reciente que investiga la PCR en pacientes con COVID-19.
Un organismo infeccioso puede escapar de los confines del tejido inmediato a través del sistema circulatorio o del sistema linfático, donde puede propagarse a otras partes del cuerpo. Si un organismo no está contenido por las acciones de la inflamación aguda, puede acceder al sistema linfático a través de los vasos linfáticos cercanos. La infección de los vasos linfáticos se conoce como linfangitis y la infección de un ganglio linfático se conoce como linfadenitis. Cuando los ganglios linfáticos no pueden destruir todos los patógenos, la infección se propaga aún más. Un patógeno puede acceder al torrente sanguíneo a través del drenaje linfático hacia el sistema circulatorio.
Cuando la inflamación abruma al huésped, se diagnostica el síndrome de respuesta inflamatoria sistémica. Cuando se debe a una infección, se aplica el término sepsis, aplicándose los términos bacteriemia específicamente a la sepsis bacteriana y viremia específicamente a la sepsis viral. La vasodilatación y la disfunción orgánica son problemas graves asociados con una infección generalizada que puede provocar un shock séptico y la muerte.
La inflamación también se caracteriza por altos niveles sistémicos de proteínas de fase aguda. En la inflamación aguda, estas proteínas resultan beneficiosas; sin embargo, en la inflamación crónica pueden contribuir a la amiloidosis. Estas proteínas incluyen la proteína C reactiva, el amiloide A sérico y el amiloide P sérico, que causan una variedad de efectos sistémicos que incluyen:
La inflamación a menudo afecta la cantidad de leucocitos presentes en el cuerpo:
Con el descubrimiento de las interleucinas (IL), se desarrolló el concepto de inflamación sistémica. Aunque los procesos involucrados son idénticos a los de la inflamación tisular, la inflamación sistémica no se limita a un tejido en particular sino que involucra el endotelio y otros sistemas de órganos.
La inflamación crónica se observa ampliamente en la obesidad. Las personas obesas comúnmente tienen muchos marcadores elevados de inflamación, que incluyen:
La inflamación crónica de bajo grado se caracteriza por un aumento de dos a tres veces en las concentraciones sistémicas de citoquinas como TNF-α, IL-6 y PCR. La circunferencia de la cintura se correlaciona significativamente con la respuesta inflamatoria sistémica.
La pérdida de tejido adiposo blanco reduce los niveles de marcadores de inflamación. La asociación de la inflamación sistémica con la resistencia a la insulina y la diabetes tipo 2 y con la aterosclerosis se encuentra bajo investigación preliminar, aunque no se han realizado ensayos clínicos rigurosos para confirmar tales relaciones.
La proteína C reactiva (PCR) se genera en un nivel más alto en personas obesas y puede aumentar el riesgo de enfermedades cardiovasculares.
El resultado en una circunstancia particular estará determinado por el tejido en el que se ha producido la lesión y el agente nocivo que la está causando. Estos son los posibles resultados de la inflamación:
La inflamación generalmente se indica agregando el sufijo "itis", como se muestra a continuación. Sin embargo, algunas condiciones, como el asma y la neumonía, no siguen esta convención. Más ejemplos están disponibles en Lista de tipos de inflamación.
 Dermatitis aguda
Dermatitis aguda Meningitis infecciosa aguda
Meningitis infecciosa aguda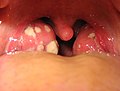 amigdalitis aguda
amigdalitis aguda