Hipoclorito
En química, hipoclorito o cloróxido es un anión con la fórmula química ClO-. Se combina con varios cationes para formar sales de hipoclorito. Los ejemplos comunes incluyen el hipoclorito de sodio (lejía doméstica) y el hipoclorito de calcio (un componente del polvo blanqueador, "cloro" para piscinas). La distancia Cl-O en ClO− es 1,69 Å.
El nombre también puede referirse a ésteres del ácido hipocloroso, es decir, compuestos orgánicos con un grupo ClO– unido covalentemente al resto de la molécula. El ejemplo principal es el hipoclorito de terc-butilo, que es un agente clorante útil.
La mayoría de las sales de hipoclorito se manipulan como soluciones acuosas. Sus principales aplicaciones son como agentes blanqueadores, desinfectantes y de tratamiento de agua. También se utilizan en química para reacciones de cloración y oxidación.
Reacciones
Reacción ácida
La acidificación de los hipocloritos genera ácido hipocloroso, que existe en equilibrio con el cloro. Un pH reducido (es decir, hacia el ácido) provoca la siguiente reacción hacia la derecha, liberando cloro gaseoso, que puede ser peligroso:
- 2 H+
+ ClO−
+ Cl−
⇌ Cl
2 + H
2O
Estabilidad
Los hipocloritos son generalmente inestables y muchos compuestos existen sólo en solución. El hipoclorito de litio LiOCl, el hipoclorito de calcio Ca(OCl)2 y el hipoclorito de bario Ba(ClO)2 se han aislado como compuestos anhidros puros. Todos son sólidos. Se pueden producir algunos más como soluciones acuosas. En general cuanto mayor sea la dilución mayor será su estabilidad. No es posible determinar las tendencias de las sales de metales alcalinotérreos, ya que muchas de ellas no se pueden formar. El hipoclorito de berilio es algo inaudito. No se puede preparar hipoclorito de magnesio puro; sin embargo, se conoce Mg(OH)OCl sólido. El hipoclorito de calcio se produce a escala industrial y tiene buena estabilidad. El hipoclorito de estroncio, Sr(OCl)2, no está bien caracterizado y aún no se ha determinado su estabilidad.
Al calentarse, el hipoclorito se degrada a una mezcla de cloruro, oxígeno y cloratos:
- 2 ClO−
→ 2 Cl−
+ O
2 - 3 ClO−
→ 2 Cl−
+ ClO−
3
Esta reacción es exotérmica y, en el caso de hipocloritos concentrados, como LiOCl y Ca(OCl)2, puede provocar una fuga térmica peligrosa y es potencialmente explosiva.
La estabilidad de los hipocloritos de metales alcalinos disminuye en el grupo. El hipoclorito de litio anhidro es estable a temperatura ambiente; sin embargo, el hipoclorito de sodio es explosivo como sólido anhidro. El pentahidrato (NaOCl·(H2O)5) es inestable por encima de 0 °C; aunque las soluciones más diluidas que se encuentran como lejía doméstica son más estables. El hipoclorito de potasio (KOCl) sólo se conoce en solución.
Los hipocloritos de lantánidos también son inestables; sin embargo, se ha informado que son más estables en sus formas anhidras que en presencia de agua. Se ha utilizado hipoclorito para oxidar el cerio desde su estado de oxidación +3 a +4.
El ácido hipocloroso en sí no es estable de forma aislada, ya que se descompone para formar cloro. Su descomposición también da como resultado alguna forma de oxígeno.
Reacciones con amoníaco
Los hipocloritos reaccionan con el amoníaco primero dando monocloramina (NH
>2Cl ), luego dicloramina (NHCl
2), y finalmente tricloruro de nitrógeno ( NCl
3).
- NH
3 + ClO−
→ HOMBRE−
+ NH
2Cl
- NH
2Cl + ClO−
→ HOMBRE−
+ NHCl
2
- NHCl
2 + ClO−
→ HOMBRE−
+ NCl
3
Preparación
Sales de hipoclorito
Sales de hipoclorito formadas por la reacción entre cloro e hidróxidos de metales alcalinos y alcalinotérreos. La reacción se realiza cerca de la temperatura ambiente para suprimir la formación de cloratos. Este proceso es ampliamente utilizado para la producción industrial de hipoclorito de sodio (NaClO) e hipoclorito de calcio (Ca(ClO)2).
- Cl2 + 2 NaOH → NaCl + NaClO + H2O
- 2 Cl2 + 2 Ca(OH)2 → CaCl2 + Ca(ClO)2 + 2 H2O
También se producen electroquímicamente grandes cantidades de hipoclorito de sodio mediante un proceso de cloro-álcali no separado. En este proceso, la salmuera se electroliza para formar Cl
2 que se disocia en agua para formar hipoclorito. Esta reacción debe realizarse en condiciones no ácidas para evitar la liberación de cloro:
- 2 Cl−
→ Cl
2 + 2 e−
- Cl
2 + H
2O ⇌ HClO + Cl−
+ H+
Algunos hipocloritos también se pueden obtener mediante una reacción de metátesis de sal entre hipoclorito de calcio y varios sulfatos metálicos. Esta reacción se realiza en agua y se basa en la formación de sulfato de calcio insoluble, que precipitará de la solución, lo que completará la reacción.
- Ca.2 + MSO4 → M(ClO)2 + CaSO4
Hipocloritos orgánicos
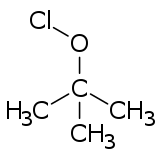
Los ésteres de hipoclorito se forman generalmente a partir de los alcoholes correspondientes, mediante tratamiento con cualquiera de varios reactivos (por ejemplo, cloro, ácido hipocloroso, monóxido de dicloro y diversas sales acidificadas de hipoclorito).
Bioquímica
Biosíntesis de compuestos organoclorados
Las cloroperoxidasas son enzimas que catalizan la cloración de compuestos orgánicos. Esta enzima combina los sustratos inorgánicos cloruro y peróxido de hidrógeno para producir el equivalente de Cl+, que reemplaza un protón en el sustrato de hidrocarburo:
- R-H + Cl− + H2O2 + H+ → R-Cl + 2 H2O
La fuente de "Cl+" es el ácido hipocloroso (HOCl). Muchos compuestos organoclorados se biosintetizan de esta forma.
Respuesta inmune
En respuesta a la infección, el sistema inmunológico humano genera cantidades diminutas de hipoclorito dentro de glóbulos blancos especiales, llamados granulocitos neutrófilos. Estos granulocitos engullen virus y bacterias en una vacuola intracelular llamada fagosoma, donde son digeridos.
Parte del mecanismo de digestión implica un estallido respiratorio mediado por enzimas, que produce compuestos reactivos derivados del oxígeno, incluido el superóxido (que es producido por la NADPH oxidasa). El superóxido se descompone en oxígeno y peróxido de hidrógeno, que se utiliza en una reacción catalizada por mieloperoxidasa para convertir el cloruro en hipoclorito.
También se descubrió que bajas concentraciones de hipoclorito interactúan con las proteínas de choque térmico de un microbio, estimulando su papel como acompañante intracelular y provocando que las bacterias formen grupos (muy parecidos a un huevo hervido) que eventualmente morirá. El mismo estudio encontró que los niveles bajos (micromolares) de hipoclorito inducen E. coli y Vibrio cholerae para activar un mecanismo protector, aunque sus implicaciones no estaban claras.
En algunos casos, la acidez básica del hipoclorito compromete la membrana lipídica de una bacteria, una reacción similar a reventar un globo.
Usos industriales y domésticos
Los hipocloritos, especialmente de sodio ("lejía líquida", "agua de jabalina") y de calcio ("blanqueador en polvo"), se utilizan ampliamente, a nivel industrial y doméstico, para blanquear la ropa, aclarar el color del cabello y quitar manchas. Fueron los primeros productos blanqueadores comerciales, desarrollados poco después de que el químico francés Claude Berthollet descubriera esa propiedad en 1785.
Los hipocloritos también se utilizan ampliamente como desinfectantes y desodorizantes de amplio espectro. Esa aplicación comenzó poco después de que el químico francés Labarraque descubriera esas propiedades, alrededor de 1820 (aún antes de que Pasteur formulara su teoría de las enfermedades de los gérmenes).
Usos de laboratorio
Como agentes oxidantes
El hipoclorito es el agente oxidante más fuerte de los oxianiones de cloro. Esto se puede ver comparando los potenciales de media celda estándar en toda la serie; Los datos también muestran que los oxianiones de cloro son oxidantes más fuertes en condiciones ácidas.
| Ion | Reacción acídica | E° (V) | Reacción neutra/básica | E° (V) |
|---|---|---|---|---|
| Hipoclorito | H+ + HOCl + e− → 1.2 Cl2()g) + H2O | 1.63 | ClO− + H2O + 2 e− → Cl− + 2OH− | 0.89 |
| Clorite | 3 H+ + HOClO + 3 e− → 1.2 Cl2()g) + 2 H2O | 1.64 | ClO− 2 + 2 H2O + 4 e− → Cl− + 4 OH− | 0,78 |
| Chlorate | 6 H+ + ClO− 3 + 5 e− → 1.2 Cl2()g) + 3 H2O | 1.47 | ClO− 3 + 3 H2O + 6 e− → Cl− + 6 OH− | 0.63 |
| Perchlorate | 8 H+ + ClO− 4 + 7 e− → 1.2 Cl2()g) + 4 H2O | 1.42 | ClO− 4 + 4 H2O + 8 e− → Cl− + 8 OH− | 0,56 |
El hipoclorito es un oxidante lo suficientemente fuerte como para convertir Mn(III) en Mn(V) durante la reacción de epoxidación de Jacobsen y para convertir Ce3+
a Ce4+
></span .
Este poder oxidante es lo que los convierte en agentes blanqueadores y desinfectantes eficaces.
En química orgánica, los hipocloritos se pueden utilizar para oxidar alcoholes primarios a ácidos carboxílicos.
Como agentes clorantes
Las sales de hipoclorito también pueden servir como agentes clorantes. Por ejemplo, convierten los fenoles en clorofenoles. El hipoclorito de calcio convierte la piperidina en N-cloropiperidina.
Oxianiones relacionados
El cloro puede ser el núcleo de oxianiones con estados de oxidación de −1, +1, +3, +5 o +7. (El elemento también puede asumir un estado de oxidación de +4, como se observa en el compuesto neutro dióxido de cloro ClO2).
| Estado de oxidación cloro | −1 | + 1 | +3 | +5 | +7 |
|---|---|---|---|---|---|
| Nombre | cloruro | hipoclorito | clorito | clorado | perclorado |
| Formula | Cl− | ClO− | ClO− 2 | ClO− 3 | ClO− 4 |
| Estructura |  |  |  |
Contenido relacionado
Ley de Fick
Miscibilidad
Masa molar
Ley de las proporciones múltiples
Anilina