Glicina
La glicina (símbolo Gly o G) es un aminoácido que tiene un solo átomo de hidrógeno como cadena lateral. Es el aminoácido estable más simple (el ácido carbámico es inestable), con la fórmula química NH 2 -CH 2 -COOH. La glicina es uno de los aminoácidos proteinogénicos. Está codificado por todos los codones que comienzan con GG (GGU, GGC, GGA, GGG). La glicina es parte integral de la formación de hélices alfa en la estructura proteica secundaria debido a su forma compacta. Por la misma razón, es el aminoácido más abundante en las triples hélices de colágeno. La glicina también es un neurotransmisor inhibidor: la interferencia con su liberación dentro de la médula espinal (como durante una infección por Clostridium tetani) puede causar parálisis espástica debido a la contracción muscular desinhibida.
Es el único aminoácido proteinogénico aquiral. Puede encajar en ambientes hidrofílicos o hidrofóbicos, debido a su cadena lateral mínima de un solo átomo de hidrógeno.
Historia y etimología
La glicina fue descubierta en 1820 por el químico francés Henri Braconnot cuando hidrolizó gelatina hirviéndola con ácido sulfúrico. Originalmente lo llamó "azúcar de gelatina", pero el químico francés Jean-Baptiste Boussingault demostró que contenía nitrógeno. El científico estadounidense Eben Norton Horsford, entonces alumno del químico alemán Justus von Liebig, propuso el nombre "glicocoll"; sin embargo, el químico sueco Berzelius sugirió el nombre más simple "glicina". El nombre proviene de la palabra griega γλυκύς "sabor dulce" (que también está relacionado con los prefijos glico- y gluco-, como glicoproteína y glucosa).). En 1858, el químico francés Auguste Cahours determinó que la glicina era una amina del ácido acético.
Producción
Aunque la glicina se puede aislar de la proteína hidrolizada, esta no se usa para la producción industrial, ya que se puede fabricar de manera más conveniente mediante síntesis química. Los dos procesos principales son la aminación del ácido cloroacético con amoníaco, dando glicina y cloruro de amonio, y la síntesis de aminoácidos de Strecker, que es el principal método de síntesis en los Estados Unidos y Japón. Anualmente se producen unas 15 mil toneladas de esta forma.
La glicina también se cogenera como impureza en la síntesis de EDTA, que surge de las reacciones del coproducto amoníaco.
Reacciones químicas
Sus propiedades ácido-base son las más importantes. En solución acuosa, la glicina es anfótera: por debajo de pH = 2,4, se convierte en el catión de amonio llamado glicinio. Por encima de 9,6, se convierte en glicinato.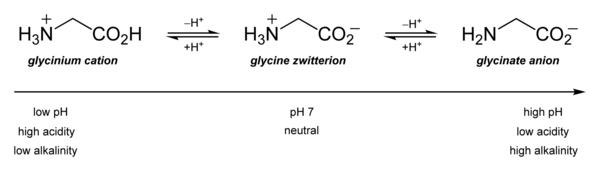
La glicina funciona como un ligando bidentado para muchos iones metálicos, formando complejos de aminoácidos. Un complejo típico es Cu(glicinato) 2, es decir, Cu(H 2 NCH 2 CO 2) 2, que existe tanto en isómeros cis como trans.
Con cloruros de ácido, la glicina se convierte en ácido amidocarboxílico, como el ácido hipúrico y la acetilglicina. Con ácido nitroso se obtiene ácido glicólico (determinación de van Slyke). Con yoduro de metilo, la amina se cuaterniza para dar trimetilglicina, un producto natural:H3norteCH2ARRULLO+ 3 CH 3 I → (CH3)3norteCH2ARRULLO + 3 hola
La glicina se condensa consigo misma para dar péptidos, comenzando con la formación de glicilglicina:2 horas3norteCH2ARRULLO → H3norteCH2CONHCH2ARRULLO + H2O _
La pirólisis de glicina o glicilglicina da 2,5-dicetopiperazina, la diamida cíclica.
Forma ésteres con alcoholes. A menudo se aíslan como su clorhidrato, por ejemplo, clorhidrato de éster metílico de glicina. De lo contrario, el éster libre tiende a convertirse en dicetopiperazina.
Como molécula bifuncional, la glicina reacciona con muchos reactivos. Estas se pueden clasificar en reacciones centradas en N y centradas en carboxilato.
Metabolismo
Biosíntesis
La glicina no es esencial para la dieta humana, ya que se biosintetiza en el cuerpo a partir del aminoácido serina, que a su vez se deriva del 3-fosfoglicerato, pero la capacidad metabólica para la biosíntesis de glicina no satisface la necesidad de síntesis de colágeno. En la mayoría de los organismos, la enzima serina hidroximetiltransferasa cataliza esta transformación a través del cofactor piridoxal fosfato:serina + tetrahidrofolato → glicina + N, N -metileno tetrahidrofolato + H 2 O
En el hígado de los vertebrados, la glicina sintasa (también llamada enzima de escisión de glicina) cataliza la síntesis de glicina. Esta conversión es fácilmente reversible:CO2 + NH4+ N, N -metileno tetrahidrofolato + NADH + H ⇌ Glicina + tetrahidrofolato + NAD
Además de sintetizarse a partir de la serina, la glicina también puede derivarse de la treonina, la colina o la hidroxiprolina a través del metabolismo interorgánico del hígado y los riñones.
Degradación
La glicina se degrada a través de tres vías. La vía predominante en animales y plantas es la inversa de la vía de la glicina sintasa mencionada anteriormente. En este contexto, el sistema enzimático implicado suele denominarse sistema de escisión de glicina:Glicina + tetrahidrofolato + NAD ⇌ CO 2 + NH4+ N, N -metileno tetrahidrofolato + NADH + H
En la segunda ruta, la glicina se degrada en dos pasos. El primer paso es el reverso de la biosíntesis de glicina a partir de serina con serina hidroximetil transferasa. La serina luego se convierte en piruvato por la serina deshidratasa.
En la tercera vía de su degradación, la glicina se convierte en glioxilato por la D-aminoácido oxidasa. Luego, el glioxilato es oxidado por la lactato deshidrogenasa hepática a oxalato en una reacción dependiente de NAD.
La vida media de la glicina y su eliminación del cuerpo varía significativamente según la dosis. En un estudio, la vida media varió entre 0,5 y 4,0 horas.
La glicina es extremadamente sensible a los antibióticos que se dirigen al folato, y los niveles de glicina en la sangre caen severamente al minuto de las inyecciones de antibióticos. Algunos antibióticos pueden agotar más del 90 % de la glicina a los pocos minutos de ser administrados.
Función fisiológica
La función principal de la glicina es actuar como precursor de las proteínas. La mayoría de las proteínas incorporan solo pequeñas cantidades de glicina, con una excepción notable del colágeno, que contiene aproximadamente un 35 % de glicina debido a su papel periódicamente repetido en la formación de la estructura helicoidal del colágeno junto con la hidroxiprolina. En el código genético, la glicina está codificada por todos los codones que comienzan con GG, es decir, GGU, GGC, GGA y GGG.
Como intermedio biosintético
En eucariotas superiores, el ácido δ-aminolevulínico, el precursor clave de las porfirinas, es biosintetizado a partir de glicina y succinil-CoA por la enzima ALA sintasa. La glicina proporciona la subunidad central C 2 N de todas las purinas.
Como neurotransmisor
La glicina es un neurotransmisor inhibitorio en el sistema nervioso central, especialmente en la médula espinal, el tronco encefálico y la retina. Cuando se activan los receptores de glicina, el cloruro ingresa a la neurona a través de los receptores ionotrópicos, lo que provoca un potencial postsináptico inhibitorio (IPSP). La estricnina es un fuerte antagonista de los receptores ionotrópicos de glicina, mientras que la bicuculina es débil. La glicina es un coagonista requerido junto con el glutamato para los receptores NMDA. En contraste con el papel inhibidor de la glicina en la médula espinal, este comportamiento se facilita en los receptores glutamatérgicos (NMDA) que son excitatorios. La LD 50 de la glicina es de 7930 mg/kg en ratas (oral), y suele provocar la muerte por hiperexcitabilidad.
Usos
En los EE. UU., la glicina generalmente se vende en dos grados: Farmacopea de los Estados Unidos ("USP") y grado técnico. Las ventas de grado USP representan aproximadamente del 80 al 85 por ciento del mercado estadounidense de glicina. Si se necesita una pureza mayor que el estándar de la USP, por ejemplo, para inyecciones intravenosas, se puede usar una glicina de grado farmacéutico más costosa. La glicina de grado técnico, que puede o no cumplir con los estándares de grado de la USP, se vende a un precio más bajo para su uso en aplicaciones industriales, por ejemplo, como agente en el complejo y acabado de metales.
Alimentos animales y humanos
La glicina no se usa mucho en alimentos por su valor nutritivo, excepto en infusiones. En cambio, el papel de la glicina en la química de los alimentos es como saborizante. Es ligeramente dulce y contrarresta el regusto a sacarina. También tiene propiedades conservantes, quizás debido a su formación de complejos con iones metálicos. Los complejos de glicinato de metal, por ejemplo, glicinato de cobre (II), se utilizan como suplementos para alimentos para animales.
Materia prima química
La glicina es un intermediario en la síntesis de una variedad de productos químicos. Se utiliza en la fabricación de los herbicidas glifosato, iprodiona, glifosina, imiprotrina y eglinazina. Se utiliza como intermediario de medicamentos como el tiamfenicol.
Investigación de laboratorio
La glicina es un componente importante de algunas soluciones utilizadas en el método de análisis de proteínas SDS-PAGE. Sirve como agente amortiguador, manteniendo el pH y evitando daños en la muestra durante la electroforesis. La glicina también se usa para eliminar los anticuerpos que marcan proteínas de las membranas de transferencia Western para permitir el sondeo de numerosas proteínas de interés del gel SDS-PAGE. Esto permite extraer más datos de la misma muestra, aumentando la confiabilidad de los datos, reduciendo la cantidad de procesamiento de muestras y la cantidad de muestras requeridas. Este proceso se conoce como decapado.
Presencia en el espacio
La presencia de glicina fuera de la Tierra se confirmó en 2009, en base al análisis de muestras que habían sido tomadas en 2004 por la nave espacial de la NASA Stardust del cometa Wild 2 y que posteriormente regresaron a la Tierra. La glicina se había identificado previamente en el meteorito Murchison en 1970. El descubrimiento de glicina en el espacio exterior reforzó la hipótesis de la llamada panspermia blanda, que afirma que los "bloques de construcción" de la vida están muy extendidos por todo el universo. En 2016, se anunció la detección de glicina dentro del cometa 67P/Churyumov-Gerasimenko por parte de la nave espacial Rosetta.
Se ha debatido la detección de glicina fuera del Sistema Solar en el medio interestelar. En 2008, el Instituto Max Planck de Radioastronomía descubrió las líneas espectrales de un precursor de glicina (aminoacetonitrilo) en la Gran Molécula Heimat, una nube de gas gigante cerca del centro galáctico en la constelación de Sagitario.
Evolución
Varios estudios evolutivos independientes que utilizan diferentes tipos de datos han sugerido que la glicina pertenece a un grupo de aminoácidos que constituyeron el código genético primitivo. Por ejemplo, las regiones de baja complejidad (en las proteínas), que pueden parecerse a los protopéptidos del código genético primitivo, están muy enriquecidas en glicina.
Presencia en alimentos
| Alimento | g/100 g |
|---|---|
| Snacks, pieles de cerdo | 11.04 |
| Harina de semillas de sésamo (baja en grasa) | 3.43 |
| Bebidas, proteína en polvo (a base de soja) | 2.37 |
| Semillas, harina de semilla de cártamo, parcialmente desgrasadas | 2.22 |
| Carne, bisonte, vacuno y otros (varias partes) | 1.5-2.0 |
| postres de gelatina | 1.96 |
| Semillas, semillas de calabaza y calabaza | 1.82 |
| Pavo, todas las clases, lomo, carne y piel | 1.79 |
| Pollo, asados o fritos, carne y piel | 1.74 |
| Carne de cerdo, molida, 96 % magra/4 % de grasa, cocida, desmoronada | 1.71 |
| Palitos de tocino y carne de res | 1.64 |
| Miseria | 1.63 |
| Crustáceos, langosta espinosa | 1.59 |
| Especias, semilla de mostaza, molida | 1.59 |
| Salami | 1.55 |
| Nueces, nueces, secas | 1.51 |
| Pescado, salmón, rosado, enlatado, sólidos escurridos | 1.42 |
| Almendras | 1.42 |
| pescado, caballa | 0.93 |
| Cereales listos para comer, granola, caseros | 0.81 |
| Puerros (bulbo y parte inferior de la hoja), liofilizados | 0.7 |
| Queso, parmesano (y otros), rallado | 0,56 |
| Soja, verde, cocida, hervida, escurrida, sin sal | 0.51 |
| Pan, proteína (incluye gluten) | 0.47 |
| Huevo, entero, cocido, frito | 0.47 |
| Frijoles, blancos, semillas maduras, cocidos, hervidos, con sal | 0.38 |
| Lentejas, semillas maduras, cocidas, hervidas, con sal | 0.37 |
Contenido relacionado
Activadores de enzimas
Dispersión biológica
Fenética