Éter sililico

Los éteres silílicos son un grupo de compuestos químicos que contienen un átomo de silicio unido covalentemente a un grupo alcoxi. La estructura general es R1R2R3Si−O−R4 donde R4 es un grupo alquilo o un grupo arilo. Los silil éteres se utilizan habitualmente como grupos protectores de alcoholes en síntesis orgánica. Dado que R1R2R3 pueden ser combinaciones de diferentes grupos que pueden variarse para proporcionar una cantidad de éteres sililo, este grupo de compuestos químicos proporciona un amplio espectro de selectividad para proteger la química del grupo. Los éteres silílicos comunes son: trimetilsililo (TMS), terc-butildifenilsililo (TBDPS), terc-butildimetilsililo (TBS/TBDMS) y triisopropilsililo (CONSEJOS). Son particularmente útiles porque pueden instalarse y retirarse de forma muy selectiva en condiciones suaves.
Éteres silílicos comunes
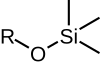 |  |  |  | 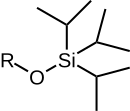 |
| TMS | TES | TBS/TBDMS | TBDPS | TIPS |
| Trimethylsilyl ether | Triethylsilyl ether | tert-Butyldimethylsilyl ether | tert-Butyldiphenylsilyl ether | Triisopropylsilyl ether |
Formación
Comúnmente la sililación de alcoholes requiere un cloruro de sililo y una base de amina. Un procedimiento confiable y rápido es el protocolo de Corey en el que el alcohol se hace reaccionar con cloruro de sililo e imidazol en alta concentración en DMF. Si se sustituye el DMF por diclorometano, la reacción es algo más lenta, pero se simplifica la purificación del compuesto. Una base impedida común para usar con triflatos de sililo es la 2,6-lutidina. Los alcoholes primarios se pueden proteger en menos de una hora, mientras que algunos alcoholes impedidos pueden requerir días de tiempo de reacción.
Cuando se utiliza cloruro de sililo, normalmente no se requieren precauciones especiales, excepto la exclusión de grandes cantidades de agua. Puede emplearse un exceso de cloruro de sililo pero no es necesario. Si se utiliza un exceso de reactivo, el producto requerirá cromatografía ultrarrápida para eliminar el exceso de silanol y siloxano.
A veces se utilizan triflato de sililo y una base de amina impedida. Los triflatos de sililo son más reactivos que sus correspondientes cloruros, por lo que pueden usarse para instalar grupos sililo en posiciones impedidas. El triflato de sililo es más reactivo y también convierte las cetonas en éteres de sililo enol. Los triflatos de sililo son sensibles al agua y deben funcionar en condiciones de atmósfera inerte. La purificación implica la adición de un ácido acuoso como una solución saturada de cloruro de amonio. El agua apaga el reactivo de sililo restante y protona las bases de amina antes de su eliminación de la mezcla de reacción. Después de la extracción, el producto puede purificarse mediante cromatografía ultrarrápida.
Las cetonas reaccionan con los hidrosilanos en presencia de catalizadores metálicos.
Eliminación
La reacción con ácidos o fluoruros como el fluoruro de tetra-n-butilamonio elimina el grupo sililo cuando ya no se necesita protección. Los sustituyentes más grandes aumentan la resistencia a la hidrólisis, pero también dificultan la introducción del grupo sililo.
En medios ácidos, la resistencia relativa es:
- TMS (1) 0 0 TES (64) 0 TBS (20 000)
En medios básicos, la resistencia relativa es:
- TMS (1) 0 TES (10-100)
Monoprotección de dioles simétricos
Es posible monosilar un diol simétrico, aunque se sabe que esto resulta problemático ocasionalmente. Por ejemplo, se informó la siguiente monosililación:
Sin embargo, resulta que esta reacción es difícil de repetir. Si la reacción estuviera controlada únicamente por termodinámica, y si el dianión tuviera una reactividad similar a la del monoanión, entonces se esperaría una mezcla estadística correspondiente de diol disililado:monosililado:no sililado 1:2:1. Sin embargo, la reacción en THF se vuelve selectiva por dos factores: 1. desprotonación cinética del primer anión y 2. la insolubilidad del monoanión. En la adición inicial de TBSCl, solo hay una pequeña cantidad de monoanión en solución y el resto en suspensión. Esta pequeña porción reacciona y cambia el equilibrio del monoanión para atraer más a la solución, permitiendo así obtener altos rendimientos del compuesto mono-TBS. En algunos casos se pueden obtener resultados superiores con butillitio:
Un tercer método utiliza una mezcla de DMF y DIPEA.
Como alternativa, se puede utilizar un exceso (4 eq) del diol, forzando la reacción hacia la monoprotección.
Desprotección selectiva
En muchos casos es posible la desprotección selectiva de los grupos sililo. Por ejemplo, en la síntesis de taxol:
Los éteres sililicos se diferencian principalmente en función de sus componentes estéricos o electrónicos. En general, las desprotecciones ácidas desprotegen los grupos sililo menos impedidos más rápido, siendo el volumen estérico del silicio más significativo que el volumen estérico del oxígeno. Las desprotecciones basadas en fluoruro desprotegen los grupos sililo pobres en electrones más rápidamente que los grupos sililo ricos en electrones. Existe cierta evidencia de que algunas desprotecciones de sililo se realizan a través de especies de silicio hipervalentes.
La desprotección selectiva de los éteres silílicos se ha revisado exhaustivamente. Aunque se han logrado desprotecciones selectivas en muchas condiciones diferentes, algunos procedimientos, que se describen a continuación, son más fiables. Es probable que una desprotección selectiva tenga éxito si hay una diferencia sustancial en los estéricos (por ejemplo, TBS primario frente a TBS secundario o TES primario frente a TBS primario) o electrónicos (por ejemplo, TBDPS primario frente a TBS primario). Desafortunadamente, inevitablemente se requiere cierta optimización y, a menudo, es necesario ejecutar desprotecciones parcialmente y reciclar material.
- Algunas afecciones ácidos comunes
- 100 mol% 10-CSA (ácido camphorsulfónico) en MeOH, temperatura ambiente; un "blast" de ácido, desprotege los grupos primarios de TBS en diez minutos.
- 10 mol% 10-CSA, 1:1 MeOH:DCM, −20 o 0 °C; deprotege un grupo primario de TBS dentro de dos horas a 0; si CSA es reemplazada por PPTS, la tasa es aproximadamente diez veces más lenta; con p-TsOH, aproximadamente diez veces más rápido; la mezcla de solvente es crucial.
- 4:1:1 v/v/v AcOH:THF:water, room temp.; esto es muy lento, pero puede ser muy selectivo.
- Algunas condiciones básicas comunes
- HF-pyridine, 10:1 THF:pyridine, 0 °C; una desprotección excelente; elimina los grupos primarios de TBS dentro de ocho horas; las reacciones usando HF deben ser ejecutadas en contenedores de plástico.
- Los grupos TBAF, THF o 1:1 TBAF/AcOH, THF; TBDPS y TBS pueden ser desprotegidos en presencia de otros en diferentes condiciones.
Aplicación
Contenido relacionado
Ley de Fick
Miscibilidad
Masa molar
Ley de las proporciones múltiples
Anilina
