Enfermedad de Lyme
La enfermedad de Lyme, también conocida como borreliosis de Lyme, es una enfermedad transmitida por vectores causada por la bacteria Borrelia, que se propaga por las garrapatas en el género Ixodes. El signo más común de infección es una erupción roja en expansión, conocida como eritema migratorio (EM), que aparece en el sitio de la picadura de la garrapata aproximadamente una semana después. La erupción generalmente no produce picazón ni dolor. Aproximadamente el 70-80% de las personas infectadas desarrollan una erupción. El diagnóstico temprano puede ser difícil. Otros síntomas tempranos pueden incluir fiebre, dolores de cabeza y cansancio. Si no se trata, los síntomas pueden incluir pérdida de la capacidad de mover uno o ambos lados de la cara, dolores en las articulaciones, dolores de cabeza intensos con rigidez en el cuello o palpitaciones del corazón. Meses o años después, pueden ocurrir episodios repetidos de dolor e inflamación en las articulaciones. Ocasionalmente, se pueden desarrollar dolores punzantes u hormigueo en los brazos y las piernas. A pesar del tratamiento adecuado, alrededor del 10 al 20% de los afectados desarrollan dolores en las articulaciones, problemas de memoria y cansancio durante al menos seis meses.
La enfermedad de Lyme se transmite a los humanos por la picadura de garrapatas infectadas del género Ixodes. En los Estados Unidos, las garrapatas de interés suelen ser del tipo Ixodes scapularis y deben permanecer adheridas durante al menos 24 horas antes de que la bacteria pueda propagarse. En Europa, las garrapatas Ixodes ricinus pueden propagar la bacteria más rápidamente. En América del Norte, las especies bacterianas Borrelia burgdorferi y B. mayonii causan la enfermedad de Lyme. En Europa y Asia, Borrelia afzelii, Borrelia garinii, B. spielmanii y otras cuatro especies también causan la enfermedad. La enfermedad no parece ser transmisible entre personas, por otros animales ni a través de los alimentos. El diagnóstico se basa en una combinación de síntomas, antecedentes de exposición a garrapatas y posiblemente pruebas de anticuerpos específicos en la sangre. Los análisis de sangre a menudo son falsos negativos en las primeras etapas de la enfermedad. La prueba de garrapatas individuales no suele ser útil.
La prevención incluye esfuerzos para prevenir las picaduras de garrapatas usando ropa que cubra los brazos y las piernas y usando DEET o repelentes de insectos a base de picaridina. El uso de pesticidas para reducir el número de garrapatas también puede ser efectivo. Las garrapatas se pueden quitar con pinzas. Si la garrapata extraída está llena de sangre, se puede usar una sola dosis de doxiciclina para prevenir el desarrollo de la infección, pero generalmente no se recomienda ya que el desarrollo de la infección es raro. Si se desarrolla una infección, varios antibióticos son efectivos, como la doxiciclina, la amoxicilina y la cefuroxima. El tratamiento estándar suele durar dos o tres semanas. Algunas personas desarrollan fiebre y dolores musculares y articulares a causa del tratamiento, que pueden durar uno o dos días. En aquellos que desarrollan síntomas persistentes, no se ha encontrado que la terapia con antibióticos a largo plazo sea útil.
La enfermedad de Lyme es la enfermedad más común transmitida por garrapatas en el hemisferio norte. Las infecciones son más comunes en la primavera y principios del verano. La enfermedad de Lyme fue diagnosticada como una condición separada por primera vez en 1975 en Lyme, Connecticut. Originalmente se confundió con la artritis reumatoide juvenil. La bacteria involucrada fue descrita por primera vez en 1981 por Willy Burgdorfer. Los síntomas crónicos posteriores al tratamiento se conocen como "síndrome de la enfermedad de Lyme posterior al tratamiento" (PTLDS). PTLDS es diferente de la enfermedad de Lyme crónica, un término que los científicos ya no respaldan y que los diferentes grupos usan de diferentes maneras. Algunos proveedores de atención médica afirman que el PTLDS es causado por una infección persistente, pero se cree que esto no es cierto porque no se puede encontrar evidencia de infección persistente después del tratamiento estándar.
A partir de 2023, se estaban realizando ensayos clínicos de las vacunas humanas propuestas para la enfermedad de Lyme, pero no había ninguna vacuna disponible. Se produjo una vacuna, LYMERix, pero se suspendió en 2002 debido a una demanda insuficiente. Existen varias vacunas para la prevención de la enfermedad de Lyme en perros.
Signos y síntomas
Lyme puede afectar varios sistemas corporales y producir una amplia gama de síntomas. No todas las personas con enfermedad de Lyme tienen todos los síntomas y muchos de los síntomas no son específicos de la enfermedad de Lyme, pero también pueden ocurrir con otras enfermedades.
El período de incubación desde la infección hasta el inicio de los síntomas suele ser de una a dos semanas, pero puede ser mucho más corto (días) o mucho más largo (meses o años). Los síntomas de Lyme a menudo ocurren de mayo a septiembre en el hemisferio norte porque la etapa ninfal de la garrapata es responsable de la mayoría de los casos. Existe una infección asintomática, pero ocurre en menos del 7% de las personas infectadas en los Estados Unidos. La infección asintomática puede ser mucho más común entre los infectados en Europa.
Infección localizada temprana
La infección temprana y localizada puede ocurrir cuando la infección aún no se ha propagado por todo el cuerpo. Solo el sitio donde la infección ha entrado en contacto con la piel se ve afectada. El signo inicial de aproximadamente el 80% de las infecciones de Lyme es una erupción eritema migrans (EM) en el sitio de una picadura de garrapata, a menudo cerca de pliegues de la piel como la axila, la ingle o la parte posterior de la rodilla, en el tronco, debajo de las correas de la ropa, o en el cabello, las orejas o el cuello de los niños. La mayoría de las personas que se infectan no recuerdan haber visto una garrapata o un mordisco. La erupción aparece típicamente una o dos semanas (rango de 3 a 32 días) después de la mordida y se expande de 2 a 3 cm por día hasta un diámetro de 5–70 cm (mediana de 16 cm). La erupción suele ser circular u ovalada, roja o azulada, y puede tener un centro elevado o más oscuro. En aproximadamente el 79% de los casos en Europa, pero solo el 19% de los casos en áreas endémicas de los EE. UU., La erupción se despeja gradualmente del centro hacia los bordes, posiblemente formando un ojo de bull ' sys " patrón. La erupción puede sentirse cálida, pero generalmente no tiene picazón, rara vez es tierna o dolorosa, y tarda hasta cuatro semanas en resolverse si no se trata.
La erupción EM a menudo va acompañada de síntomas de una enfermedad viral, que incluye fatiga, dolor de cabeza, dolores corporales, fiebre y escalofríos, pero generalmente no náuseas o problemas de respiración superior. Estos síntomas también pueden aparecer sin una erupción o permanecer después de que la erupción ha desaparecido. Lyme puede progresar a etapas posteriores sin estos síntomas o una erupción.
Las personas con fiebre alta durante más de dos días o cuyos otros síntomas de enfermedad viral no mejoran a pesar del tratamiento con antibióticos para la enfermedad de Lyme, o que tienen niveles anormalmente bajos de blanco o glóbulos rojos o plaquetas en la sangre, deben ser Investigado para una posible coinfección con otras enfermedades transmitidas por garrapatas como la ehrlichiosis y la babesiosis.
Infección diseminada temprana
Dentro de los días a las semanas posteriores al inicio de la infección local, las bacterias Borrelia pueden propagarse a través del sistema linfático o el torrente sanguíneo. En el 10-20% de los casos no tratados, las erupciones EM se desarrollan en sitios de todo el cuerpo que no tienen relación con la picadura de garrapata original. Los dolores musculares transitorios y los dolores articulares también son comunes.
En aproximadamente el 10-15% de las personas no tratadas, Lyme causa problemas neurológicos conocidos como neuroborreliosis. La neuroborreliosis temprana generalmente aparece de 4 a 6 semanas (rango de 1 a 12 semanas) después de la picadura de garrapatas e implica alguna combinación de meningitis linfocítica, neuritis craneal, radiculopatía y/o mononeuritis multiplex. fiebre baja. Después de varios meses, la neuroborreliosis también puede presentar síntomas otorrinolaringológicos. Hasta el 76.5% de ellos presentes como tinnitus, el síntoma más común. El vértigo y los mareos (53.7%) y la pérdida auditiva (16.7%) fueron los siguientes síntomas más comunes. En los niños también puede ocurrir pérdida de visión parcial. La neuritis craneal es una inflamación de los nervios craneales. Cuando se debe a Lyme, más típicamente causa parálisis facial, que perjudica parpadeando, sonriendo y masticando uno o ambos lados de la cara. También puede causar visión doble intermitente. La radiculopatía de Lyme es una inflamación de las raíces del nervio espinal que a menudo causa dolor y menos a menudo debilidad, entumecimiento o sensación alterada en las áreas del cuerpo servidas por nervios conectados a las raíces afectadas, p. Ej. miembro (s) o parte (s) de tronco. El dolor a menudo se describe como a diferencia de cualquier otro sentido previamente, insoportable, migrando, peor por la noche, rara vez simétrico y a menudo acompañado de trastornos extremas del sueño. Mononeuritis Multiplex es una inflamación que causa síntomas similares en uno o más nervios periféricos no relacionados. En raras ocasiones, la neuroborreliosis temprana puede implicar la inflamación del cerebro o la médula espinal, con síntomas como confusión, marcha anormal, movimientos oculares o discurso, movimiento deteriorado, planificación motora deteriorada o agitación.
En América del Norte, la parálisis facial es la presentación típica de neuroborreliosis temprana, que ocurre en 5-10% de las personas no tratadas, en aproximadamente el 75% de los casos acompañados de meningitis linfocítica. La radiculopatía de Lyme se informa la mitad de frecuencia, pero muchos casos pueden no ser reconocidos. En los adultos europeos, la presentación más común es una combinación de meningitis linfocítica y radiculopatía conocida como síndrome de Bannwarth, acompañada en el 36-89% de los casos por parálisis facial. En este síndrome, el dolor radicular tiende a comenzar en la misma región del cuerpo que el eritema inicial erupción migrans, si hubiera una, y precede a una posible parálisis facial y otro movimiento deteriorado. En casos extremos, puede ocurrir un deterioro permanente de la función motor o sensorial de las extremidades inferiores. En los niños europeos, las manifestaciones más comunes son la parálisis facial (en 55%), otra neuritis craneal y meningitis linfocítica (en el 27%).
en aproximadamente 4–10% de los casos no tratados en los EE. UU. Y 0.3–4% de los casos no tratados en Europa, típicamente entre junio Y diciembre, aproximadamente un mes (rango 4 días-7 meses) después de la picadura de garrapata, la infección puede causar complicaciones cardíacas conocidas como carditis de Lyme. Los síntomas pueden incluir palpitaciones cardíacas (en el 69% de las personas), mareos, desmayos, falta de aliento y dolor en el pecho. También pueden estar presentes otros síntomas de la enfermedad de Lyme, como la erupción emergente, dolores articulares, parálisis facial, dolores de cabeza o dolor radicular. En algunas personas, sin embargo, la carditis puede ser la primera manifestación de la enfermedad de Lyme. La carditis de Lyme en 19-87% de las personas afecta negativamente el sistema de conducción eléctrica del corazón, causando un bloqueo auricricular que a menudo se manifiesta como ritmos cardíacos que se alternan en cuestión de minutos entre anormalmente lento y anormalmente rápido. En el 10-15% de las personas, Lyme causa complicaciones miocárdicas como cardiomegalia, disfunción ventricular izquierda o insuficiencia cardíaca congestiva.
Otra condición de la piel, que se encuentra en Europa pero no en América del Norte, es el linfocitoma borrelial, un bulto púrpura que se desarrolla en el lóbulo del oído, el pezón o el escroto.
Infección diseminada tardía
La artritis de Lyme ocurre en hasta el 60 % de las personas que no reciben tratamiento, y generalmente comienza unos seis meses después de la infección. Por lo general, afecta solo una o algunas articulaciones, a menudo una rodilla o posiblemente la cadera, otras articulaciones grandes o la articulación temporomandibular. Por lo general, se produce un gran derrame articular e inflamación, pero solo dolor leve o moderado. Sin tratamiento, la hinchazón y el dolor generalmente se resuelven con el tiempo, pero regresan periódicamente. Los quistes de Baker pueden formarse y romperse.
En los primeros estudios estadounidenses sobre la enfermedad de Lyme, se describió una neuropatía periférica rara que incluía entumecimiento, hormigueo o ardor que comenzaba en los pies o las manos y, con el tiempo, posiblemente subía por las extremidades. En un análisis posterior que descubrió documentación deficiente de esta manifestación, los expertos se preguntaron si existe en los EE. UU. o simplemente es muy raro.
Un síndrome neurológico llamado encefalopatía de Lyme se asocia con dificultades cognitivas y de memoria sutiles, insomnio, una sensación general de malestar y cambios en la personalidad. La encefalopatía de Lyme es controvertida en los EE. UU. y no se ha informado en Europa. Problemas como la depresión y la fibromialgia son tan comunes en las personas con la enfermedad de Lyme como en la población general. No hay pruebas convincentes de que la enfermedad de Lyme cause trastornos psiquiátricos, trastornos del comportamiento (p. ej., TDAH) o trastornos del desarrollo (p. ej., autismo).
La acrodermatitis crónica atrófica es un trastorno crónico de la piel que se observa principalmente en Europa entre los ancianos. Comienza como una mancha azul rojiza de piel descolorida, a menudo en el dorso de las manos o los pies. La lesión se atrofia lentamente durante varias semanas o meses, y la piel se vuelve primero delgada y arrugada y luego, si no se trata, completamente seca y sin vello. También se asocia con neuropatía periférica.
Causa
La enfermedad de Lyme es causada por espiroquetas, bacterias espirales del género Borrelia. Las espiroquetas están rodeadas de peptidoglicano y flagelos, junto con una membrana externa similar a las bacterias Gram-negativas. Debido a su envoltura de doble membrana, las bacterias Borrelia a menudo se describen erróneamente como Gram negativas a pesar de las diferencias considerables en los componentes de su envoltura con respecto a las bacterias Gram negativas. Las especies de Borrelia relacionadas con Lyme se conocen colectivamente como Borrelia burgdorferi sensu lato y muestran una gran diversidad genética.
B. burgdorferi sensu lato es un complejo de especies compuesto por 20 genoespecies aceptadas y tres propuestas. Se sabe que ocho especies causan la enfermedad de Lyme: B. mayonii (que se encuentra en América del Norte), B. burgdorferi sensu stricto (que se encuentra en América del Norte y Europa), B. afzelii, B. garinii, B. spielmanii, y B. lusitaniae (todos encontrados en Eurasia). Algunos estudios también han propuesto que B. valaisiana a veces puede infectar a los humanos, pero esta especie no parece ser una causa importante de enfermedad.
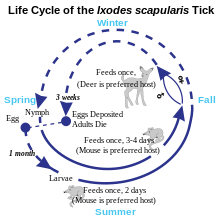
Ciclo de vida de las garrapatas
Hay tres etapas en el ciclo de vida de una garrapata: larva, ninfa y adulto. Durante la etapa de ninfa, las garrapatas transmiten con mayor frecuencia la enfermedad de Lyme y, por lo general, son más activas a fines de la primavera y principios del verano en regiones donde el clima es templado. Durante la etapa adulta, la transmisión de la enfermedad de Lyme es menos común porque es menos probable que las garrapatas adultas piquen a los humanos y tienden a ser de mayor tamaño, por lo que se pueden ver y eliminar fácilmente.
Transmisión
La enfermedad de Lyme se clasifica como una zoonosis, ya que se transmite a los humanos desde un reservorio natural entre pequeños mamíferos y aves a través de garrapatas que se alimentan de ambos conjuntos de huéspedes. Las garrapatas de cuerpo duro del género Ixodes son los vectores de la enfermedad de Lyme (también el vector de Babesia). La mayoría de las infecciones son causadas por garrapatas en la etapa de ninfa, ya que son muy pequeñas, por lo que pueden alimentarse durante largos períodos de tiempo sin ser detectadas. Las garrapatas ninfas son generalmente del tamaño de una semilla de amapola y, a veces, tienen una cabeza oscura y un cuerpo translúcido. O bien, las garrapatas ninfales pueden ser más oscuras. Las larvas de garrapatas más jóvenes rara vez se infectan. Aunque los ciervos son los huéspedes preferidos de las garrapatas adultas de los ciervos, y las poblaciones de garrapatas son mucho menores en ausencia de los ciervos, las garrapatas generalmente no adquieren Borrelia de los ciervos, sino que las obtienen de pequeños mamíferos infectados como el ratón de patas blancas y ocasionalmente pájaros. Las áreas donde Lyme es común se están expandiendo.
Dentro del intestino medio de la garrapata, la proteína A de la superficie externa de Borrelia' (OspA) se une al receptor de garrapatas para OspA, conocido como TROSPA. Cuando la garrapata se alimenta, Borrelia regula a la baja OspA y aumenta OspC, otra proteína de superficie. Después de que la bacteria migre del intestino medio a las glándulas salivales, OspC se une a Salp15, una proteína salival de garrapata que parece tener efectos inmunosupresores que aumentan la infección. La infección exitosa del huésped mamífero depende de la expresión bacteriana de OspC.
Las picaduras de garrapatas a menudo pasan desapercibidas debido al pequeño tamaño de la garrapata en su etapa de ninfa, así como a las secreciones de la garrapata que evitan que el huésped sienta picazón o dolor por la picadura. Sin embargo, la transmisión es bastante rara, con solo alrededor del 1.2 al 1.4 por ciento de las picaduras de garrapatas reconocidas que resultan en la enfermedad de Lyme.
En Europa, el vector principal es Ixodes ricinus, que también se denomina garrapata de oveja o garrapata de ricino. En China, Ixodes persulcatus (la garrapata de la taiga) es probablemente el vector más importante. En América del Norte, la garrapata de patas negras o garrapata del venado (Ixodes scapularis) es el principal vector en la costa este.
Es poco probable que la garrapata estrella solitaria (Amblyomma americanum), que se encuentra en todo el sureste de los Estados Unidos hasta Texas, transmita las espiroquetas de la enfermedad de Lyme, aunque puede estar implicada en una enfermedad relacionada. llamado síndrome del sarpullido asociado a la garrapata del sur, que se asemeja a una forma leve de la enfermedad de Lyme.
En la costa oeste de los Estados Unidos, el principal vector es la garrapata occidental de patas negras (Ixodes pacificus). La tendencia de esta especie de garrapata a alimentarse predominantemente de especies hospedantes como el lagarto de valla occidental que son resistentes a la infección por Borrelia parece disminuir la transmisión de la enfermedad de Lyme en Occidente.
La transmisión puede ocurrir a través de la placenta durante el embarazo y, al igual que con otras enfermedades por espiroquetas, es posible que se produzcan resultados adversos en el embarazo si la infección no se trata; el tratamiento oportuno con antibióticos reduce o elimina este riesgo.
No existe evidencia científica que respalde la transmisión de la enfermedad de Lyme a través de transfusiones de sangre, contacto sexual o leche materna.
Coinfecciones transmitidas por garrapatas
Ticks que transmiten B. burgdorferi a los humanos también puede portar y transmitir varios otros microbios, como Babesia microti y Anaplasma phagocytophilum, que causan las enfermedades babesiosis y anaplasmosis granulocítica humana (HGA), respectivamente. Entre las personas con enfermedad de Lyme temprana, dependiendo de su ubicación, 2 a 12 % también tendrán HGA y 2 a 10 % tendrán babesiosis. Las garrapatas en ciertas regiones también transmiten virus que causan la encefalitis transmitida por garrapatas y la enfermedad del virus Powassan. Es posible que las coinfecciones de la enfermedad de Lyme no requieran tratamiento adicional, ya que pueden resolverse por sí solas o, como en el caso de HGA, pueden tratarse con la doxiciclina recetada para Lyme. La fiebre persistente o los resultados de laboratorio anómalos compatibles pueden ser indicativos de una coinfección.
Fisiopatología
B. burgdorferi puede diseminarse por todo el cuerpo durante el curso de la enfermedad y se ha encontrado en la piel, el corazón, las articulaciones, el sistema nervioso periférico y el sistema nervioso central. B. Burgdorferi no produce toxinas. Por lo tanto, muchos de los signos y síntomas de la enfermedad de Lyme son consecuencia de la respuesta inmune a la espiroqueta en esos tejidos.
B. burgdorferi se inyecta en la piel por la picadura de una garrapata Ixodes infectada. La saliva de la garrapata, que acompaña a la espiroqueta en la piel durante el proceso de alimentación, contiene sustancias que interrumpen la respuesta inmunitaria en el lugar de la picadura. Esto proporciona un ambiente protector donde la espiroqueta puede establecer una infección. Las espiroquetas se multiplican y migran hacia el exterior dentro de la dermis. La respuesta inflamatoria del huésped a las bacterias de la piel provoca la característica lesión EM circular. Los neutrófilos, sin embargo, que son necesarios para eliminar las espiroquetas de la piel, no aparecen en cantidades necesarias en la lesión EM en desarrollo porque la saliva de la garrapata inhibe la función de los neutrófilos. Esto permite que las bacterias sobrevivan y eventualmente se propaguen por todo el cuerpo.
Días o semanas después de la picadura de la garrapata, las espiroquetas se diseminan a través del torrente sanguíneo hacia las articulaciones, el corazón, el sistema nervioso y sitios distantes de la piel, donde su presencia da lugar a la variedad de síntomas de la enfermedad diseminada. La propagación de B. burgdorferi se ve favorecida por la unión de la proteasa plasmina del huésped a la superficie de la espiroqueta.
Si no se trata, la bacteria puede persistir en el cuerpo durante meses o incluso años, a pesar de la producción de B. burgdorferi por el sistema inmunitario. Las espiroquetas pueden evitar la respuesta inmunitaria al disminuir la expresión de proteínas de superficie a las que se dirigen los anticuerpos, la variación antigénica de la proteína de superficie VlsE, la inactivación de componentes inmunitarios clave como el complemento y la ocultación en la matriz extracelular, lo que puede interferir con la función del sistema inmunitario. factores
En el cerebro, B. burgdorferi puede inducir a los astrocitos a sufrir astrogliosis (proliferación seguida de apoptosis), lo que puede contribuir a la neurodisfunción. Las espiroquetas también pueden inducir a las células huésped a secretar ácido quinolínico, que estimula el receptor NMDA en las células nerviosas, lo que puede explicar la fatiga y el malestar observados con la encefalopatía de Lyme. Además, la patología difusa de la materia blanca durante la encefalopatía de Lyme puede alterar las conexiones de la materia gris y podría explicar los déficits en la atención, la memoria, la capacidad visuoespacial, la cognición compleja y el estado emocional. La enfermedad de la sustancia blanca puede tener un mayor potencial de recuperación que la enfermedad de la sustancia gris, quizás porque la pérdida neuronal es menos común. Se ha observado la resolución de las hiperintensidades de la sustancia blanca en la RM después del tratamiento con antibióticos.
El triptófano, un precursor de la serotonina, parece estar reducido en el sistema nervioso central en varias enfermedades infecciosas que afectan al cerebro, incluida la enfermedad de Lyme. Los investigadores están investigando si esta secreción de neurohormonas es la causa de los trastornos neuropsiquiátricos que se desarrollan en algunas personas con borreliosis.
Estudios inmunológicos
La exposición a la bacteria Borrelia durante la enfermedad de Lyme posiblemente cause una respuesta inflamatoria duradera y dañina, una forma de enfermedad autoinmune inducida por patógenos. La producción de esta reacción podría deberse a una forma de mimetismo molecular, donde Borrelia evita ser eliminada por el sistema inmunitario al parecerse a partes normales de los tejidos del cuerpo.
Los síntomas crónicos de una reacción autoinmune podrían explicar por qué algunos síntomas persisten incluso después de que las espiroquetas hayan sido eliminadas del cuerpo. Esta hipótesis puede explicar por qué la artritis crónica persiste después de la terapia con antibióticos, similar a la fiebre reumática, pero su aplicación más amplia es controvertida.
Diagnóstico
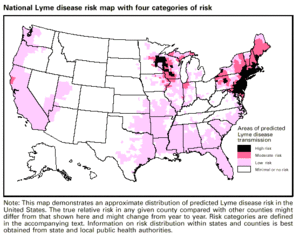
La enfermedad de Lyme se diagnostica en función de los síntomas, hallazgos físicos objetivos (como sarpullido eritema migratorio (EM), parálisis facial o artritis), antecedentes de posible exposición a garrapatas infectadas y posiblemente pruebas de laboratorio. Las personas con síntomas de la enfermedad de Lyme temprana deben someterse a un examen de la piel de todo el cuerpo en busca de erupciones EM y se les debe preguntar si las erupciones de tipo EM se han manifestado en los últimos 1 a 2 meses. La presencia de una erupción EM y la exposición reciente a garrapatas (es decir, estar al aire libre en un hábitat probable de garrapatas donde Lyme es común, dentro de los 30 días posteriores a la aparición de la erupción) son suficientes para el diagnóstico de Lyme; no se necesita ni se recomienda confirmación de laboratorio. La mayoría de las personas que se infectan no recuerdan una garrapata o una picadura, y la erupción EM no tiene por qué parecerse a una diana (la mayoría de las erupciones EM en los EE. UU. no lo hacen) ni estar acompañada de ningún otro síntoma. En los EE. UU., Lyme es más común en los estados de Nueva Inglaterra y el Atlántico Medio y partes de Wisconsin y Minnesota, pero se está expandiendo a otras áreas. Varias áreas limítrofes de Canadá también tienen un alto riesgo de Lyme.
En ausencia de una erupción EM o antecedentes de exposición a garrapatas, el diagnóstico de Lyme depende de la confirmación de laboratorio. Las bacterias que causan la enfermedad de Lyme son difíciles de observar directamente en los tejidos del cuerpo y también son difíciles de cultivar en el laboratorio y consumen demasiado tiempo. Las pruebas más utilizadas buscan en cambio la presencia de anticuerpos contra esas bacterias en la sangre. Un resultado positivo de la prueba de anticuerpos no prueba por sí mismo una infección activa, pero puede confirmar una infección que se sospecha debido a los síntomas, los hallazgos objetivos y el historial de exposición a garrapatas en una persona. Debido a que entre el 5 y el 20 % de la población normal tiene anticuerpos contra la enfermedad de Lyme, las personas sin antecedentes ni síntomas que sugieran la enfermedad de Lyme no deben someterse a pruebas de detección de anticuerpos contra la enfermedad de Lyme: un resultado positivo probablemente sea falso, lo que posiblemente cause un tratamiento innecesario.
En algunos casos, cuando los antecedentes, los signos y los síntomas sugieren claramente una enfermedad de Lyme diseminada temprana, se puede iniciar un tratamiento empírico y reevaluarse a medida que se disponga de los resultados de las pruebas de laboratorio.
Pruebas de laboratorio
Las pruebas de anticuerpos en la sangre por ELISA y Western blot es el método más utilizado para el diagnóstico de Lyme. Los Centros para el Control y la Prevención de Enfermedades (CDC) recomiendan un protocolo de dos niveles: primero se realiza la prueba ELISA sensible y, si es positiva o equívoca, se ejecuta la transferencia Western más específica. El sistema inmunitario tarda un tiempo en producir anticuerpos en cantidad. Después del inicio de la infección de Lyme, los anticuerpos de los tipos IgM e IgG generalmente se pueden detectar por primera vez respectivamente a las 2 a 4 semanas y a las 4 a 6 semanas, y alcanzan su punto máximo a las 6 a 8 semanas. Cuando aparece por primera vez una erupción EM, es posible que no haya anticuerpos detectables. Por lo tanto, se recomienda que no se realicen pruebas y que el diagnóstico se base en la presencia de la erupción EM. Hasta 30 días después del inicio de la sospecha de infección por Lyme, la infección puede confirmarse mediante la detección de anticuerpos IgM o IgG; después de eso, se recomienda considerar solo los anticuerpos IgG. Un resultado positivo de la prueba de IgM y negativo de IgG después del primer mes de infección generalmente indica un resultado falso positivo. La cantidad de anticuerpos IgM suele colapsar entre 4 y 6 meses después de la infección, mientras que los anticuerpos IgG pueden permanecer detectables durante años.
Se pueden usar otras pruebas en casos de neuroborreliosis. En Europa, la neuroborreliosis generalmente es causada por Borrelia garinii y casi siempre implica pleocitosis linfocítica, es decir, las densidades de linfocitos (células que combaten infecciones) y proteínas en el líquido cefalorraquídeo (LCR) generalmente aumentan a niveles característicamente anormales, mientras que el nivel de glucosa permanece normal. Además, el sistema inmunitario produce anticuerpos contra Lyme dentro del espacio intratecal, que contiene el LCR. Se requiere la demostración mediante punción lumbar y análisis del LCR de pleocitosis y producción de anticuerpos intratecales para el diagnóstico definitivo de neuroborreliosis en Europa (excepto en casos de neuropatía periférica asociada con acrodermatitis crónica atrófica, que generalmente es causada por Borrelia afzelii y confirmada por análisis de anticuerpos en sangre). En América del Norte, la neuroborreliosis es causada por Borrelia burgdorferi y es posible que no se acompañe de los mismos signos del LCR; confirman un diagnóstico de neuroborreliosis del sistema nervioso central (SNC) si es positivo, pero no lo excluyen si es negativo. Las pautas estadounidenses consideran que el análisis del LCR es opcional cuando los síntomas parecen limitarse al sistema nervioso periférico (SNP), p. parálisis facial sin síntomas manifiestos de meningitis. A diferencia de las pruebas de anticuerpos en sangre e intratecales, las pruebas de pleocitosis en el LCR vuelven a la normalidad después de que termina la infección y, por lo tanto, pueden usarse como marcadores objetivos del éxito del tratamiento e informar las decisiones sobre si se debe repetir el tratamiento. En la infección que afecta al SNP, se pueden utilizar la electromiografía y los estudios de conducción nerviosa para controlar objetivamente la respuesta al tratamiento.
En la carditis de Lyme, los electrocardiogramas se usan para evidenciar anomalías en la conducción cardíaca, mientras que la ecocardiografía puede mostrar disfunción miocárdica. La biopsia y la confirmación de células de Borrelia en el tejido miocárdico pueden usarse en casos específicos, pero generalmente no se realizan debido al riesgo del procedimiento.
También se han desarrollado pruebas de reacción en cadena de la polimerasa (PCR) para la enfermedad de Lyme a fin de detectar el material genético (ADN) de la espiroqueta de la enfermedad de Lyme. El cultivo o PCR son los medios actuales para detectar la presencia del organismo, ya que los estudios serológicos solo prueban anticuerpos de Borrelia. La PCR tiene la ventaja de ser mucho más rápida que el cultivo. Sin embargo, las pruebas de PCR son susceptibles a resultados falsos positivos, p. mediante la detección de restos de células muertas de Borrelia o contaminación de la muestra. Incluso cuando se realiza correctamente, la PCR a menudo muestra resultados falsos negativos porque se pueden encontrar pocas células de Borrelia en la sangre y el líquido cefalorraquídeo (LCR) durante la infección. Por lo tanto, las pruebas de PCR se recomiendan solo en casos especiales, p. diagnóstico de la artritis de Lyme, porque es una forma muy sensible de detectar el ADN de ospA en el líquido sinovial. Aunque la sensibilidad de la PCR en LCR es baja, se puede considerar su uso cuando se sospecha que los resultados de las pruebas de producción de anticuerpos intratecales son falsos negativos, p. en neuroborreliosis muy temprana (< 6 semanas) o en personas inmunodeprimidas.
Existen otras formas de pruebas de laboratorio para la enfermedad de Lyme, algunas de las cuales no se han validado adecuadamente. Los antígenos OspA, arrojados por la bacteria Borrelia viva en la orina, son una técnica prometedora que se está estudiando. Se está analizando el uso de partículas nanotrap para su detección y la OspA se ha relacionado con síntomas activos de Lyme. Los títulos altos de anticuerpos de inmunoglobulina G (IgG) o inmunoglobulina M (IgM) contra los antígenos de Borrelia indican enfermedad, pero los títulos más bajos pueden ser engañosos, porque los anticuerpos IgM pueden permanecer después de la infección inicial y los anticuerpos IgG puede permanecer durante años.
Los CDC no recomiendan pruebas de antígenos en orina, pruebas de PCR en orina, tinción inmunofluorescente para formas de B deficientes en la pared celular. burgdorferi, y pruebas de transformación de linfocitos.
Imágenes
La neuroimagen es controvertida en cuanto a si proporciona patrones específicos exclusivos de la neuroborreliosis, pero puede ayudar en el diagnóstico diferencial y en la comprensión de la fisiopatología de la enfermedad. Aunque controvertida, alguna evidencia muestra que ciertas pruebas de neuroimagen pueden proporcionar datos que son útiles en el diagnóstico de una persona. La resonancia magnética nuclear (RMN) y la tomografía computarizada por emisión de fotón único (SPECT) son dos de las pruebas que pueden identificar anomalías en el cerebro de una persona afectada por esta enfermedad. Los hallazgos de neuroimagen en una resonancia magnética incluyen lesiones en la sustancia blanca periventricular, así como ventrículos agrandados y atrofia cortical. Los hallazgos se consideran poco excepcionales porque se ha descubierto que las lesiones son reversibles después del tratamiento con antibióticos. Las imágenes producidas mediante SPECT muestran numerosas áreas en las que se administra una cantidad insuficiente de sangre a la corteza y la sustancia blanca subcortical. Sin embargo, se sabe que las imágenes SPECT son inespecíficas porque muestran un patrón heterogéneo en las imágenes. Las anomalías observadas en las imágenes de SPECT son muy similares a las observadas en personas con vasculitis cerebral y enfermedad de Creutzfeldt-Jakob, lo que las hace cuestionables.
Diagnóstico diferencial
Se ha informado que las clínicas comunitarias diagnostican erróneamente entre el 23 y el 28 % de las erupciones por eritema migrans (EM) y el 83 % de otras manifestaciones objetivas de la enfermedad de Lyme temprana. Las erupciones EM a menudo se diagnostican erróneamente como picaduras de araña, celulitis o herpes zóster. Muchos diagnósticos erróneos se atribuyen a la idea errónea generalizada de que las erupciones EM deberían verse como una diana. En realidad, las características distintivas clave de la erupción EM son la velocidad y el grado en que se expande, respectivamente hasta 2-3 cm/día y un diámetro de al menos 5 cm, y en el 50 % de los casos más de 16 cm. El sarpullido se expande lejos de su centro, que puede o no verse diferente o estar separado del resto del sarpullido por un claro en forma de anillo. En comparación con las erupciones EM, las picaduras de araña son más comunes en las extremidades, tienden a ser más dolorosas y pican o se hinchan, y algunas pueden causar necrosis (un parche azul oscuro de piel muerta que se hunde). La celulitis se desarrolla más comúnmente alrededor de una herida o úlcera, rara vez es circular y es más probable que se hinche y se vuelva sensible. Las erupciones EM a menudo aparecen en sitios que son inusuales para la celulitis, como la axila, la ingle, el abdomen o la parte posterior de la rodilla. Al igual que la enfermedad de Lyme, la culebrilla a menudo comienza con dolor de cabeza, fiebre y fatiga, seguidos de dolor o entumecimiento. Sin embargo, a diferencia de Lyme, en el herpes zóster estos síntomas suelen ir seguidos de la aparición de erupciones compuestas por múltiples ampollas pequeñas junto con un dermatoma nervioso, y el herpes zóster también puede confirmarse mediante pruebas de laboratorio rápidas.
La parálisis facial causada por la enfermedad de Lyme (LDFP) a menudo se diagnostica erróneamente como parálisis de Bell. Aunque la parálisis de Bell es el tipo más común de parálisis facial de un solo lado (alrededor del 70 % de los casos), la LDFP puede representar alrededor del 25 % de los casos de parálisis facial en áreas donde la enfermedad de Lyme es común. En comparación con la LDFP, la parálisis de Bell afecta con mucha menos frecuencia a ambos lados de la cara. Aunque la LDFP y la parálisis de Bell tienen síntomas similares y evolucionan de manera similar si no se tratan, el tratamiento con corticosteroides es beneficioso para la parálisis de Bell, mientras que es perjudicial para la LDFP. Se deben evaluar los antecedentes recientes de exposición a un hábitat probable de garrapatas durante los meses más cálidos, sarpullido EM, síntomas virales como dolor de cabeza y fiebre y/o parálisis en ambos lados de la cara para determinar la probabilidad de LDFP; si es más que mínimo, se debe iniciar terapia empírica con antibióticos, sin corticosteroides, y reevaluar al completar las pruebas de laboratorio para la enfermedad de Lyme.
A diferencia de la meningitis viral, la meningitis linfocítica de Lyme tiende a no causar fiebre, dura más y reaparece. La meningitis linfocítica también se caracteriza por la posibilidad de coexistir con erupción EM, parálisis facial u obstrucción parcial de la visión y por tener un porcentaje mucho más bajo de leucocitos polimorfonucleares en el LCR.
La radiculopatía de Lyme que afecta las extremidades a menudo se diagnostica erróneamente como una radiculopatía causada por la compresión de la raíz nerviosa, como la ciática. Aunque la mayoría de los casos de radiculopatía son compresivos y se resuelven con tratamiento conservador (p. ej., reposo) en 4 a 6 semanas, las guías para el manejo de la radiculopatía recomiendan evaluar primero los riesgos de otras posibles causas que, aunque menos frecuentes, requieren diagnóstico y tratamiento inmediatos, incluidas infecciones como como Lyme y culebrilla. Un historial de actividades al aire libre en hábitats probables de garrapatas en los últimos 3 meses, posiblemente seguido de una erupción o síntomas similares a los virales, y dolor de cabeza actual, otros síntomas de meningitis linfocítica o parálisis facial, llevarían a la sospecha de la enfermedad de Lyme y la recomendación de serología y Pruebas de punción lumbar para confirmación.
La radiculopatía de Lyme que afecta el tronco se puede diagnosticar erróneamente como una miríada de otras afecciones, como la diverticulitis y el síndrome coronario agudo. El diagnóstico de la enfermedad de Lyme en etapa tardía a menudo se complica por una apariencia multifacética y síntomas inespecíficos, lo que llevó a un revisor a llamar a Lyme el nuevo "gran imitador". Como todas las personas con una infección en etapa avanzada tendrán una prueba de anticuerpos positiva, los análisis de sangre simples pueden excluir la enfermedad de Lyme como una posible causa de los síntomas de una persona.
Prevención
Las picaduras de garrapatas se pueden prevenir evitando o reduciendo el tiempo en los posibles hábitats de las garrapatas y tomando precauciones al entrar y salir de uno.
La mayoría de las infecciones humanas de Lyme son causadas por picaduras de ninfas de Ixodes entre abril y septiembre. Las garrapatas prefieren lugares húmedos y sombreados en bosques, arbustos, pastos altos y hojarasca o montones de madera. Las densidades de garrapatas tienden a ser más altas en los bosques, seguidas por los bordes sin mantenimiento entre los bosques y el césped (alrededor de la mitad), las plantas ornamentales y la cubierta vegetal perenne (alrededor de una cuarta parte) y el césped (alrededor de 30 veces menos). Las larvas y ninfas de Ixodes tienden a ser abundantes también donde anidan los ratones, como paredes de piedra y troncos de madera. Las larvas y ninfas de Ixodes normalmente esperan a los huéspedes potenciales ("búsqueda") en hojas o pastos cerca del suelo con las patas delanteras extendidas; cuando un huésped roza sus extremidades, la garrapata rápidamente se aferra y trepa sobre el huésped en busca de un lugar en la piel para morder. En el noreste de los Estados Unidos, se estima que el 69 % de las picaduras de garrapatas ocurren en residencias, el 11 % en escuelas o campamentos, el 9 % en parques o áreas recreativas, el 4 % en el trabajo, el 3 % durante la caza y el 4 % en otras áreas. Las actividades asociadas con las picaduras de garrapatas alrededor de las residencias incluyen el trabajo en el jardín, la limpieza de arbustos, la jardinería, jugar en el jardín y dejar entrar a la casa a los perros o gatos que deambulan afuera en áreas boscosas o con césped. En los parques, las picaduras de garrapatas a menudo ocurren durante caminatas o campamentos. Caminar sobre un césped cortado o el centro de un sendero sin tocar la vegetación adyacente es menos riesgoso que gatear o sentarse sobre un tronco o un muro de piedra. No se debe permitir que las mascotas deambulen libremente en los posibles hábitats de las garrapatas.
Como precaución, los CDC recomiendan remojar o rociar la ropa, los zapatos y el equipo de campamento, como tiendas de campaña, mochilas y sacos de dormir, con una solución de permetrina al 0,5 % y colgarlos para que se sequen antes de usarlos. La permetrina es inodora y segura para los humanos, pero altamente tóxica para las garrapatas. Después de arrastrarse sobre telas tratadas con permetrina durante tan solo 10 a 20 segundos, las ninfas de garrapata se irritan y se caen o mueren. Los zapatos cerrados y los calcetines tratados con permetrina reducen 74 veces la cantidad de mordeduras de las ninfas que hacen el primer contacto con un zapato de una persona que también usa pantalones cortos tratados (debido a que las ninfas generalmente buscan cerca del suelo, este es un escenario de contacto típico). Se puede lograr una mejor protección metiendo los pantalones tratados con permetrina dentro de los calcetines tratados y una camisa de manga larga tratada dentro de los pantalones para minimizar los espacios a través de los cuales una garrapata podría alcanzar la piel del usuario. La ropa de colores claros puede hacer que sea más fácil ver las garrapatas y quitarlas antes de que piquen. Trabajadores militares y al aire libre' Se ha descubierto que los uniformes tratados con permetrina reducen el número de casos de mordeduras en un 80 a 95%. La protección con permetrina dura varias semanas de uso y lavados en artículos tratados por el cliente y hasta 70 lavados para artículos tratados en fábrica. La permetrina no debe usarse en la piel humana, la ropa interior o los gatos.
La EPA recomienda varios repelentes de garrapatas para usar en la piel expuesta, incluidos DEET, picaridina, IR3535 (un derivado del aminoácido beta-alanina), aceite de eucalipto de limón (OLE, un compuesto natural) y OLE's active ingrediente para-mentano-diol (PMD). A diferencia de la permetrina, los repelentes repelen pero no matan las garrapatas, protegen solo durante varias horas después de la aplicación y pueden eliminarse con el sudor o el agua. El repelente más popular es el DEET en los EE. UU. y la picaridina en Europa. A diferencia del DEET, la picaridina no tiene olor y es menos probable que irrite la piel o dañe la tela o los plásticos. Los repelentes con mayor concentración pueden durar más pero no son más efectivos; contra las garrapatas, la picaridina al 20 % puede funcionar durante 8 horas frente al 55–98,11 % de DEET durante 5–6 horas o el 30–40 % de OLE durante 6 horas. Los repelentes no deben usarse debajo de la ropa, en los ojos, boca, heridas o cortes, o en bebés menores de 2 meses (3 años para OLE o PMD). Si se usa bloqueador solar, se debe aplicar repelente encima. Los repelentes no deben rociarse directamente en la cara, sino que deben rociarse en una mano y luego frotarse en la cara.
Después de entrar al interior, la ropa, el equipo y las mascotas deben revisarse en busca de garrapatas. La ropa se puede poner en una secadora caliente durante 10 minutos para matar las garrapatas (simplemente lavar o secar con agua tibia no es suficiente). Ducharse lo antes posible, buscar garrapatas en todo el cuerpo y quitarlas reduce el riesgo de infección. Las ninfas de garrapata sin alimentar son del tamaño de una semilla de amapola, pero uno o dos días después de morder y adherirse a una persona, se ven como una pequeña ampolla de sangre. Las siguientes áreas deben revisarse con especial cuidado: axilas, entrepiernas, parte posterior de la rodilla, ombligo, tronco y, en niños, orejas, cuello y cabello.
Eliminación de garrapatas
Las marcas adjuntas deben eliminarse de inmediato. El riesgo de infección aumenta con el tiempo de adhesión, pero en América del Norte el riesgo de enfermedad de Lyme es pequeño si la garrapata se elimina dentro de las 36 horas. Los CDC recomiendan insertar una pinza de punta fina entre la piel y la garrapata, agarrarla con mucha firmeza y tirar de la pinza cerrada directamente lejos de la piel sin torcer, sacudir, apretar ni aplastar la garrapata. Después de la eliminación de la garrapata, cualquier parte de la garrapata que quede en la piel debe eliminarse con una pinza limpia, si es posible. Luego, la herida y las manos deben limpiarse con alcohol o agua y jabón. La garrapata se puede desechar colocándola en un recipiente con alcohol, una bolsa sellada, cinta adhesiva o tirándola por el inodoro. La persona mordida debe anotar dónde y cuándo ocurrió la mordedura para que se lo pueda informar a un médico si la persona presenta una erupción o síntomas similares a los de la gripe en las siguientes semanas. Los CDC recomiendan no usar los dedos, esmalte de uñas, vaselina o calor sobre la garrapata para intentar quitarla.
En Australia, donde prevalece la garrapata de la parálisis australiana, la Sociedad de Alergia e Inmunología Clínica de Australasia recomienda no usar pinzas para quitar las garrapatas, porque si la persona es alérgica, podría producirse anafilaxia. En su lugar, se debe rociar un producto sobre la garrapata para que se congele y luego se caiga. Un médico usaría nitrógeno líquido, pero en su lugar se pueden usar productos disponibles en farmacias para congelar las verrugas. Otro método originario de Australia consiste en utilizar unos 20 cm de hilo dental o hilo de pescar para atar lentamente un nudo simple entre la piel y la garrapata y luego separarlo de la piel.
Antibióticos preventivos
El riesgo de transmisión infecciosa aumenta con la duración de la adherencia de la garrapata. Requiere entre 36 y 48 horas de adhesión para que la bacteria que causa la enfermedad de Lyme viaje desde el interior de la garrapata hasta su saliva. Si se encuentra adherida a una persona una garrapata de venado que probablemente sea portadora de Borrelia y se la extrae, y si la garrapata ha estado adherida durante 36 horas o está hinchada, se administrará una dosis única de doxiciclina dentro del 72 horas después de la extracción puede reducir el riesgo de enfermedad de Lyme. Por lo general, no se recomienda para todas las personas mordidas, ya que el desarrollo de la infección es raro: unas 50 personas mordidas tendrían que ser tratadas de esta manera para prevenir un caso de eritema migratorio (es decir, la erupción típica que se encuentra en aproximadamente el 70-80% de las personas infectadas).).
Paisajismo de jardines
Varias prácticas de paisajismo pueden reducir el riesgo de picaduras de garrapatas en jardines residenciales. Estos incluyen mantener el césped cortado, eliminar la hojarasca y las malas hierbas y evitar el uso de cubiertas para el suelo. Se recomienda una barrera de roca o astillas de madera de 3 pies de ancho para separar el césped de las pilas de madera, los bosques, los muros de piedra y los arbustos. Sin vegetación en la barrera, las garrapatas tenderán a no cruzarla; También se pueden rociar acaricidas para matar las garrapatas. Una zona segura de garrapatas expuesta al sol al menos a 9 pies de la barrera debe concentrar la actividad humana en el patio, incluidos los patios, los parques infantiles y la jardinería. Los materiales como cubiertas de madera, hormigón, ladrillos, grava o astillas de madera que se utilizan en el suelo debajo de los patios y áreas de juegos desalientan las garrapatas allí. Se puede agregar una cerca de 8 pies de alto para mantener a los venados alejados de la zona segura de garrapatas.
Exposición ocupacional
Los trabajadores al aire libre corren el riesgo de contraer la enfermedad de Lyme si trabajan en sitios con garrapatas infectadas. Esto incluye la construcción, el paisajismo, la silvicultura, la limpieza de matorrales, la agrimensura, la agricultura, el trabajo ferroviario, el trabajo en campos petroleros, el trabajo en líneas de servicios públicos, la gestión de parques o la vida silvestre. Los trabajadores de EE. UU. en los estados del noreste y centro-norte corren el mayor riesgo de exposición a garrapatas infectadas. Las garrapatas también pueden transmitir otras enfermedades transmitidas por garrapatas a los trabajadores en estas y otras regiones del país. Es probable que los lugares de trabajo con bosques, arbustos, hierba alta o hojarasca tengan más garrapatas. Los trabajadores al aire libre deben tener más cuidado para protegerse a fines de la primavera y el verano, cuando las garrapatas jóvenes están más activas.
Animales de acogida
Las garrapatas pueden alimentarse de la sangre de una amplia gama de posibles huéspedes, como lagartijas, pájaros, ratones, gatos, perros, ciervos, ganado y humanos. La medida en que una garrapata puede alimentarse, reproducirse y propagarse dependerá del tipo y la disponibilidad de sus anfitriones. La posibilidad de que propague la enfermedad también se ve afectada por los huéspedes disponibles. Algunas especies, como los lagartos, se conocen como "huéspedes de dilución" porque no tienden a apoyar a los patógenos de la enfermedad de Lyme y, por lo tanto, disminuyen la probabilidad de que las garrapatas que se alimentan de ellos transmitan la enfermedad. El venado cola blanca es tanto una fuente de alimento como un 'huésped reproductivo', donde las garrapatas tienden a aparearse. El ratón de patas blancas es un huésped reservorio en el que puede sobrevivir el patógeno de la enfermedad de Lyme. La disponibilidad de huéspedes puede tener un impacto significativo en la transmisión de la enfermedad de Lyme. Una mayor diversidad de hospedadores, o de aquellos que no soportan el patógeno, tiende a disminuir la probabilidad de que se transmita la enfermedad.
En los Estados Unidos, un enfoque para reducir la incidencia de Lyme y otras enfermedades transmitidas por garrapatas de venado ha sido reducir en gran medida la población de venados de la que dependen las garrapatas adultas para alimentarse y reproducirse. Los casos de enfermedad de Lyme disminuyeron luego de la erradicación de venados en una isla, Monhegan, Maine, y luego del control de venados en Mumford Cove, Connecticut. Los defensores han sugerido reducir la población de ciervos a niveles de 8 a 10 ciervos por milla cuadrada, en comparación con los niveles de 60 o más ciervos por milla cuadrada en las áreas del país con las tasas más altas de la enfermedad de Lyme.
Otros han señalado que, si bien los ciervos son huéspedes reproductivos, no son reservorios de Borrelia burgdorferi. Los investigadores han sugerido que los reservorios de Lyme más pequeños y menos visibles, como los ratones de patas blancas y las ardillas listadas orientales, pueden tener un impacto más fuerte en la aparición de la enfermedad de Lyme. Los estudios de ecosistemas en el estado de Nueva York sugieren que los ratones de patas blancas prosperan cuando los bosques se dividen en trozos más pequeños y aislados con menos roedores depredadores. Con más roedores que albergan la enfermedad, aumentan las probabilidades de que una garrapata se alimente de un roedor portador de la enfermedad y que alguien recoja una garrapata portadora de la enfermedad en su jardín o caminando por el bosque. Los datos indican que cuanto menor sea el área boscosa, más garrapatas contendrá y es probable que transmitan la enfermedad de Lyme, lo que respalda la idea de que la deforestación y la fragmentación del hábitat afectan a las garrapatas, los huéspedes y la transmisión de enfermedades.
Se estima que las enfermedades transmitidas por garrapatas afectan a ~80 % del ganado en todo el mundo. También afectan a gatos, perros y otras mascotas. Se ha sugerido el control veterinario de rutina de las garrapatas de los animales domésticos mediante el uso de acaricidas como una forma de reducir la exposición de los seres humanos a las garrapatas. Sin embargo, el control químico con acaricidas ahora se critica por varios motivos. Las garrapatas parecen desarrollar resistencia a los acaricidas; los acaricidas son costosos; y existen preocupaciones sobre su toxicidad y la posibilidad de que los residuos químicos afecten los alimentos y el medio ambiente.
En Europa, los reservorios conocidos de Borrelia burgdorferi fueron 9 pequeños mamíferos, 7 mamíferos medianos y 16 especies de aves (incluyendo paseriformes, aves marinas y faisanes). Estos animales parecen transmitir espiroquetas a las garrapatas y participar así en la circulación natural de B. burgdorferi en Europa. También se sospecha del ratón doméstico, así como de otras especies de pequeños roedores, particularmente en Europa del Este y Rusia. "Las especies reservorio que contienen más patógenos son el corzo europeo Capreolus capreolus; "no parece servir como un reservorio importante de B. burgdorferi" pensó Jaenson & Alabama. (1992) (huésped incompetente para B. burgdorferi y virus TBE) pero es importante para la alimentación de garrapatas, como ciervos y jabalíes (Sus scrofa), en las que Se identificaron una especie de Rickettsia y tres de Borrelia, con alto riesgo de coinfección en corzo. Sin embargo, en la década de 2000, en corzos en Europa se identificaron "dos especies de Rickettsia y dos especies de Borrelia".
Vacunación
A partir de 2023, no había vacunas para humanos contra la enfermedad de Lyme disponibles. La única vacuna humana que avanzó al mercado fue LYMErix, que estuvo disponible desde 1998, pero se suspendió en 2002. La vacuna candidata VLA15 estaba programada para comenzar un ensayo de fase 3 en el tercer trimestre de 2022, con otras investigaciones en curso. Hay múltiples vacunas disponibles para la prevención de la enfermedad de Lyme en perros.
LYMErix
La vacuna LYMErix estuvo disponible desde 1998 hasta 2002. La vacuna recombinante contra la enfermedad de Lyme, basada en la proteína de superficie externa A (OspA) de B. burgdorferi con hidróxido de aluminio como adyuvante, fue desarrollado por SmithKline Beecham. En ensayos clínicos en los que participaron más de 10 000 personas, se descubrió que la vacuna confiere inmunidad protectora contra la enfermedad de Lyme en el 76 % de los adultos después de tres dosis con solo efectos adversos leves o moderados y transitorios. El 21 de diciembre de 1998, la Administración de Alimentos y Medicamentos (FDA) aprobó LYMErix sobre la base de estos ensayos para personas de 15 a 70 años de edad.
Después de la aprobación de la vacuna, su entrada en la práctica clínica fue lenta por una variedad de razones, incluido su costo, que a menudo no era reembolsado por las compañías de seguros. Posteriormente, cientos de vacunados informaron que habían desarrollado efectos secundarios autoinmunes y de otro tipo. Con el apoyo de algunos grupos de defensa, se presentaron varias demandas colectivas contra GlaxoSmithKline, alegando que la vacuna había causado estos problemas de salud. Estas afirmaciones fueron investigadas por la FDA y los Centros para el Control de Enfermedades, que no encontraron conexión entre la vacuna y las quejas autoinmunes.
A pesar de la falta de evidencia de que las quejas fueran causadas por la vacuna, las ventas se desplomaron y GlaxoSmithKline retiró LYMErix del mercado estadounidense en febrero de 2002, en el contexto de una cobertura mediática negativa y temores de los efectos secundarios de la vacuna. El destino de LYMErix se describió en la literatura médica como un "cuento de advertencia"; un editorial en Nature citó la retirada de LYMErix como un caso en el que "los temores públicos infundados ejercen presiones sobre los desarrolladores de vacunas que van más allá de las consideraciones de seguridad razonables". El desarrollador original de la vacuna OspA en el Instituto Max Planck le dijo a Nature: "Esto solo muestra cuán irracional puede ser el mundo... No había justificación científica para que la primera vacuna OspA LYMErix fuera tiró."
VLA15
Valneva desarrolló la vacuna candidata VLA15 basada en la subunidad de la proteína hexavalente (OspA). La Administración de Drogas y Alimentos de EE. UU. le otorgó la designación de vía rápida en julio de 2017. En abril de 2020, Pfizer pagó $ 130 millones por los derechos de la vacuna, y las compañías la están desarrollando juntas, realizando múltiples ensayos de fase 2.
Se programó un ensayo de fase 3 de VLA15 para fines de 2022, reclutando voluntarios en sitios de prueba ubicados en el noreste de los Estados Unidos y en Europa. Se programó que los participantes recibieran una serie inicial de tres dosis de vacunas en el transcurso de cinco a nueve meses, seguida de una dosis de refuerzo después de doce meses, con la serie inicial y la dosis de refuerzo programadas para completarse antes del año. Temporada pico de la enfermedad de Lyme.
Otras investigaciones
Una vacuna de ARNm diseñada para provocar una respuesta inmunitaria fuerte y rápida a la saliva de las garrapatas permitió que el sistema inmunitario detectara y eliminara las garrapatas de los animales de prueba antes de que pudieran transmitir la bacteria infecciosa. La vacuna contiene ARNm para que el cuerpo produzca 19 proteínas en la saliva de la garrapata que, al permitir el rápido desarrollo de eritema (enrojecimiento con picazón) en el sitio de la picadura, protege a los conejillos de indias contra la enfermedad de Lyme. También protegió a los animales de prueba si la garrapata no se quita si solo una garrapata, pero no tres, permanece adherida.
Vacunas caninas
Se han formulado y aprobado vacunas caninas para la prevención de la enfermedad de Lyme en perros. Actualmente, hay tres vacunas contra la enfermedad de Lyme disponibles. LymeVax, formulado por Fort Dodge Laboratories, contiene espiroquetas muertas intactas que exponen al huésped al organismo. Galaxy Lyme, la vacuna de Intervet-Schering-Plough, se dirige a las proteínas OspC y OspA. Los anticuerpos OspC matan cualquier bacteria que no haya sido eliminada por los anticuerpos OspA. Canine Recombinant Lyme, formulado por Merial, genera anticuerpos contra la proteína OspA para que una garrapata que se alimenta de un perro vacunado extraiga sangre llena de anticuerpos anti-OspA, que matan las espiroquetas en el intestino de la garrapata antes de que se transmitan al perro.
Tratamiento
Los antibióticos son el tratamiento principal. El enfoque específico para su uso depende del individuo afectado y la etapa de la enfermedad. Para la mayoría de las personas con infección localizada temprana, se recomienda ampliamente la administración oral de doxiciclina como primera opción, ya que es eficaz no solo contra la bacteria Borrelia sino también contra una variedad de otras enfermedades transmitidas por garrapatas. Las personas que toman doxiciclina deben evitar la exposición al sol debido al mayor riesgo de quemaduras solares. La doxiciclina está contraindicada en niños menores de ocho años y mujeres embarazadas o lactantes; las alternativas a la doxiciclina son amoxicilina, cefuroxima axetilo y azitromicina. La azitromicina se recomienda solo en caso de intolerancia a los otros antibióticos. El tratamiento estándar para la celulitis, la cefalexina, no es útil para la enfermedad de Lyme. Cuando no está claro si una erupción es causada por Lyme o celulitis, la IDSA recomienda el tratamiento con cefuroxima o amoxicilina/ácido clavulánico, ya que estos son efectivos contra ambas infecciones. Las personas con infección de Lyme diseminada temprana o tardía pueden tener enfermedad cardíaca sintomática, artritis de Lyme o síntomas neurológicos como parálisis facial, radiculopatía, meningitis o neuropatía periférica. Se recomienda la administración intravenosa de ceftriaxona como primera opción en estos casos; cefotaxima y doxiciclina están disponibles como alternativas.
Los regímenes de tratamiento para la enfermedad de Lyme varían de 14 días en la enfermedad localizada temprana, de 14 a 21 días en la enfermedad diseminada temprana y de 14 a 28 días en la enfermedad diseminada tardía. Las complicaciones neurológicas de la enfermedad de Lyme se pueden tratar con doxiciclina, ya que se puede tomar por vía oral y tiene un costo menor, aunque en América del Norte la evidencia de eficacia es solo indirecta. En caso de fracaso, las guías recomiendan el retratamiento con ceftriaxona inyectable. Varios meses después del tratamiento de la artritis de Lyme, si la inflamación de las articulaciones persiste o regresa, se puede considerar una segunda ronda de antibióticos; se prefieren los antibióticos intravenosos para el retratamiento en caso de mala respuesta a los antibióticos orales. Fuera de eso, no se recomienda un régimen prolongado de antibióticos que dure más de 28 días, ya que no hay evidencia que demuestre que sea efectivo. Los niveles de anticuerpos IgM e IgG pueden estar elevados durante años incluso después de un tratamiento exitoso con antibióticos. Dado que los niveles de anticuerpos no son indicativos del éxito del tratamiento, no se recomienda realizar pruebas para detectarlos.
La parálisis facial puede resolverse sin tratamiento; sin embargo, se recomienda el tratamiento con antibióticos para detener otras complicaciones de Lyme. No se recomiendan los corticosteroides cuando la parálisis facial es causada por la enfermedad de Lyme. En aquellos con parálisis facial, se recomienda el uso frecuente de lágrimas artificiales mientras están despiertos, junto con un ungüento y un parche o tapar el ojo con cinta adhesiva cuando duermen.
Alrededor de un tercio de las personas con carditis de Lyme necesitan un marcapasos temporal hasta que se resuelva la anomalía de la conducción cardíaca, y el 21 % necesita ser hospitalizado. La carditis de Lyme no debe tratarse con corticosteroides.
Las personas con artritis de Lyme deben limitar su nivel de actividad física para evitar dañar las articulaciones afectadas, y en caso de cojear deben usar muletas. El dolor asociado con la enfermedad de Lyme se puede tratar con medicamentos antiinflamatorios no esteroideos (AINE). Las inyecciones de corticosteroides en las articulaciones no se recomiendan para la artritis de Lyme que se trata con antibióticos. Se dice que las personas con artritis de Lyme tratadas con antibióticos intravenosos o dos meses de antibióticos orales que continúan teniendo inflamación de las articulaciones dos meses después del tratamiento y tienen una prueba de PCR negativa para el ADN de Borrelia en el líquido sinovial tienen artritis de Lyme posterior a los antibióticos; esto es más común después de la infección por ciertas cepas de Borrelia en personas con ciertas características genéticas e inmunológicas. La artritis de Lyme posterior a los antibióticos se puede tratar sintomáticamente con AINE, fármacos antirreumáticos modificadores de la enfermedad (DMARD), sinovectomía artroscópica o fisioterapia.
Se debe advertir a las personas que reciben tratamiento que la reinfección es posible y cómo prevenirla.
Pronóstico
El primer signo típico de la enfermedad de Lyme, la erupción del eritema migrans (EM), se resuelve en varias semanas incluso sin tratamiento. Sin embargo, en las personas que no reciben tratamiento, la infección a menudo se disemina al sistema nervioso, el corazón o las articulaciones, lo que posiblemente provoque daños permanentes en los tejidos corporales.
Las personas que reciben el tratamiento antibiótico recomendado dentro de varios días de la aparición de una erupción EM inicial tienen las mejores perspectivas. La recuperación puede no ser total o inmediata. El porcentaje de personas que logran una recuperación completa en los Estados Unidos aumenta de alrededor de 64 a 71 % al final del tratamiento para la erupción EM a alrededor de 84 a 90 % después de 30 meses; se informan porcentajes más altos en Europa. El fracaso del tratamiento, es decir, la persistencia de los signos originales o la aparición de nuevos signos de la enfermedad, ocurre solo en unas pocas personas. Las personas restantes se consideran curadas pero continúan experimentando síntomas subjetivos, p. dolores articulares o musculares o fatiga. Estos síntomas suelen ser leves y no incapacitantes.
Las personas tratadas solo después de las manifestaciones del sistema nervioso de la enfermedad pueden terminar con déficits neurológicos objetivos, además de síntomas subjetivos. En Europa, un promedio de 32 a 33 meses después de los síntomas iniciales de Lyme en personas tratadas principalmente con doxiciclina 200 mg durante 14 a 21 días, el porcentaje de personas con síntomas persistentes fue mucho mayor entre los diagnosticados con neuroborreliosis (50 %) que entre los con solo una erupción EM (16%). En otro estudio europeo, 5 años después del tratamiento de la neuroborreliosis, los síntomas persistentes fueron menos comunes entre los niños (15 %) que en los adultos (30 %), y en estos últimos fue menos común entre los tratados dentro de los 30 días posteriores al primer síntoma (16 %).) que entre los tratados más tarde (39%); entre aquellos con síntomas persistentes, el 54% tenía actividades diarias restringidas y el 19% estaba de baja por enfermedad o incapacitado.
Algunos datos sugieren que alrededor del 90 % de las parálisis faciales de Lyme tratadas con antibióticos se recuperan por completo una media de 24 días después de su aparición y la mayoría del resto se recupera con solo una anomalía leve. Sin embargo, en Europa, el 41 % de las personas tratadas por parálisis facial tenían otros síntomas persistentes en el seguimiento hasta 6 meses después, incluido el 28 % con entumecimiento o alteración de la sensibilidad y el 14 % con fatiga o problemas de concentración. Las parálisis en ambos lados de la cara se asocian con un tiempo de recuperación peor y más prolongado. Los datos históricos sugieren que las personas con parálisis facial que no reciben tratamiento se recuperan casi al mismo ritmo, pero el 88 % posteriormente tiene artritis de Lyme. Otra investigación muestra que la sincinesia (movimiento involuntario de un músculo facial cuando otro se mueve voluntariamente) puede volverse evidente solo de 6 a 12 meses después de que la parálisis facial parece resolverse, ya que los nervios dañados vuelven a crecer y, a veces, se conectan a los músculos incorrectos. La sincinesia se asocia con el uso de corticosteroides. En el seguimiento a más largo plazo, 16 a 23 % de las parálisis faciales de Lyme no se recuperan por completo.
En Europa, alrededor de una cuarta parte de las personas con síndrome de Bannwarth (radiculopatía de Lyme y meningitis linfocítica) tratadas con ceftriaxona intravenosa durante 14 días, una media de 30 días después de los primeros síntomas, tuvieron que volver a tratarse entre 3 y 6 meses después debido a una respuesta clínica insatisfactoria. o marcadores objetivos continuos de infección en líquido cefalorraquídeo; después de 12 meses, el 64 % se recuperó por completo, el 31 % tenía síntomas leves o infrecuentes no incapacitantes que no requerían el uso regular de analgésicos, y el 5 % tenía síntomas que eran incapacitantes o requerían un uso considerable de analgésicos. Los síntomas persistentes no incapacitantes más comunes fueron dolor de cabeza, fatiga, alteración de la sensibilidad, dolores articulares, alteraciones de la memoria, malestar general, dolor radicular, alteraciones del sueño, dolores musculares y alteraciones de la concentración. Los síntomas incapacitantes persistentes incluían parálisis facial y otras alteraciones del movimiento.
La recuperación de la neuroborreliosis tardía tiende a llevar más tiempo y ser menos completa que la de la neuroborreliosis temprana, probablemente debido al daño neurológico irreversible.
Aproximadamente la mitad de las personas con carditis de Lyme progresan hasta un bloqueo cardíaco completo, pero generalmente se resuelve en una semana. Otras anomalías de la conducción cardíaca de Lyme se resuelven típicamente dentro de las 6 semanas. Alrededor del 94 % de las personas se recupera por completo, pero el 5 % necesita un marcapasos permanente y el 1 % termina con un bloqueo cardíaco persistente (el porcentaje real puede ser mayor debido a casos no reconocidos). Las complicaciones miocárdicas de Lyme suelen ser leves y autolimitadas. Sin embargo, en algunos casos, la carditis de Lyme puede ser fatal.
Los tratamientos con antibióticos recomendados son efectivos en aproximadamente el 90 % de los casos de artritis de Lyme, aunque la inflamación puede tardar varios meses en desaparecer y, a menudo, es necesaria una segunda ronda de antibióticos. La artritis de Lyme refractaria a los antibióticos también se resuelve eventualmente, por lo general dentro de los 9 a 14 meses (rango de 4 meses a 4 años); Los FARME o la sinovectomía pueden acelerar la recuperación.
La reinfección no es infrecuente. En un estudio de EE. UU., entre el 6 y el 11 % de las personas tratadas por un sarpullido EM tuvieron otro sarpullido EM dentro de los 30 meses. La segunda erupción generalmente se debe a una infección por una cepa diferente de Borrelia.
Las personas que tienen síntomas subjetivos e inespecíficos, como fatiga, dolores articulares y musculares, o dificultades cognitivas durante más de seis meses después del tratamiento recomendado para Se dice que la enfermedad de Lyme tiene el síndrome de la enfermedad de Lyme posterior al tratamiento (PTLDS). A partir de 2016, se desconocía el motivo de los síntomas persistentes; la condición generalmente se maneja de manera similar a la fibromialgia o al síndrome de fatiga crónica.
Epidemiología
La enfermedad de Lyme ocurre regularmente en las regiones templadas del hemisferio norte. Se estima que 476,000 personas al año son diagnosticadas y tratadas por la enfermedad en los Estados Unidos. Es probable que este número sea una sobreestimación debido al sobrediagnóstico y el sobretratamiento. Más de 200.000 personas al año son diagnosticadas y tratadas en Europa. Existe una sugerencia de que las poblaciones de garrapatas y la aparición de la enfermedad de Lyme están aumentando y extendiéndose a nuevas áreas, debido en parte al aumento de las temperaturas del cambio climático. Sin embargo, los sistemas de enfermedades transmitidas por garrapatas son complejos y puede ser difícil determinar si los cambios se deben al cambio climático oa otros factores.
África
En el norte de África, B. burgdorferi sensu lato se ha identificado en Marruecos, Argelia, Egipto y Túnez.
La enfermedad de Lyme en África subsahariana se desconoce actualmente, pero la evidencia indica que puede ocurrir en humanos en esta región. La abundancia de huéspedes y vectores de garrapatas favorecería el establecimiento de la infección de Lyme en África. En África oriental, se informaron dos casos de enfermedad de Lyme en Kenia.
Asia
B. Las garrapatas infestadas con burgdorferi sensu lato se encuentran con mayor frecuencia en Japón, así como en el noroeste de China, Nepal, Tailandia y el extremo este de Rusia. Borrelia también se ha aislado en Mongolia.
Australia
La enfermedad de Lyme no se considera endémica de Australia. Si bien ha habido informes de personas que contrajeron la enfermedad de Lyme en Australia, e incluso evidencia de especies de Borrelia estrechamente relacionadas en garrapatas, la evidencia que vincula estos casos con la transmisión local es limitada. La investigación en curso sobre la resolución de especies potenciales de Borrelia a complejos de síntomas debilitantes atribuidos a garrapatas (DSCATT) en Australia está en curso.
Europa
En Europa, la enfermedad de Lyme está causada por la infección con una o más genoespecies europeas patógenas de la espiroqueta B. burgdorferi sensu lato, transmitida principalmente por la garrapata Ixodes ricinus. Casos de B. Las garrapatas infectadas por burgdorferi sensu lato se encuentran predominantemente en Europa central, particularmente en Eslovenia y Austria, pero se han aislado en casi todos los países del continente. El número de casos en el sur de Europa, como Italia y Portugal, es mucho menor. Los casos diagnosticados en algunos países occidentales, como Islandia, están aumentando. La enfermedad de Lyme es rara en Islandia. En promedio, se diagnostican alrededor de 6 a 7 casos cada año, principalmente infecciones localizadas que se presentan como eritema migratorio. Ninguno de los casos tenía un origen islandés definitivo y el número anual de casos no ha ido en aumento.
Reino Unido
En el Reino Unido, el número de casos de la enfermedad de Lyme confirmados por laboratorio ha ido en constante aumento desde que se introdujo la notificación voluntaria en 1986, cuando se registraron 68 casos en el Reino Unido e Irlanda combinados. En el Reino Unido hubo 23 casos confirmados en 1988 y 19 en 1990, pero 973 en 2009 y 953 en 2010. Las cifras provisionales de los 3 primeros trimestres de 2011 muestran un aumento del 26 % con respecto al mismo período de 2010.
Sin embargo, se cree que el número real de casos es significativamente mayor que lo sugerido por las cifras anteriores, ya que la Agencia de Protección de la Salud del Reino Unido estima que hay entre 2000 y 3000 casos por año (con un promedio de alrededor del 15% de las infecciones adquiridas en el extranjero), mientras que el Dr. Darrel Ho-Yen, Director del Laboratorio Escocés de Referencia de Toxoplasma y del Servicio Nacional de Pruebas de la Enfermedad de Lyme, cree que el número de casos confirmados debería multiplicarse por 10 "para tener en cuenta los casos mal diagnosticados, las pruebas que dan resultados falsos, los enfermos que no se hicieron la prueba, las personas infectadas pero que no muestran síntomas, las faltas de notificación y las personas infectadas que no consultan a un médico."
A pesar de que la enfermedad de Lyme (infección por Borrelia burgdorferi) es una enfermedad de notificación obligatoria en Escocia desde enero de 1990 y, por lo tanto, debe informarse sobre la base de la sospecha clínica, se cree que muchos médicos de cabecera desconocen el requisito. La notificación obligatoria, limitada únicamente a los resultados de las pruebas de laboratorio, se introdujo en todo el Reino Unido en octubre de 2010, en virtud de las Regulaciones de Protección de la Salud (Notificación) de 2010.
Aunque hay un mayor número de casos de la enfermedad de Lyme en New Forest, Salisbury Plain, Exmoor, South Downs, partes de Wiltshire y Berkshire, Thetford Forest y la costa oeste y las islas de Escocia, las garrapatas infectadas están muy extendidas, e incluso se puede encontrar en los parques de Londres. Un informe de 1989 encontró que el 25% de los trabajadores forestales en New Forest eran seropositivos, al igual que entre el 2% y el 4-5% de la población local general del área.
Las pruebas en perros domésticos realizadas en todo el país en 2009 indicaron que alrededor del 2,5 % de las garrapatas en el Reino Unido pueden estar infectadas, una cantidad considerablemente mayor de lo que se pensaba anteriormente. Se especula que el calentamiento global puede conducir a un aumento en la actividad de las garrapatas en el futuro, así como a un aumento en la cantidad de tiempo que las personas pasan en los parques públicos, aumentando así el riesgo de infección. Sin embargo, ninguna investigación publicada ha demostrado que esto sea así.
América del Norte
Muchos estudios en América del Norte han examinado los correlatos ecológicos y ambientales del número de personas afectadas por la enfermedad de Lyme. Un estudio de 2005 utilizando modelos de idoneidad climática de I. scapularis proyectó que el cambio climático provocaría un aumento general del 213 % en el hábitat adecuado para vectores para 2080, con expansiones hacia el norte en Canadá, mayor idoneidad en el centro de EE. UU. y disminución del hábitat adecuado y retracción de vectores en el sur de EE. UU. Una revisión de 2008 de los estudios publicados concluyeron que la presencia de bosques o áreas boscosas era la única variable que elevaba consistentemente el riesgo de enfermedad de Lyme, mientras que otras variables ambientales mostraban poca o ninguna concordancia entre los estudios. Los autores argumentaron que los factores que influyen en la densidad de garrapatas y el riesgo humano entre los sitios aún no se conocen bien, y que los estudios futuros deben realizarse durante períodos de tiempo más largos, estandarizarse más en todas las regiones e incorporar el conocimiento existente de la ecología regional de la enfermedad de Lyme.
Canadá
La gama de garrapatas capaces de transmitir la enfermedad de Lyme se ha ampliado desde un área limitada de Ontario para incluir áreas del sur de Quebec, Manitoba, el norte de Ontario, el sur de New Brunswick, el suroeste de Nueva Escocia y partes limitadas de Saskatchewan y Alberta, así como Columbia Británica. Se han reportado casos tan al este como la isla de Terranova. Una predicción basada en un modelo de Leighton et al. (2012) sugiere que el rango de la I. scapularis tick se expandirá a Canadá a razón de 46 km/año durante la próxima década, con el calentamiento de las temperaturas climáticas como el principal impulsor de una mayor velocidad de propagación.
México
Un estudio de 2007 sugiere que las infecciones por Borrelia burgdorferi son endémicas en México, a partir de cuatro casos informados entre 1999 y 2000.
Estados Unidos
La enfermedad de Lyme es la enfermedad transmitida por garrapatas más común en América del Norte y Europa, y una de las enfermedades infecciosas de más rápido crecimiento en los Estados Unidos. De los casos notificados a los CDC de los Estados Unidos, la proporción de infección por la enfermedad de Lyme es de 7,9 casos por cada 100.000 personas. En los diez estados donde la enfermedad de Lyme es más común, el promedio fue de 31,6 casos por cada 100.000 personas para el año 2005.
Aunque la enfermedad de Lyme se ha notificado en todos los estados debido a infecciones asociadas con viajes, alrededor del 99 % de todos los casos notificados se limitan a solo cinco áreas geográficas (Nueva Inglaterra, Atlántico Medio, Centro-Norte Este, Atlántico Sur y Centro-Norte Oeste). Los CDC implementaron la vigilancia nacional de los casos de la enfermedad de Lyme en 1991. Desde entonces, los criterios de notificación se han modificado varias veces. La definición de caso de vigilancia de 2022 clasifica los casos como confirmados, probables y sospechosos.
Los CDC enfatizan que, si bien los datos de vigilancia tienen limitaciones, son útiles debido a la "uniformidad, simplicidad y puntualidad". Si bien los casos no se notifican en las áreas de alta incidencia, es probable que se notifiquen en exceso en las áreas de baja incidencia. Además, los casos de vigilancia se informan por condado de residencia y no donde necesariamente se contrajo una infección.
El número de casos notificados de la enfermedad ha ido en aumento, al igual que las regiones endémicas de América del Norte. Por ejemplo, B. burgdorferi sensu lato anteriormente se pensaba que su capacidad para mantenerse en un ciclo enzoótico en California estaba obstaculizada, porque se suponía que la gran población de lagartos diluiría el número de personas afectadas por B. burgdorferi en poblaciones locales de garrapatas; Desde entonces, esto se ha cuestionado, ya que algunas pruebas han sugerido que los lagartos pueden infectarse.
Excepto por un estudio en Europa, gran parte de los datos que implican a los lagartos se basan en la detección de ADN de la espiroqueta y no ha demostrado que los lagartos puedan infectar a las garrapatas que se alimentan de ellos. Como algunos experimentos sugieren que las lagartijas son refractarias a la infección con Borrelia, parece probable que su participación en el ciclo enzoótico sea más compleja y específica de la especie.
Mientras que B. burgdorferi se asocia más con garrapatas alojadas en ciervos de cola blanca y ratones de patas blancas, Borrelia afzelii se detecta con mayor frecuencia en garrapatas vectoras que se alimentan de roedores y Borrelia garinii y Borrelia valaisiana parecen estar asociadas con aves. Tanto los roedores como las aves son huéspedes reservorios competentes para B. burgdorferi sensu stricto. La resistencia de una genoespecies de espiroquetas de la enfermedad de Lyme a las actividades bacteriolíticas de la vía alternativa del complemento de varias especies de huéspedes puede determinar su asociación con el huésped reservorio.
Pueden existir varias condiciones similares pero aparentemente distintas, causadas por varias especies o subespecies de Borrelia en América del Norte. Una afección regionalmente restringida que puede estar relacionada con la infección por Borrelia es la enfermedad cutánea asociada con garrapatas del sur (STARI), también conocida como enfermedad de Masters. Amblyomma americanum, conocida comúnmente como la garrapata estrella solitaria, es reconocida como el principal vector de STARI. En algunas partes de la distribución geográfica de STARI, la enfermedad de Lyme es bastante rara (p. ej., Arkansas), por lo que las personas en estas regiones que experimentan síntomas similares a los de Lyme, especialmente si siguen a la picadura de una garrapata estrella solitaria, deben considerar STARI como un posibilidad. Por lo general, es una afección más leve que la enfermedad de Lyme y, por lo general, responde bien al tratamiento con antibióticos.
En los últimos años ha habido de 5 a 10 casos al año de una enfermedad similar a la de Lyme en Montana. Ocurre principalmente en bolsas a lo largo del río Yellowstone en el centro de Montana. Las personas han desarrollado una erupción roja en forma de ojo de buey alrededor de una picadura de garrapata seguida de semanas de fatiga y fiebre.
Los efectos de la enfermedad de Lyme son comparables entre hombres y mujeres. Se ve afectada una amplia gama de grupos de edad, aunque el número de casos es más alto entre los 10 y los 19 años. Por razones desconocidas, la enfermedad de Lyme es siete veces más común entre los asiáticos.
América del Sur
En Brasil se identificó una enfermedad tipo Lyme conocida como síndrome de Baggio-Yoshinari, causada por microorganismos que no pertenecen a la B. burgdorferi sensu lato y transmitida por garrapatas de los géneros Amblyomma y Rhipicephalus. El primer caso reportado de BYS en Brasil se realizó en 1992 en Cotia, São Paulo.
Etimología
La enfermedad de Lyme se diagnosticó como una afección separada por primera vez en 1975 en Lyme, Connecticut.
Fuera de los EE. UU. y del mundo de habla inglesa, la enfermedad se conoce como borreliosis.
Historia
La historia evolutiva de la genética de Borrelia burgdorferi ha sido objeto de estudios recientes. Un estudio encontró que antes de la reforestación que acompañó al abandono de las granjas poscoloniales en Nueva Inglaterra y la migración masiva hacia el medio oeste que ocurrió a principios del siglo XIX, la enfermedad de Lyme estuvo presente durante miles de años en Estados Unidos y se había propagado a lo largo de con sus anfitriones de garrapatas desde el noreste hasta el medio oeste.
John Josselyn, quien visitó Nueva Inglaterra en 1638 y nuevamente entre 1663 y 1670, escribió: "Hay un número infinito de garrapatas colgando de los arbustos durante el verano que se adhieren a la ropa del hombre y se meten en su calzones, devorándose en poco tiempo en la misma carne de un hombre. He visto las medias de los que han pasado por el bosque cubiertas de ellas."
Esto también lo confirman los escritos de Peter Kalm, un botánico sueco que fue enviado a América por Linneo, y que descubrió que los bosques de Nueva York "abundan" con garrapatas cuando lo visitó en 1749. Cuando se volvió sobre el viaje de Kalm 100 años después, los bosques habían desaparecido y la bacteria de Lyme probablemente se había aislado en algunos focos a lo largo de la costa noreste, Wisconsin y Minnesota.
Quizás la primera descripción detallada de lo que ahora se conoce como enfermedad de Lyme apareció en los escritos de John Walker después de una visita a la isla de Jura (Deer Island) en la costa oeste de Escocia en 1764. Da una buena descripción tanto de los síntomas de la enfermedad de Lyme (con "dolor exquisito [en] las partes internas de las extremidades") y de la propia garrapata vector, que describe como un "gusano" con un cuerpo que es "de color rojizo y de forma comprimida con una fila de pies a cada lado" que "penetra en la piel". Muchas personas de esta zona de Gran Bretaña emigraron a América del Norte entre 1717 y finales del siglo XVIII.
El examen de especímenes preservados en museos ha encontrado ADN de Borrelia en una garrapata Ixodes ricinus infectada de Alemania que data de 1884, y de un ratón infectado de Cape Cod que murió en 1894. La autopsia de 2010 de Ötzi the Iceman, una momia de 5300 años de antigüedad, reveló la presencia de la secuencia de ADN de Borrelia burgdorferi, lo que lo convierte en el ser humano más antiguo conocido con la enfermedad de Lyme.
Los primeros estudios europeos de lo que ahora se conoce como enfermedad de Lyme describieron sus manifestaciones cutáneas. El primer estudio data de 1883 en Breslau, Alemania (ahora Wrocław, Polonia), donde el médico Alfred Buchwald describió a un hombre que durante 16 años había tenido un trastorno degenerativo de la piel ahora conocido como acrodermatitis crónica atrófica.
En una conferencia de investigación de 1909, el dermatólogo sueco Arvid Afzelius presentó un estudio sobre una lesión en forma de anillo en expansión que había observado en una mujer mayor después de la picadura de una garrapata de oveja. Llamó a la lesión eritema migrans. La afección de la piel que ahora se conoce como linfocitoma borrelial se describió por primera vez en 1911.
La historia moderna de la comprensión médica de la enfermedad, incluida su causa, diagnóstico y tratamiento, ha sido difícil.
Los problemas neurológicos posteriores a las picaduras de garrapatas se reconocieron a partir de la década de 1920. Los médicos franceses Garin y Bujadoux describieron a un granjero con radiculitis sensorial dolorosa acompañada de meningitis leve después de una picadura de garrapata. También se notó una gran erupción en forma de anillo, aunque los médicos no la relacionaron con la meningoradiculitis. En 1930, el dermatólogo sueco Sven Hellerström fue el primero en proponer la EM y se relacionaron los síntomas neurológicos tras la picadura de una garrapata. En la década de 1940, el neurólogo alemán Alfred Bannwarth describió varios casos de meningitis linfocítica crónica y polirradiculoneuritis, algunos de los cuales se acompañaban de lesiones cutáneas eritematosas.
Carl Lennhoff, que trabajaba en el Instituto Karolinska de Suecia, creía que las espiroquetas provocaban muchas enfermedades de la piel. En 1948, utilizó una tinción especial para observar microscópicamente lo que creía que eran espiroquetas en varios tipos de lesiones cutáneas, incluida la EM. Aunque más tarde se demostró que sus conclusiones eran erróneas, se despertó el interés por el estudio de las espiroquetas. En 1949, Nils Thyresson, que también trabajaba en el Instituto Karolinska, fue el primero en tratar la ACA con penicilina. En la década de 1950, la relación entre la picadura de garrapata, el linfocitoma, la EM y el síndrome de Bannwarth se reconoció en toda Europa, lo que llevó al uso generalizado de la penicilina para el tratamiento en Europa.
En 1970, un dermatólogo de Wisconsin llamado Rudolph Scrimenti reconoció una lesión EM en una persona después de recordar un artículo de Hellerström que había sido reimpreso en una revista científica estadounidense en 1950. Este fue el primer caso documentado de EM en los Estados Unidos.. Basado en la literatura europea, trató a la persona con penicilina.
El síndrome completo que ahora se conoce como enfermedad de Lyme no se reconoció hasta que se identificó un grupo de casos que originalmente se pensó que era artritis reumatoide juvenil en tres ciudades del sureste de Connecticut en 1975, incluidas las ciudades de Lyme y Old Lyme, lo que le dio a la enfermedad su origen. nombre popular Esto fue investigado por los médicos David Snydman y Allen Steere del Servicio de Inteligencia Epidémica, y por otros de la Universidad de Yale, incluido Stephen Malawista, a quien se le acredita como co-descubridor de la enfermedad. El reconocimiento de que la gente en los Estados Unidos tenía EM llevó al reconocimiento de que la "artritis de Lyme" fue una manifestación de la misma condición transmitida por garrapatas conocida en Europa.
Antes de 1976, los elementos de B. burgdorferi sensu lato fueron llamadas o conocidas como meningopolineuritis transmitida por garrapatas, síndrome de Garin-Bujadoux, síndrome de Bannwarth, enfermedad de Afzelius, rodilla de Montauk o fiebre por garrapatas de oveja. Desde 1976, la enfermedad se conoce con mayor frecuencia como enfermedad de Lyme, borreliosis de Lyme o simplemente borreliosis.
En 1980, Steere, et al., comenzaron a probar regímenes de antibióticos en adultos con la enfermedad de Lyme. En el mismo año, el epidemiólogo del Departamento de Salud del Estado de Nueva York, Jorge Benach, proporcionó a Willy Burgdorfer, investigador del Laboratorio Biológico de las Montañas Rocosas, colecciones de I. dammini [scapularis] de Shelter Island, Nueva York, un área conocida como endémica de Lyme como parte de una investigación en curso sobre la fiebre maculosa de las Montañas Rocosas. Al examinar las garrapatas en busca de rickettsias, Burgdorfer notó "espiroquetas mal teñidas, más bien largas, enrolladas irregularmente". Un examen más detallado reveló espiroquetas en el 60% de las garrapatas. Burgdorfer acreditó su familiaridad con la literatura europea para darse cuenta de que las espiroquetas podrían ser la "causa largamente buscada de la ECM y la enfermedad de Lyme". Benach le proporcionó más garrapatas de Shelter Island y sueros de personas diagnosticadas con la enfermedad de Lyme. El investigador del Centro de Ciencias de la Salud de la Universidad de Texas, Alan Barbour, "ofreció su experiencia para cultivar y caracterizar inmunoquímicamente el organismo". Posteriormente, Burgdorfer confirmó su descubrimiento al aislar, de personas con la enfermedad de Lyme, espiroquetas idénticas a las que se encuentran en las garrapatas. En junio de 1982, publicó sus hallazgos en Science y la espiroqueta recibió el nombre de Borrelia burgdorferi en su honor.
Después de la identificación de B. burgdorferi como el agente causante de la enfermedad de Lyme, se seleccionaron antibióticos para la prueba, guiados por sensibilidades antibióticas in vitro, incluidos antibióticos de tetraciclina, amoxicilina, cefuroxima axetilo, penicilina intravenosa e intramuscular y ceftriaxona intravenosa. El mecanismo de transmisión de las garrapatas también fue objeto de mucha discusión. B. burgdorferi se identificaron espiroquetas en la saliva de las garrapatas en 1987, lo que confirma la hipótesis de que la transmisión se produjo a través de las glándulas salivales de las garrapatas.
Sociedad, cultura y amp; controversia
Cambios de paisaje & urbanización
La urbanización y otros factores antropogénicos pueden estar implicados en la propagación de la enfermedad de Lyme a los humanos. En muchas áreas, la expansión de los vecindarios suburbanos ha llevado a la deforestación gradual de las áreas boscosas circundantes y a un mayor contacto fronterizo entre los humanos y las áreas densas de garrapatas. La expansión humana también ha resultado en una reducción de los depredadores que cazan ciervos, así como ratones, ardillas listadas y otros roedores pequeños, los principales reservorios de la enfermedad de Lyme. Como consecuencia del mayor contacto humano con el huésped y el vector, la probabilidad de transmisión de la enfermedad ha aumentado considerablemente. Los investigadores están investigando posibles vínculos entre el calentamiento global y la propagación de enfermedades transmitidas por vectores, incluida la enfermedad de Lyme.
El efecto de dilución
Dada esta dinámica hábitat-huésped, algunos investigadores han comenzado a postular si el efecto de dilución podría mitigar la propagación de la enfermedad de Lyme. El efecto de dilución es una hipótesis que predice que un aumento en la biodiversidad del huésped resultará en una disminución en el número de vectores infectados con B. Burgdorferi. La investigación científica ha demostrado que la prevalencia de la infección por ninfas (NIP, por sus siglas en inglés) disminuye a medida que aumenta el número de especies huésped, lo que respalda el efecto de dilución. Dicho esto, estos hallazgos no deben malinterpretarse para sugerir que existe una relación directa entre la disminución de NIP y la disminución del riesgo epidemiológico, ya que esto aún no se ha probado. Además, es importante tener en cuenta que, hasta el momento, el efecto de dilución solo se admite en el noreste de los Estados Unidos y se ha refutado en otras partes del mundo que también experimentan altas tasas de incidencia de la enfermedad de Lyme.
Enfermedad de Lyme crónica
El término "enfermedad de Lyme crónica" es controvertido y no reconocido en la literatura médica, y la mayoría de las autoridades médicas desaconsejan el tratamiento con antibióticos a largo plazo para la enfermedad de Lyme. Los estudios han demostrado que la mayoría de las personas diagnosticadas con "enfermedad de Lyme crónica" no tienen evidencia objetiva de infección anterior o actual con B. burgdorferi o son personas que deben clasificarse como portadoras del síndrome de la enfermedad de Lyme posterior al tratamiento (PTLDS), que se define como síntomas inespecíficos continuos o recidivantes (como fatiga, dolor musculoesquelético y quejas cognitivas) en una persona previamente tratado por la enfermedad de Lyme.
El documental de 2008 Under Our Skin es conocido por promover teorías controvertidas y no reconocidas sobre la "enfermedad de Lyme crónica".
Otros animales
Perros
La prevención de la enfermedad de Lyme es un paso importante para mantener seguros a los perros en áreas endémicas. La educación preventiva y una serie de medidas preventivas están disponibles. Primero, para los dueños de perros que viven cerca o que frecuentan áreas infestadas de garrapatas, la vacunación de rutina de sus perros es un paso importante.
Otra medida preventiva crucial es el uso de acaricidas persistentes, como repelentes tópicos o pesticidas que contienen triazapentadienos (Amitraz), fenilpirazoles (Fipronil) o permetrina (piretroides). Estos acaricidas se dirigen principalmente a las etapas adultas de las garrapatas portadoras de Lyme y reducen la cantidad de garrapatas reproductivamente activas en el medio ambiente. Las formulaciones de estos ingredientes están disponibles en una variedad de formas tópicas, que incluyen manchas, aerosoles, polvos, collares impregnados, soluciones y champús.
Examinar a un perro en busca de garrapatas después de haber estado en un área infestada de garrapatas es una medida de precaución importante para la prevención de la enfermedad de Lyme. Los puntos clave para examinar incluyen la cabeza, el cuello y las orejas.
En los perros, un pronóstico grave a largo plazo puede resultar en enfermedad glomerular, que es una categoría de daño renal que puede causar enfermedad renal crónica. Los perros también pueden experimentar una enfermedad articular crónica si la enfermedad no se trata. Sin embargo, la mayoría de los casos de enfermedad de Lyme en perros dan como resultado una recuperación completa con, ya veces sin, tratamiento con antibióticos. En casos raros, la enfermedad de Lyme puede ser fatal tanto para humanos como para perros.
Caballos
Si bien la enfermedad de Lyme puede ocurrir en caballos, no todas las infecciones con B. burgdorferi se asocia con síntomas. En especial, la detección de anticuerpos específicos frente a B. burgdorferi por sí solo no es suficiente para un diagnóstico de la enfermedad de Lyme equina y no se recomiendan pruebas inespecíficas de anticuerpos.
Contenido relacionado
Ley de Fick
Presión oncótica
Memoria explícita
Sociología médica
Memoria implícita