Efectos electrónicos (Química)
Los efectos electrónicos son un grupo de fenómenos electroquímicos que influencian la estructura, reactividad y propiedades de las moléculas sin llegar a ser ni un enlace tradicional ni un efecto estérico. Cada uno de estos efectos describe la forma como se mueven y distribuyen los electrones a lo largo de la molécula, afectando su comportamiento químico, y aunque existen al menos 8 efectos electrónicos, los principales son el efecto inductivo y el efecto resonante o conjugativo.
Estos fenómenos son especialmente relevantes en la química orgánica, donde la interacción entre la estructura electrónica y la geometría molecular (estereoquímica) es fundamental, por lo que a veces también reciben el nombre de efectos estereoelectrónicos.
El término "efecto electrónico" se refiere al flujo de electrones desde o hacia un átomo específico a través de los enlaces químicos, o del espacio colindante. Este flujo de electrones puede disminuir o aumentar la densidad electrónica en ciertas áreas de la molécula, lo que se traduce en la formación de grupos aceptores de electrones (GAE) o grupos donadores de electrones (GDE), respectivamente.
Aunque los efectos electrónicos se consideran distintos de los efectos estéricos, que se refieren a las interacciones espaciales entre las partes de la molécula, la convergencia de ambos efectos se denomina también efectos estereoelectrónicos. Todo esto, subraya la compleja interacción entre la disposición espacial de los átomos en una molécula y su configuración electrónica, y resalta la importancia de considerar ambos aspectos para entender realmente la química de las sustancias.
HSD
Tipos de efectos electrónicos
- Inducción
- Conjugación
- Hiperconjugación
- Simetría orbital
- Interacciones electrostáticas
- Número cuántico de espín
- Efecto Jahn-Teller
- Efecto anomérico
- Influencia trans
La inducción es la redistribución de la densidad de electrones a través de una estructura enlazada sigma tradicional de acuerdo con la electronegatividad de los átomos involucrados. El efecto inductivo cae en cada enlace sigma involucrado, limitando su efecto a solo unos pocos enlaces.
La conjugación es una redistribución de la densidad electrónica similar a la inducción pero transmitida a través de enlaces pi interconectados. La conjugación no solo se ve afectada por la electronegatividad de los átomos conectados, sino también por la posición de los pares de electrones solitarios con respecto al sistema pi. Los efectos electrónicos se pueden transmitir a través de un sistema pi, lo que permite que su influencia se extienda más allá de la inducción.
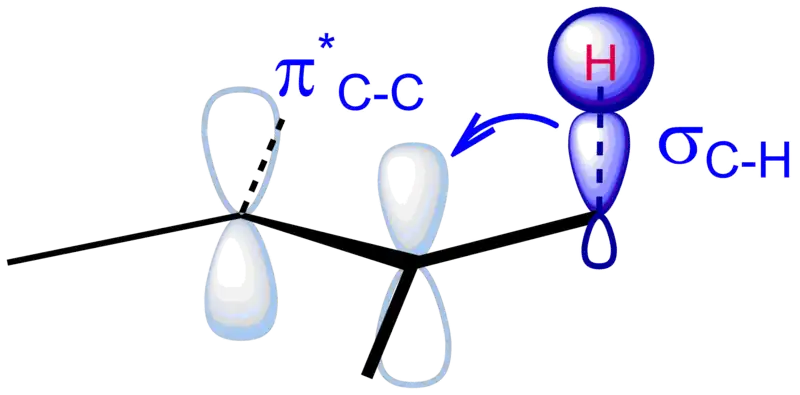
La hiperconjugación es la interacción estabilizadora que resulta de la interacción de los electrones en un enlace sigma (generalmente CH o CC) con un orbital p adyacente vacío (o parcialmente lleno) no enlazante o un orbital π antienlazante o un orbital sigma antienlazante para dar un orbital molecular extendido que aumenta la estabilidad del sistema. La hiperconjugación se puede utilizar para explicar fenómenos como el efecto gauche y el efecto anomérico.
La simetría orbital es importante cuando se trata de orbitales que contienen componentes direccionales como p y d. Un ejemplo de tal efecto son los complejos de metales de transición d planos cuadrados de espín bajo. Estos complejos existen como complejos planos cuadrados debido a la direccionalidad de los orbitales d del centro metálico a pesar de una menor congestión estérica en una estructura geométrica tetraédrica. Este es un ejemplo simple de muchos ejemplos variados, que incluyen aspectos de reacciones pericíclicas como la reacción de Diels-Alder, entre otras.
Las interacciones electrostáticas incluyen fuerzas de atracción y repulsión asociadas con la acumulación de carga en una molécula. Las interacciones electrostáticas son generalmente demasiado débiles para ser consideradas enlaces tradicionales o se les impide formar un enlace tradicional, posiblemente por un efecto estérico. Un enlace generalmente se define como dos átomos que se acercan más que la suma de sus radios de Van der Waal. El enlace de hidrógeno limita con ser un "enlace" real y una interacción electrostática. Mientras que una interacción electrostática atractiva se considera un "enlace" si se vuelve demasiado fuerte, una interacción electrostática repulsiva es siempre un efecto electrostático independientemente de la fuerza. Un ejemplo de un efecto repulsivo es una molécula que se retuerce para minimizar las interacciones culómbicas de los átomos que tienen cargas similares.
El estado de espín electrónico en su forma más simple describe el número de electrones desapareados en una molécula. La mayoría de las moléculas, incluidas las proteínas, los carbohidratos y los lípidos que constituyen la mayor parte de la vida, no tienen electrones desapareados, incluso cuando están cargadas. Estas moléculas se denominan moléculas singlete, ya que sus electrones apareados tienen un solo estado de espín. Por el contrario, el dioxígeno en condiciones ambientales tiene dos electrones desapareados. El dioxígeno es una molécula triplete, ya que los dos electrones desapareados permiten tres estados de espín. La reacción de una molécula triplete con una molécula singlete está prohibida en mecánica cuántica. Esta es la razón principal por la que existe una barrera de reacción muy alta para la reacción termodinámicamente extremadamente favorable de moléculas orgánicas singulete con oxígeno triplete.
Los estados de espín electrónico son más complejos para los metales de transición. Para comprender la reactividad de los metales de transición, es esencial comprender el concepto de configuración electrónica d, así como la configuración de alto y bajo espín. Por ejemplo, un complejo de metal de transición d de espín bajo suele ser plano cuadrado inerte por sustitución sin electrones desapareados. Por el contrario, un complejo de metal de transición d de alto espín suele ser octaédrico, lábil por sustitución, con dos electrones desapareados.
El efecto Jahn-Teller es la distorsión geométrica de moléculas no lineales bajo ciertas situaciones. Cualquier molécula no lineal con un estado básico electrónico degenerado sufrirá una distorsión geométrica que eliminará esa degeneración. Esto tiene el efecto de reducir la energía total. La distorsión de Jahn-Teller es especialmente común en ciertos complejos de metales de transición; por ejemplo, complejos de cobre (II) con 9 d electrones.
La influencia trans es la influencia que tiene un ligando en un complejo cuadrado u octaédrico sobre el enlace con el ligando trans. Es causado por efectos electrónicos y se manifiesta como el alargamiento de los enlaces trans y como un efecto sobre la energía global del complejo.
Diferencia entre efectos electrónicos y estéricos
La estructura, las propiedades y la reactividad de una molécula dependen de interacciones de enlace directas que incluyen enlaces covalentes, enlaces iónicos, enlaces de hidrógeno y otras formas de enlace. Este enlace proporciona un esqueleto molecular básico que es modificado por fuerzas repulsivas que generalmente se consideran efectos estéricos. Los efectos básicos de enlace y estéricos a veces son insuficientes para explicar muchas estructuras, propiedades y reactividad. Por lo tanto, los efectos estéricos a menudo se contrastan y complementan con efectos electrónicos, lo que implica la influencia de efectos como la inducción, la conjunción, la simetría orbital, las interacciones electrostáticas y el estado de espín. Hay efectos electrónicos más esotéricos, pero estos se encuentran entre los más importantes cuando se considera la estructura química y la reactividad.
Se desarrolló un procedimiento computacional especial para separar los efectos estéricos y electrónicos de un grupo arbitrario en la molécula y revelar su influencia en la estructura y la reactividad.
Contenido relacionado
Esfalerita
Grupo hidroxi
Gadolinio