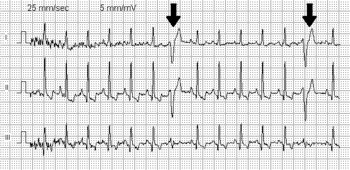
Contracción ventricular prematura
Una contracción ventricular prematura (PVC) es un evento común donde el latido del corazón es iniciado por las fibras de Purkinje en los ventrículos en lugar del nódulo sinoauricular. Las PVC pueden no causar síntomas o pueden percibirse como un "latido saltado" o sentido como palpitaciones en el pecho. Los PVC no suelen suponer ningún peligro.
Los eventos eléctricos del corazón detectados por el electrocardiograma (ECG) permiten distinguir fácilmente una CVP de un latido cardíaco normal. Sin embargo, las CVP muy frecuentes pueden ser sintomáticas de una afección cardíaca subyacente (como la miocardiopatía arritmogénica del ventrículo derecho). Además, las CVP muy frecuentes (más del 20 % de todos los latidos del corazón) se consideran un factor de riesgo de miocardiopatía inducida por arritmia, en la que el músculo cardíaco se vuelve menos eficaz y pueden desarrollarse síntomas de insuficiencia cardíaca. Por lo tanto, se recomienda la ecografía del corazón en personas con PVC frecuentes.
Si las CVP son frecuentes o molestas, se pueden usar medicamentos (bloqueadores beta o ciertos bloqueadores de los canales de calcio). Las CVP muy frecuentes en personas con miocardiopatía dilatada pueden tratarse con ablación por radiofrecuencia.
Signos y síntomas
Aunque hay muchos síntomas posibles asociados con las PVC, es posible que las PVC no presenten ningún síntoma. Las PVC se pueden percibir como un latido cardíaco salteado, un latido fuerte, palpitaciones o mareos. También pueden causar dolor en el pecho, sensación de desmayo, fatiga o hiperventilación después del ejercicio. Los síntomas pueden ser más pronunciados en momentos de estrés. Las mujeres pueden ser más conscientes de las PVC en el momento del período menstrual.
Las contracciones ventriculares prematuras pueden estar asociadas con una enfermedad cardíaca subyacente y, por lo tanto, ciertas características se obtienen de forma rutinaria: la presencia de signos de enfermedad cardíaca o antecedentes conocidos de enfermedad cardíaca (p. ej., infarto de miocardio previo), así como enfermedad cardíaca o Muerte cardiaca en familiares cercanos. También son preocupantes las PVC y las palpitaciones asociadas con el síncope (pérdida transitoria del conocimiento) o provocadas por el esfuerzo. El examen físico se enfoca en identificar evidencia de enfermedad cardíaca subyacente.
Causas
Las contracciones ventriculares prematuras ocurren en personas sanas de cualquier edad, pero son más frecuentes en los ancianos y en los hombres. En una proporción muy significativa de personas se producen de forma espontánea sin causa conocida.
Algunas posibles causas subyacentes de las PVC incluyen:
Causas no cardíacas
- Exceso de adrenalina
- Anemia
- Exceso de Catecolamina
- Ciertos medicamentos como antidepresivos tricíclicos, digoxina, simpatizante, aminofilina
- Anormalidades químicas (electrolíticas) en la sangre (por ejemplo hipokalemia (farasio de sangre baja), que pueden ocurrir en aquellos que toman diuréticos ("píldoras de agua") e hipomagnesemia (deficiencia de magnesio).
- El contacto con la carina (trachea/bronchi) al realizar succión médica estimula el nervio vago
- Drogas/sustancias como:
- Anfetaminas
- Alcohol
- Caffeine
- Cocaine
- Nicotina
- Theobromine
- Hipercapnia (intoxicación por CO2)
- Hipertensión (presión arterial alta)
- Hipertiroidismo
- Alto calcio de sangre
- Hipoxia y/o hipercapnia
- Falta de sueño / agotamiento
- Sarcoidosis
- Fumar
- Stress
- Ansiedad
Causas cardíacas
- Cualquier enfermedad cardíaca estructural que altera las vías de conducción eléctrica debido a alteraciones del tejido
- Cardiomiopatía, hipertrófica o dilatada
- Infarto de miocardio
- Miocarditis
- Contusión miocárdica
- Prolapso de válvula mitral
Fisiopatología
Normalmente, los impulsos pasan a través de ambos ventrículos casi al mismo tiempo y las ondas de despolarización de los dos ventrículos se cancelan parcialmente en el ECG. Sin embargo, cuando ocurre un PVC, el impulso casi siempre viaja a través de un solo haz de fibras, por lo que no hay efecto de neutralización; esto da como resultado la onda QRS de alto voltaje en el electrocardiógrafo.
Hay tres explicaciones fisiológicas principales para las contracciones ventriculares prematuras: aumento de la automaticidad del ganglio ectópico, señalización de reentrada y activación por reperfusión/tóxica.
El automatismo ganglionar mejorado ectópico sugiere focos de células de marcapasos valvulares subpulmonares que tienen un potencial subumbral para activarse. El ritmo básico del corazón eleva estas células al umbral, lo que precipita un latido ectópico. Este proceso es el mecanismo subyacente de las arritmias debidas al exceso de catecolaminas y algunas deficiencias de electrolitos, particularmente el bajo nivel de potasio en sangre, conocido como hipopotasemia.
La reentrada ocurre cuando hay un área de bloqueo unidireccional en las fibras de Purkinje y una segunda área de conducción lenta. Esta condición se observa con frecuencia en pacientes con cardiopatía subyacente que crea áreas de conducción diferencial y recuperación debido a la cicatrización o isquemia del miocardio. Durante la activación ventricular, el área de conducción lenta de un haz activa el bloqueo posterior de las fibras del haz del otro haz una vez que el resto del ventrículo se ha recuperado. Esto resulta en un latido extra. La reentrada puede producir latidos ectópicos únicos o desencadenar una taquicardia paroxística.
Se considera que los latidos desencadenados se deben a posdespolarizaciones desencadenadas por el potencial de acción precedente. Estos se observan a menudo en pacientes con arritmias ventriculares debido a la toxicidad de la digoxina y la terapia de reperfusión después de un infarto de miocardio (IM).
Esta ectopia de los ventrículos, cuando se asocia con un corazón estructuralmente normal, ocurre con mayor frecuencia en el tracto de salida del ventrículo derecho (TSVD) debajo de la válvula pulmonar. Se cree que el mecanismo detrás de esto es una mayor automaticidad frente a la actividad desencadenada.
Base molecular
Hay varias explicaciones moleculares diferentes para las PVC.
- Exceso de calcio: Una explicación es básicamente debido a una mayor cantidad de AMP(cAMP) cíclico en las células musculares de los ventrículos del corazón que conducen al aumento del flujo de iones de calcio en la célula. Esto puede ocurrir por las siguientes razones:
- Activación del sistema nervioso simpático, por ansiedad y/o estrés fisiológico, por ejemplo hipovolemia causada por deshidratación o sangrado. Esta activación puede causar una liberación de catecolaminas como la epinefrina (adrenalina) que pueden unirse al receptor adrenergico beta-1 (β1 receptores) en los miocitos cardíacos, activando un tipo de proteína nucleótido de guanosina llamada proteína Gs. Este tipo de proteína estimula la producción de cAMP, aumentando finalmente el flujo de iones de calcio del espacio extracelular y del reticulum sarcoplasmático al citosol.
Esto tiene el efecto de (1) aumentar la fuerza de la contracción (inotropía) y (2) despolarizar el miocito más rápidamente (cronotropía). Por lo tanto, los miocitos ventriculares son más irritables de lo habitual, y pueden depolarizar espontáneamente antes de que el nodo SA despolarice. Otras moléculas simpatizantes como las anfetaminas y la cocaína también causarán este efecto. - Los inhibidores de la fosfodiesterasa, como la cafeína, afectan directamente la cascada de transducción de señales de coupled G al inhibir la enzima que cataliza el desglose de cAMP, lo que da lugar a una mayor concentración de iones de calcio en el citosol.
- Activación del sistema nervioso simpático, por ansiedad y/o estrés fisiológico, por ejemplo hipovolemia causada por deshidratación o sangrado. Esta activación puede causar una liberación de catecolaminas como la epinefrina (adrenalina) que pueden unirse al receptor adrenergico beta-1 (β1 receptores) en los miocitos cardíacos, activando un tipo de proteína nucleótido de guanosina llamada proteína Gs. Este tipo de proteína estimula la producción de cAMP, aumentando finalmente el flujo de iones de calcio del espacio extracelular y del reticulum sarcoplasmático al citosol.
- deficiencia de potasio: Las concentraciones de iones de potasio son un determinante importante en la magnitud del potencial electroquímico de las células, y la hipokalemia hace más probable que las células despolaricen espontáneamente. La hipercalcemia tiene un efecto similar, aunque clínicamente es de menor preocupación.
- deficiencia de magnesio: iones de magnesio afectan el flujo de iones de calcio, y afectan la función de la Na+/K+ ATPase, y son necesarios para mantener los niveles de potasio. Por lo tanto, el bajo magnesio de sangre también hace más probable la depolarización espontánea.
- Daño miocardio: El daño existente al miocardio también puede provocar PVCs. La cicatrización miocárdica que ocurre en el infarto de miocardio y también en la reparación quirúrgica de la cardiopatía congénita puede interrumpir el sistema de conducción del corazón y también puede irritar los miocitos ventriculares viables circundantes, hacerlos más propensos a despolarizar espontáneamente. La inflamación del miocardio (como ocurre en la miocarditis) y la inflamación sistémica causan aumentos de citocinas, que pueden afectar las propiedades eléctricas de los miocitos y pueden ser en última instancia responsables de causar irritabilidad de los miocitos.
Diagnóstico
Las PVC se pueden encontrar incidentalmente en pruebas cardíacas, como un electrocardiograma de 12 derivaciones (ECG/EKG) realizado por otro motivo. En aquellos con síntomas que sugieren complejos ventriculares prematuros, el ECG/EKG es la primera investigación que puede identificar CVP, así como otros problemas del ritmo cardíaco que pueden causar síntomas similares. Si los síntomas son poco frecuentes, se pueden usar otras formas de registro continuo de los latidos del corazón, como un monitor Holter de 24 o 48 horas o incluso registradores de 14 a 30 días si los síntomas son muy ocasionales. La ventaja de estos monitores es que permiten cuantificar la cantidad de latidos anormales ("carga") y aseguran que no haya arritmias cardíacas presentes que puedan requerir atención, como taquicardia ventricular. Si los síntomas están asociados con el ejercicio, es posible que se requiera una prueba de esfuerzo cardíaco supervisada para reproducir la anomalía. En concreto, si presenta taquicardia ventricular inducida por el ejercicio, requeriría un tratamiento específico. Si las PVC se suprimen con el ejercicio, este es un hallazgo alentador.
En electrocardiografía (ECG o Holter) las contracciones ventriculares prematuras tienen una apariencia específica de los complejos QRS y ondas T, que son diferentes de las lecturas normales. Por definición, una PVC ocurre antes que el latido regular normalmente conducido. Posteriormente, el tiempo entre la CVP y el siguiente latido normal es mayor como resultado de una pausa compensatoria. Las CVP pueden distinguirse de las contracciones auriculares prematuras porque la pausa compensatoria es más larga después de las contracciones ventriculares prematuras, además de una diferencia en la apariencia del QRS.
En algunas personas, las CVP ocurren con un patrón predecible. Dos PVC seguidos se denominan dobletes y tres PVC seguidos son trillizos. Dependiendo de si hay uno, dos o tres latidos normales (sinusales) entre cada PVC, el ritmo se denomina bigeminismo, trigeminismo o cuadrigeminismo. Si ocurren 3 o más CVP consecutivas seguidas, se puede denominar taquicardia ventricular. La forma precisa del QRS puede dar una indicación de dónde precisamente en el músculo cardíaco surge la actividad eléctrica anormal. Si alguien tiene PVC que tienen todas la misma apariencia, se consideran "monofocales", si las PVC tienen una apariencia diferente, se consideran "multifocales".
Tratamiento
Las PVC aisladas con características benignas y sin enfermedad cardíaca subyacente no requieren tratamiento, especialmente si hay síntomas limitados.
El tratamiento más efectivo es la eliminación de los desencadenantes (en particular, dejar de usar sustancias como la cafeína y ciertas drogas, como el tabaco). Si es frecuente, es posible utilizar:
- Medicamentos
- Antiarritmicos: estos agentes alteran los mecanismos electrofisiológicos responsables de los PVCs. En el estudio CAST de sobrevivientes de infarto de miocardio encainida y flecainida, se demostró que, aunque esos fármacos podrían suprimir PVC, también aumentaron el riesgo de muerte. Sin embargo, mientras que la moricicina aumentó la tasa de mortalidad cuando se utiliza con diuréticos, redujo la frecuencia de muertes cuando se utiliza solo.
- Bloqueadores de beta: no afectan o reducen directamente la ocurrencia de PVC, pero reducen la contractilidad cardíaca que hace que los PVCs sean menos obvios para una persona; posiblemente reducen los PVC inducidos de catecolamina (en personas sensibles a la catecolamina) debido a la adrenalina no alcanzando tanto el nodo sinusal.
- Bloqueadores de canales de calcio
- Sustitución de electrolitos
- Suplementos de magnesio (por ejemplo, citrato de magnesio, orotate, Maalox, etc.)
- Suplementos de potasio (por ejemplo, cloruro de potasio con ión de cítrato)
- Tratamiento de ablación de catéter de radiofrecuencia. Se recomienda para personas con disfunción ventricular y/o tachyarrythmia o PVC muy frecuente (concentrado20% en 24 h) y función ventricular normal. Este procedimiento es una manera de destruir el área del tejido cardíaco que está causando las contracciones irregulares características de PVC utilizando energía de frecuencia radio.
- Implantable cardioverter-defibrillator
- Modificación del estilo de vida
- Los individuos frecuentemente estresados deben considerar la terapia, o unirse a un grupo de apoyo.
Pronóstico
Las PVC son inofensivas, pero las PVC frecuentes pueden aumentar el riesgo de desarrollar cardiomiopatía, que puede afectar en gran medida la función cardíaca. En una escala más grave y grave, las CVP muy frecuentes pueden acompañar a una enfermedad cardíaca subyacente.
Las personas que no tienen cardiopatías (con fracciones de eyección superiores al 40%) tienen los mismos pronósticos a largo plazo que la minoría de personas sin CVP en las 24 horas. Los datos emergentes también sugieren que la ectopia ventricular muy frecuente puede estar asociada con la miocardiopatía a través de un mecanismo que se cree que es similar al de la miocardiopatía crónica asociada a la estimulación del ventrículo derecho. Para los pacientes con cardiopatía estructural crónica subyacente y ectopia compleja, la mortalidad aumenta significativamente.
En un metanálisis de 11 estudios, las personas con CVP frecuentes (≥ una vez durante un registro electrocardiográfico estándar o ≥30 veces durante un registro de 1 hora) tenían un riesgo de muerte cardíaca dos veces mayor que los participantes con CVP ocasionales. Aunque la mayoría de los investigadores intentaron excluir a los sujetos de alto riesgo, como aquellos con antecedentes de enfermedad cardiovascular, no evaluaron a los participantes para detectar una enfermedad cardíaca estructural subyacente.
En un estudio de 239 personas con CVP frecuentes (>1000 latidos/día) y sin cardiopatía estructural (es decir, en presencia de una función cardíaca normal), no hubo eventos cardíacos graves durante 5,6 años en promedio, pero hubo correlación entre prevalencia de CVP y disminución de la fracción de eyección y aumento de la dimensión diastólica del ventrículo izquierdo. En este estudio, la ausencia de enfermedad cardíaca se estableció mediante ecocardiografía, resonancia magnética cardíaca en 63 personas y monitoreo Holter.
Otro estudio ha sugerido que, en ausencia de cardiopatía estructural, incluso las CVP frecuentes (> 60/h o 1/min) y complejas se asocian con un pronóstico benigno. Fue un estudio de 70 personas seguidas por 6,5 años en promedio. El estado de salud se verificó mediante un extenso examen cardiológico no invasivo, aunque el cateterismo cardíaco de un subgrupo reveló enfermedad arterial coronaria grave en el 19%. La supervivencia global fue mejor de lo esperado.
Por otro lado, el Framingham Heart Study informó que las PVC frecuentes en personas sanas se asociaron con un aumento del doble en el riesgo de mortalidad por todas las causas, infarto de miocardio y muerte cardíaca. En hombres con enfermedad coronaria y en mujeres con o sin enfermedad coronaria, las arritmias complejas o frecuentes no se asociaron con un mayor riesgo. Las personas en riesgo pueden tener enfermedad coronaria subclínica. Estos resultados de Framingham han sido criticados por la falta de medidas rigurosas para excluir el posible factor de confusión de la enfermedad cardíaca subyacente.
En el estudio ARIC de 14 783 personas seguidas durante 15 a 17 años, aquellos con PVC detectado durante el ECG de 2 minutos, y sin hipertensión o diabetes al principio, tenían un aumento del riesgo de accidente cerebrovascular en un 109 %. La hipertensión o la diabetes, ambos factores de riesgo de accidente cerebrovascular, no cambiaron significativamente el riesgo de accidente cerebrovascular para las personas con CVP. Es posible que las PVC identificaran a las personas con riesgo de accidente cerebrovascular con presión arterial y tolerancia alterada a la glucosa en un continuo de riesgo por debajo de los umbrales de diagnóstico convencionales para la hipertensión y la diabetes. Aquellos en el estudio ARIC con cualquier CVP tenían un riesgo de insuficiencia cardíaca aumentado en un 63 % y eran > dos veces más probabilidades de morir de enfermedad coronaria (CHD). El riesgo también fue mayor para las personas con o sin cardiopatía coronaria inicial.
En el estudio de Niigata de 63 386 personas con un período de seguimiento de 10 años, los sujetos con CVP durante un registro de 10 segundos tenían el triple de riesgo de fibrilación auricular que los que no tenían CVP, independientemente de estos factores de riesgo: edad; sexo masculino; alto índice de masa corporal simple (un posible indicador de obesidad); hipertensión (presión arterial sistólica y diastólica dentro de ciertos límites anormales); y diabetes
Reducir las CVP muy frecuentes (>20 %) mediante fármacos antiarrítmicos o mediante ablación con catéter mejora significativamente el rendimiento cardíaco.
Estudios recientes han demostrado que aquellos sujetos con CVP extremadamente frecuentes (varios miles al día) pueden desarrollar miocardiopatía dilatada. En estos casos, si las CVP se reducen o eliminan (por ejemplo, mediante terapia de ablación), la miocardiopatía retrocede.
Epidemiología
Las CVP únicas son comunes en personas sanas. Cuando se usa el monitoreo ambulatorio de 24 horas, hasta el 80 por ciento de las personas aparentemente sanas tienen CVP ocasionales. Las tasas varían según la edad, siendo extremadamente raras para los menores de 11 años y extremadamente comunes para los mayores de 75 años. Estas diferencias pueden deberse a las tasas de presión arterial alta y aterosclerosis, que son más fáciles de encontrar en las personas mayores. En 101 personas libres de cardiopatía durante el seguimiento Holter de 24 horas, 39 tenían al menos 1 PVC y 4 al menos 100. La cardiopatía se excluyó después del examen físico, radiografía de tórax, ECG, ecocardiografía, prueba de esfuerzo máximo, prueba de esfuerzo derecho. y cateterismo del corazón izquierdo y angiografía coronaria. En 122.043 pilotos de la Fuerza Aérea de los Estados Unidos y solicitantes de cadetes durante aproximadamente 48 segundos de ECG, el 0,78 % (952 hombres) tenía PVC en todos los grupos de edad, pero con una mayor incidencia con el aumento de la edad. La ectopia ventricular es más prevalente en hombres que en mujeres de la misma edad. Los datos de grandes estudios basados en la población indican que la prevalencia es menor en mujeres blancas jóvenes sin enfermedad cardíaca y mayor en individuos afroamericanos mayores con hipertensión.
Contenido relacionado
Ley de Fick
Presión oncótica
Memoria explícita
Sociología médica
Memoria implícita