Conjugado (teoría ácido-base)
Un ácido conjugado, dentro de la teoría ácido-base de Brønsted-Lowry, es un compuesto químico que se forma cuando un ácido dona un protón (H+) a una base; en otras palabras, es una base con un ion de hidrógeno agregado, ya que en la reacción inversa pierde un ion de hidrógeno. Por otro lado, una base conjugada es lo que queda después de que un ácido haya donado un protón durante una reacción química. Por lo tanto, una base conjugada es una especie formada por la eliminación de un protón de un ácido, ya que en la reacción inversa puede ganar un ion de hidrógeno. Debido a que algunos ácidos son capaces de liberar múltiples protones, la base conjugada de un ácido puede ser ácida.
En resumen, esto se puede representar como la siguiente reacción química:
Johannes Nicolaus Brønsted y Martin Lowry introdujeron la teoría de Brønsted-Lowry, que proponía que cualquier compuesto que puede transferir un protón a cualquier otro compuesto es un ácido, y el compuesto que acepta el protón es una base. Un protón es una partícula nuclear con una unidad de carga eléctrica positiva; se representa con el símbolo H+ porque constituye el núcleo de un átomo de hidrógeno, es decir, un catión de hidrógeno.
Un catión puede ser un ácido conjugado y un anión puede ser una base conjugada, dependiendo de qué sustancia esté involucrada y qué teoría ácido-base sea el punto de vista. El anión más simple que puede ser una base conjugada es el electrón solvatado cuyo ácido conjugado es el hidrógeno atómico.
Reacciones ácido-base
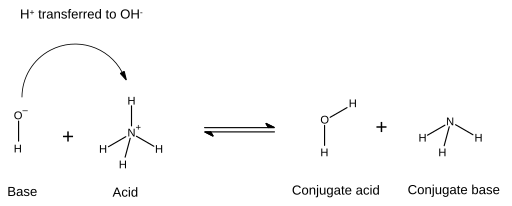
En una reacción ácido-base, un ácido más una base reaccionan para formar una base conjugada más un ácido conjugado. El ácido pierde un protón y la base gana un protón. En los diagramas químicos que ilustran esto, el nuevo enlace formado entre la base y el protón se muestra mediante una flecha que convencionalmente comienza en un par de electrones de la base y cuya punta de flecha termina en el ion de hidrógeno (protón) que será transferido:
En este caso, la molécula de agua es el ácido conjugado del ion hidróxido después de que este último recibió el ion hidrógeno donado por el amonio. Por otro lado, el amoníaco es la base conjugada del amonio ácido después de que el amonio haya donado un ion de hidrógeno y producido la molécula de agua. Además, OH− puede considerarse como la base conjugada de H
2O, ya que el agua molécula dona un protón para dar NH+
4 en la reacción inversa. Los términos "ácido", "base", "ácido conjugado" y "base conjugada" no son fijos para una determinada especie química, sino que son intercambiables según la reacción que tenga lugar.
Fuerza de los conjugados
La fuerza de un ácido conjugado es directamente proporcional a su constante de disociación. Si un ácido conjugado es fuerte, su disociación tendrá una constante de equilibrio mayor y se favorecerán los productos de la reacción. La fuerza de una base conjugada puede verse como la tendencia de la especie a "jalar" protones de hidrógeno hacia sí mismo. Si una base conjugada se clasifica como fuerte, se "aguantará" al protón de hidrógeno cuando está en solución y su ácido no se disociará.
Si una especie se clasifica como un ácido fuerte, su base conjugada será débil. Un ejemplo de este caso sería la disociación del ácido clorhídrico HCl en agua. Como el HCl es un ácido fuerte (se disocia en gran medida), su base conjugada (Cl−
) será un conjugado débil base. Por lo tanto, en este sistema, la mayoría H+
tendrá la forma de un ion hidronio H
3O+
en lugar de unirse a un anión Cl− y la base conjugada será más débil que una molécula de agua.
Por otro lado, si una especie se clasifica como un ácido débil, su base conjugada no será necesariamente una base fuerte. Considere que el acetato, la base conjugada del ácido acético, tiene una constante de disociación de bases (Kb) de aproximadamente 5.6×10−10, por lo que es una base débil. Para que una especie tenga una base conjugada fuerte tiene que ser un ácido muy débil, como el agua por ejemplo.
Identificación de pares ácido-base conjugados
Para identificar el ácido conjugado, busque el par de compuestos que están relacionados. La reacción ácido-base se puede ver en un sentido de antes y después. El antes es el lado del reactivo de la ecuación, el después es el lado del producto de la ecuación. El ácido conjugado en el lado posterior de una ecuación gana un ion de hidrógeno, por lo que en el lado anterior de la ecuación, el compuesto que tiene un ion de hidrógeno menos del ácido conjugado es la base. La base conjugada en el lado posterior de la ecuación perdió un ion de hidrógeno, por lo que en el lado anterior de la ecuación, el compuesto que tiene un ion de hidrógeno más de la base conjugada es el ácido.
Considere la siguiente reacción ácido-base:
- HNO
3 + H
2O → H
3O+
+ NO−
3
Ácido nítrico (HNO
3) es un ácido porque dona un protón al molécula de agua y su base conjugada es nitrato (NO−
3). La molécula de agua actúa como base porque recibe el catión hidrógeno (protón) y su ácido conjugado es el ion hidronio (H
3O+
).
| Ecuación | Acid | Base | Base conyugal | Ácido conjugado |
|---|---|---|---|---|
| HClO 2 + H 2O → ClO− 2 + H 3O+ | HClO2 | H2O | ClO−2 | H3O+ |
| ClO− + H 2O → HClO + Oh.− | H 2O | ClO− | Oh- | HClO |
| HCl + H 2PO− 4 → Cl− + H 3PO 4 | HCl | H2PO−4 | Cl - | H3PO4 |
Aplicaciones
Un uso de los ácidos y bases conjugados se encuentra en los sistemas tampón, que incluyen una solución tampón. En un tampón, se utiliza un ácido débil y su base conjugada (en forma de sal), o una base débil y su ácido conjugado, para limitar el cambio de pH durante un proceso de titulación. Los tampones tienen aplicaciones químicas orgánicas y no orgánicas. Por ejemplo, además de los tampones que se utilizan en los procesos de laboratorio, la sangre humana actúa como tampón para mantener el pH. El amortiguador más importante en nuestro torrente sanguíneo es el amortiguador de ácido carbónico-bicarbonato, que previene cambios drásticos de pH cuando CO
2. Esto funciona como tal:
Además, aquí hay una tabla de búferes comunes.
Agente de amortiguación pKa rango de pH útil Ácido cítrico 3.13, 4.76, 6.40 2.1 - 7.4 Ácido acético 4.8 3.8 - 5.8 KH2PO4 7.2 6.2 - 8.2 CHES 9.3 8.3 a 10.3 Borate 9.24 8.25 - 10.25
Una segunda aplicación común con un compuesto orgánico sería la producción de un tampón con ácido acético. Si es ácido acético, un ácido débil con la fórmula CH
< sub style="font-size:inherit;line-height:inherit;vertical-align:baseline">3COOH, se convirtió en una solución tampón, tendría que ser combinado con su base conjugada CH
3COO−
en forma de una sal La mezcla resultante se denomina tampón de acetato, que consta de CH
3COOH y acuoso CH
3COONa. El ácido acético, junto con muchos otros ácidos débiles, sirven como componentes útiles de tampones en diferentes entornos de laboratorio, cada uno útil dentro de su propio rango de pH.
La solución de lactato de Ringer es un ejemplo en el que la base conjugada de un ácido orgánico, ácido láctico, CH
3CH(OH)CO< sup style="font-size:inherit;line-height:inherit;vertical-align:baseline">−
2 se combina con cationes de sodio, calcio y potasio y aniones de cloruro en agua destilada que juntos forman un líquido que es isotónico en relación con la sangre humana y se utiliza para la reanimación con líquidos después de la pérdida de sangre debido a un traumatismo, una cirugía o un bu rn lesión.
Tabla de ácidos y sus bases conjugadas
A continuación se tabulan varios ejemplos de ácidos y sus bases conjugadas; observe cómo difieren en solo un protón (ion H+). La fuerza del ácido disminuye y la fuerza de la base conjugada aumenta en la tabla.
| Acid | Base conyugal |
|---|---|
| H 2F+ Fluoronium ion | fluoruro de hidrógeno HF |
| HCl Hidroclorático | Cl− Chloride ion |
| H2SO4 Ácido sulfúrico | HSO− 4 Sulfato de hidrógeno ionbisulfate ion) |
| HNO3 Ácido nitrico | NO− 3 Nitrato ion |
| H3O+ Hydronium ion | H2O Agua |
| HSO− 4 Sulfato de hidrógeno ion | SO2 - 2 4 Sulfate ion |
| H3PO4 Ácido fósforo | H2PO− 4 Dihidrogen fosfato ion |
| CH3COOH Ácido acético | CH3COO− Acetato ion |
| HF Ácido hidrofluorico | F− Fluoride ion |
| H2CO3 Ácido carbónico | HCO− 3 Hidrogen carbonato ion |
| H2S Hydrosulfuric acid | HS− Sulfuro de hidrógeno ion |
| H2PO− 4 Dihidrogen fosfato ion | HPO2 - 2 4 Hidrogen fosfato ion |
| NH+ 4 iión de amonio | NH3 Amoníaco |
| H2O Water (pH=7) | Oh.− Hydroxide ion |
| HCO− 3 Hidrogencarbonato (bicarbonato) ion | CO2 - 2 3 Carbonate ion |
Tabla de bases y sus ácidos conjugados
En contraste, aquí hay una tabla de bases y sus ácidos conjugados. De manera similar, la fuerza de la base disminuye y la fuerza del ácido conjugado aumenta en la tabla.
| Base | Ácido conjugado |
|---|---|
| C 2H 5NH 2 Ethylamine | C 2H 5NH+ 3 Ethylammonium ion |
| CH 3NH 2 Methylamine | CH 3NH+ 3 Methylammonium ion |
| NH 3 Amoníaco | NH+ 4 iión de amonio |
| C 5H 5N Pyridine | C 5H 6N+ Pyridinium |
| C 6H 5NH 2 Aniline | C 6H 5NH+ 3 Phenylammonium ion |
| C 6H 5CO− 2 Benzoate ion | C 6H 6CO 2 Ácido benzoico |
| F− Fluoride ion | HF fluoruro de hidrógeno |
| PO3 - 3 4 Phosphate ion | HPO2 - 2 4 Hidrogen fosfato ion |
| Oh.− Hydroxide ion | H2O Water (neutral, pH 7) |
| HCO− 3 Bicarbonato | H 2CO 3 Ácido carbónico |
| CO2 - 2 3 Carbonate ion | HCO− 3 Bicarbonato |
| Br− Bromine | HBr Bromuro de hidrógeno |
| HPO2 - 2 4 Hydrogen Phosphate | H 2PO− 4 Hidrogen fosfato ion |
| Cl− Chloride ion | HCl Cloruro de hidrógeno |
| H 2O Agua | H 3O+ Hydronium ion |
| Nitrite ion | Ácido nitroso |
Contenido relacionado
Erich Huckel
Fenotiazina
Brecha de banda