Ciclo de Krebs
El ciclo del ácido cítrico, ciclo del ácido tricarboxílico o ciclo de Krebs, es una serie de reacciones químicas para liberar energía almacenada a través de la oxidación de acetil-CoA derivado de carbohidratos, grasas y proteínas. El ciclo de Krebs es utilizado por organismos que respiran (a diferencia de los organismos que fermentan) para generar energía, ya sea mediante respiración anaeróbica o respiración aeróbica. Además, el ciclo proporciona precursores de ciertos aminoácidos, así como el agente reductor NADH, que se utilizan en muchas otras reacciones. Su importancia central para muchas vías bioquímicas sugiere que fue uno de los primeros componentes del metabolismo y puede haberse originado de forma abiogénica.A pesar de que se califica como un 'ciclo', no es necesario que los metabolitos sigan una sola ruta específica; Se han reconocido al menos tres segmentos alternativos del ciclo del ácido cítrico.
El nombre de esta ruta metabólica se deriva del ácido cítrico (un ácido tricarboxílico, a menudo llamado citrato, ya que la forma ionizada predomina en el pH biológico) que se consume y luego se regenera mediante esta secuencia de reacciones para completar el ciclo. El ciclo consume acetato (en forma de acetil-CoA) y agua, reduce el NAD a NADH, liberando dióxido de carbono. El NADH generado por el ciclo del ácido cítrico se introduce en la vía de fosforilación oxidativa (transporte de electrones). El resultado neto de estas dos vías estrechamente vinculadas es la oxidación de nutrientes para producir energía química utilizable en forma de ATP.
En las células eucariotas, el ciclo del ácido cítrico ocurre en la matriz de la mitocondria. En las células procarióticas, como las bacterias, que carecen de mitocondrias, la secuencia de reacción del ciclo del ácido cítrico se realiza en el citosol con el gradiente de protones para la producción de ATP a través de la superficie de la célula (membrana plasmática) en lugar de la membrana interna de la mitocondria. El rendimiento total de compuestos que contienen energía del ciclo TCA es tres NADH, uno FADH 2 y un GTP.
Descubrimiento
Varios de los componentes y reacciones del ciclo del ácido cítrico fueron establecidos en la década de 1930 por la investigación de Albert Szent-Györgyi, quien recibió el Premio Nobel de Fisiología o Medicina en 1937 específicamente por sus descubrimientos relacionados con el ácido fumárico, un componente clave del ciclo. Hizo este descubrimiento al estudiar el músculo de la pechuga de paloma. Debido a que este tejido mantiene su capacidad oxidativa mucho después de romperse en el molino Latapie y liberarse en soluciones acuosas, el músculo de la pechuga de la paloma estaba muy bien calificado para el estudio de las reacciones oxidativas. El ciclo del ácido cítrico en sí mismo fue finalmente identificado en 1937 por Hans Adolf Krebs y William Arthur Johnson mientras estaban en la Universidad de Sheffield,por lo que el primero recibió el Premio Nobel de Fisiología o Medicina en 1953, y por lo que el ciclo a veces se denomina "ciclo de Krebs".
Visión de conjunto
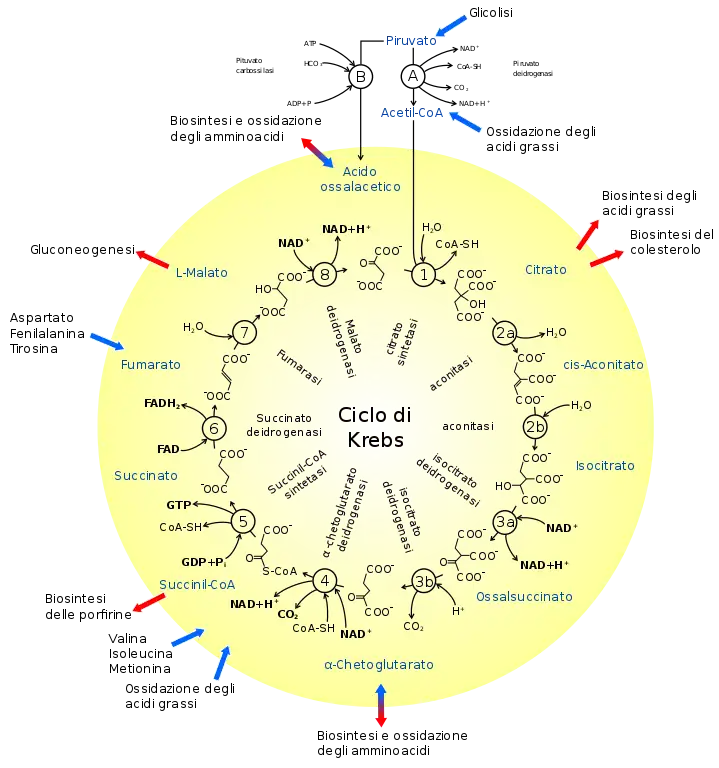
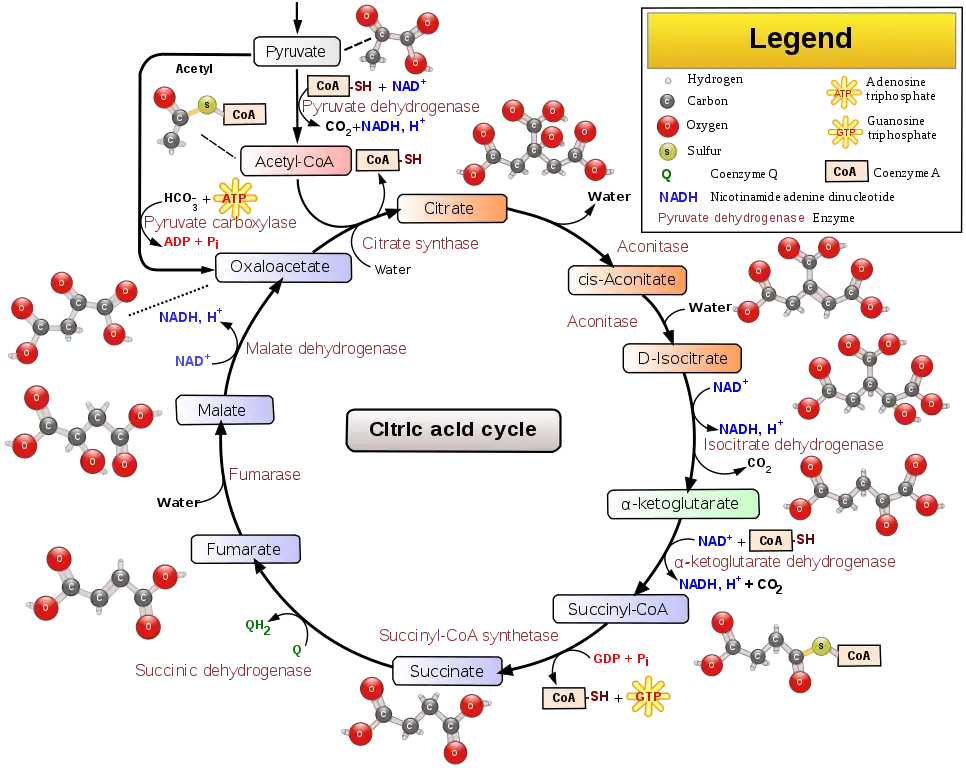
El ciclo del ácido cítrico es una vía metabólica clave que conecta el metabolismo de carbohidratos, grasas y proteínas. Las reacciones del ciclo son realizadas por ocho enzimas que oxidan completamente el acetato (una molécula de dos carbonos), en forma de acetil-CoA, en dos moléculas de dióxido de carbono y agua. A través del catabolismo de azúcares, grasas y proteínas, se produce el producto orgánico de dos carbonos acetil-CoA que ingresa al ciclo del ácido cítrico. Las reacciones del ciclo también convierten tres equivalentes de dinucleótido de nicotinamida y adenina (NAD) en tres equivalentes de NAD reducido (NADH), un equivalente de dinucleótido de flavina y adenina (FAD) en un equivalente de FADH 2 y un equivalente de difosfato de guanosina (GDP) y fosfato inorgánico (P i) en un equivalente de trifosfato de guanosina (GTP). El NADH y el FADH 2 generados por el ciclo del ácido cítrico son, a su vez, utilizados por la vía de fosforilación oxidativa para generar ATP rico en energía.
Una de las principales fuentes de acetil-CoA proviene de la descomposición de azúcares por glucólisis que produce piruvato que, a su vez, es descarboxilado por el complejo piruvato deshidrogenasa que genera acetil-CoA de acuerdo con el siguiente esquema de reacción:
CH 3 C(=O)C(=O)Opiruvato+ HSCoA + NAD →
CH3C (=O) SCoAacetil-CoA+ NADH + CO2
El producto de esta reacción, acetil-CoA, es el punto de partida del ciclo del ácido cítrico. Acetil-CoA también se puede obtener de la oxidación de ácidos grasos. A continuación se muestra un esquema del ciclo:
- El ciclo del ácido cítrico comienza con la transferencia de un grupo acetilo de dos carbonos del acetil-CoA al compuesto aceptor de cuatro carbonos (oxalacetato) para formar un compuesto de seis carbonos (citrato).
- El citrato luego pasa por una serie de transformaciones químicas, perdiendo dos grupos carboxilo como CO 2. Los carbonos perdidos como CO 2 se originan de lo que era oxaloacetato, no directamente del acetil-CoA. Los carbonos donados por la acetil-CoA pasan a formar parte del esqueleto de carbono del oxaloacetato después de la primera vuelta del ciclo del ácido cítrico. La pérdida de los carbonos donados por acetil-CoA como CO 2 requiere varias vueltas del ciclo del ácido cítrico. Sin embargo, debido al papel del ciclo del ácido cítrico en el anabolismo, es posible que no se pierdan, ya que muchos intermediarios del ciclo del ácido cítrico también se utilizan como precursores para la biosíntesis de otras moléculas.
- La mayoría de los electrones puestos a disposición por los pasos oxidativos del ciclo se transfieren a NAD, formando NADH. Por cada grupo acetilo que entra en el ciclo del ácido cítrico, se producen tres moléculas de NADH. El ciclo del ácido cítrico incluye una serie de reacciones de reducción de oxidación en las mitocondrias.
- Además, los electrones del paso de oxidación del succinato se transfieren primero al cofactor FAD de la succinato deshidrogenasa, reduciéndolo a FADH 2, y finalmente a ubiquinona (Q) en la membrana mitocondrial, reduciéndolo a ubiquinol (QH 2) que es un sustrato de la cadena de transferencia de electrones a nivel del Complejo III.
- Por cada NADH y FADH 2 que se producen en el ciclo del ácido cítrico, se generan 2,5 y 1,5 moléculas de ATP en la fosforilación oxidativa, respectivamente.
- Al final de cada ciclo, el oxalacetato de cuatro carbonos se ha regenerado y el ciclo continúa.
Pasos
Hay diez pasos básicos en el ciclo del ácido cítrico, como se describe a continuación. El ciclo se alimenta continuamente de nuevo carbono en forma de acetil-CoA, entrando en el paso 0 de la tabla.
| Sustratos | productos | Enzima | tipo de reacción | Comentario | |
|---|---|---|---|---|---|
| 0 / 10 | Oxalacetato + Acetil CoA + H 2 O | Citrato + CoA-SH | Citrato sintasa | Condensación aldólica | irreversible, extiende el oxalacetato 4C a una molécula 6C |
| 1 | Citrato | cis -Aconitate + H 2 O | aconitasa | Deshidración | isomerización reversible |
| 2 | cis -Aconitate + H 2 O | isocitrato | Hidratación | ||
| 3 | Isocitrato + NAD | Oxalosuccinato + NADH + H | Isocitrato deshidrogenasa | Oxidación | genera NADH (equivalente a 2,5 ATP) |
| 4 | oxalosuccinato | α-cetoglutarato + CO 2 | descarboxilación | etapa limitante de la velocidad, irreversible, genera una molécula 5C | |
| 5 | α-cetoglutarato + NAD + CoA-SH | Succinil-CoA + NADH + CO 2 | α-cetoglutaratodeshidrogenasa, pirofosfato de tiamina, ácido lipoico, Mg++, transsuccinitasa | Descarboxilación oxidativa | etapa irreversible, genera NADH (equivalente a 2,5 ATP), regenera la cadena 4C (excluyendo CoA) |
| 6 | Succinil-CoA + GDP + Pi | Succinato + CoA-SH + GTP | Succinil-CoA sintetasa | fosforilación a nivel de sustrato | o ADP→ATP en lugar de GDP→GTP, genera 1 ATP o equivalente.La reacción de condensación de GDP + Pi y la hidrólisis de succinil-CoA involucran el H 2 O necesario para la ecuación balanceada. |
| 7 | Succinato + ubiquinona (Q) | Fumarato + ubiquinol (QH 2) | succinato deshidrogenasa | Oxidación | utiliza FAD como grupo prostético (FAD→FADH 2 en el primer paso de la reacción) en la enzima.Estos dos electrones son luego transferidos a QH 2 durante el Complejo II de la ETC, donde generan el equivalente a 1.5 ATP |
| 8 | Fumarato + H 2 O | L -malato | Fumarasa | Hidratación | Hidratación del doble enlace CC |
| 9 | L -Malato + NAD | Oxalacetato + NADH + H | Malato deshidrogenasa | Oxidación | reversible (de hecho, el equilibrio favorece al malato), genera NADH (equivalente a 2,5 ATP) |
| 10 / 0 | Oxalacetato + Acetil CoA + H 2 O | Citrato + CoA-SH | Citrato sintasa | Condensación aldólica | Es lo mismo que el paso 0 y reinicia el ciclo. La reacción es irreversible y extiende el oxalacetato 4C a una molécula 6C. |
Dos átomos de carbono se oxidan a CO 2, la energía de estas reacciones se transfiere a otros procesos metabólicos a través de GTP (o ATP), y como electrones en NADH y QH 2. El NADH generado en el ciclo del ácido cítrico puede oxidarse más tarde (donar sus electrones) para impulsar la síntesis de ATP en un tipo de proceso llamado fosforilación oxidativa. FADH 2 se une covalentemente a la succinato deshidrogenasa, una enzima que funciona tanto en el CAC como en la cadena de transporte de electrones mitocondrial en la fosforilación oxidativa. FADH 2, por lo tanto, facilita la transferencia de electrones a la coenzima Q, que es el aceptor final de electrones de la reacción catalizada por el complejo succinato:ubiquinona oxidorreductasa, actuando también como intermediario en la cadena de transporte de electrones.
Las mitocondrias en animales, incluidos los humanos, poseen dos succinil-CoA sintetasas: una que produce GTP a partir de GDP y otra que produce ATP a partir de ADP. Las plantas tienen el tipo que produce ATP (succinil-CoA sintetasa formadora de ADP). Varias de las enzimas del ciclo pueden estar vagamente asociadas en un complejo proteico multienzimático dentro de la matriz mitocondrial.
El GTP formado por la succinil-CoA sintetasa formadora de GDP puede ser utilizado por la nucleósido-difosfato quinasa para formar ATP (la reacción catalizada es GTP + ADP → GDP + ATP).
Productos
Los productos de la primera vuelta del ciclo son un GTP (o ATP), tres NADH, un FADH 2 y dos CO 2.
Debido a que se producen dos moléculas de acetil-CoA a partir de cada molécula de glucosa, se requieren dos ciclos por molécula de glucosa. Por tanto, al final de dos ciclos, los productos son: dos GTP, seis NADH, dos FADH 2 y cuatro CO 2.
| Descripción | reactivos | productos |
| La suma de todas las reacciones en el ciclo del ácido cítrico es: | Acetil-CoA + 3 NAD + FAD + GDP + P i + 2 H 2 O | → CoA-SH + 3 NADH + FADH 2 + 3 H + GTP + 2 CO 2 |
| Combinando las reacciones que ocurren durante la oxidación del piruvato con las que ocurren durante el ciclo del ácido cítrico, se obtiene la siguiente reacción general de oxidación del piruvato: | Ion piruvato + 4 NAD + FAD + GDP + P i + 2 H 2 O | → 4 NADH + FADH 2 + 4 H + GTP + 3 CO 2 |
| Combinando la reacción anterior con las que ocurren en el curso de la glucólisis, se obtiene la siguiente reacción general de oxidación de glucosa (excluyendo las reacciones en la cadena respiratoria): | Glucosa + 10 NAD + 2 FAD + 2 ADP + 2 GDP + 4 P i + 2 H 2 O | → 10 NADH + 2 FADH 2 + 10 H + 2 ATP + 2 GTP + 6 CO 2 |
Las reacciones anteriores están balanceadas si P i representa el ion H 2 PO 4, ADP y GDP los iones ADP y GDP, respectivamente, y ATP y GTP los iones ATP y GTP, respectivamente.
El número total de moléculas de ATP obtenidas después de la oxidación completa de una glucosa en la glucólisis, el ciclo del ácido cítrico y la fosforilación oxidativa se estima entre 30 y 38.
Eficiencia
El rendimiento máximo teórico de ATP a través de la oxidación de una molécula de glucosa en la glucólisis, el ciclo del ácido cítrico y la fosforilación oxidativa es 38 (suponiendo 3 equivalentes molares de ATP por NADH equivalente y 2 ATP por FADH 2). En eucariotas, se generan dos equivalentes de NADH y cuatro equivalentes de ATP en la glucólisis, que tiene lugar en el citoplasma. El transporte de dos de estos equivalentes de NADH a la mitocondria consume dos equivalentes de ATP, lo que reduce la producción neta de ATP a 36. Además, las ineficiencias en la fosforilación oxidativa debidas a la fuga de protones a través de la membrana mitocondrial y al deslizamiento de la ATP sintasa/protón bomba comúnmente reduce el rendimiento de ATP de NADH y FADH 2 a menos del rendimiento máximo teórico.Los rendimientos observados están, por lo tanto, más cerca de ~2.5 ATP por NADH y ~1.5 ATP por FADH 2, lo que reduce aún más la producción neta total de ATP a aproximadamente 30. Una evaluación del rendimiento total de ATP con proporciones de protones a ATP recientemente revisadas proporciona una estimación de 29,85 ATP por molécula de glucosa.
Variación
Si bien el ciclo del ácido cítrico en general está muy conservado, existe una variabilidad significativa en las enzimas que se encuentran en diferentes taxones (tenga en cuenta que los diagramas en esta página son específicos de la variante de la ruta de los mamíferos).
Existen algunas diferencias entre eucariotas y procariotas. La conversión de D- treo - isocitrato en 2-oxoglutarato está catalizada en eucariotas por el EC 1.1.1.41 dependiente de NAD, mientras que los procariotas emplean el EC 1.1.1.42 dependiente de NADP. De manera similar, la conversión de (S)-malato en oxaloacetato es catalizada en eucariotas por el EC 1.1.1.37 dependiente de NAD, mientras que la mayoría de los procariotas utilizan una enzima dependiente de quinona, EC 1.1.5.4.
Un paso con una variabilidad significativa es la conversión de succinil-CoA en succinato. La mayoría de los organismos utilizan EC 6.2.1.5, succinato-CoA ligasa (formadora de ADP) (a pesar de su nombre, la enzima opera en la vía en dirección a la formación de ATP). En los mamíferos, también opera una enzima formadora de GTP, la succinato-CoA ligasa (formadora de PIB) (EC 6.2.1.4). El nivel de utilización de cada isoforma depende del tejido. En algunas bacterias productoras de acetato, como Acetobacter aceti, una enzima completamente diferente cataliza esta conversión: EC 2.8.3.18, succinil-CoA:acetato CoA-transferasa. Esta enzima especializada vincula el ciclo TCA con el metabolismo del acetato en estos organismos. Algunas bacterias, como Helicobacter pylori, emplee otra enzima para esta conversión: succinil-CoA:acetoacetato CoA-transferasa (EC 2.8.3.5).
También existe cierta variabilidad en el paso anterior: la conversión de 2-oxoglutarato en succinil-CoA. Mientras que la mayoría de los organismos utilizan la omnipresente 2-oxoglutarato deshidrogenasa dependiente de NAD, algunas bacterias utilizan una 2-oxoglutarato sintasa dependiente de ferredoxina (EC 1.2.7.3). Otros organismos, incluidas las bacterias y arqueas metanótrofas y autotróficas obligatorias, eluden por completo la succinil-CoA y convierten el 2-oxoglutarato en succinato a través de succinato semialdehído, utilizando EC 4.1.1.71, 2-oxoglutarato descarboxilasa, y EC 1.2.1.79, succinato-semialdehído deshidrogenasa.
En el cáncer, se producen trastornos metabólicos sustanciales para asegurar la proliferación de las células tumorales y, en consecuencia, se pueden acumular metabolitos que sirven para facilitar la tumorigénesis, denominados oncometabolitos.Entre los oncometabolitos mejor caracterizados se encuentra el 2-hidroxiglutarato, que se produce a través de una mutación heterocigota con ganancia de función (específicamente una neomórfica) en la isocitrato deshidrogenasa (IDH) (que en circunstancias normales cataliza la oxidación del isocitrato a oxalosuccinato, que luego descarboxila espontáneamente a alfa-cetoglutarato, como se discutió anteriormente; en este caso, se produce un paso de reducción adicional después de la formación de alfa-cetoglutarato a través de NADPH para producir 2-hidroxiglutarato), y por lo tanto IDH se considera un oncogén. En condiciones fisiológicas, el 2-hidroxiglutarato es un producto menor de varias rutas metabólicas como un error, pero se convierte fácilmente en alfa-cetoglutarato a través de las enzimas hidroxiglutarato deshidrogenasa (L2HGDH y D2HGDH)pero no tiene un papel fisiológico conocido en células de mamíferos; Es de destacar que, en el cáncer, el 2-hidroxiglutarato es probablemente un metabolito terminal, ya que los experimentos de marcado de isótopos de líneas celulares de cáncer colorrectal muestran que su conversión de nuevo a alfa-cetoglutarato es demasiado baja para medirla.En el cáncer, el 2-hidroxiglutarato actúa como un inhibidor competitivo de varias enzimas que facilitan las reacciones a través del alfa-cetoglutarato en las dioxigenasas dependientes de alfa-cetoglutarato. Esta mutación da como resultado varios cambios importantes en el metabolismo de la célula. Por un lado, debido a que hay una reducción adicional catalizada por NADPH, esto puede contribuir al agotamiento de las reservas celulares de NADPH y también reducir los niveles de alfa-cetoglutarato disponibles para la célula. En particular, el agotamiento de NADPH es problemático porque NADPH está muy compartimentado y no puede difundirse libremente entre los orgánulos de la célula. Se produce en gran medida a través de la vía de las pentosas fosfato en el citoplasma. El agotamiento de NADPH da como resultado un aumento del estrés oxidativo dentro de la célula, ya que es un cofactor necesario en la producción de GSH, y este estrés oxidativo puede provocar daños en el ADN. También hay cambios a nivel genético y epigenético a través de la función de las histonas lisina desmetilasas (KDM) y las enzimas de translocación diez-once (TET); normalmente, los TET hidroxilan las 5-metilcitosinas para prepararlas para la desmetilación. Sin embargo, en ausencia de alfa-cetoglutarato esto no se puede hacer y por lo tanto hay hipermetilación del ADN de la célula, lo que sirve para promover la transición epitelial-mesenquimatosa (EMT) e inhibir la diferenciación celular. Se observa un fenómeno similar para la familia Jumonji C de KDM que requiere una hidroxilación para realizar la desmetilación en el grupo metilo épsilon-amino. normalmente, los TET hidroxilan las 5-metilcitosinas para prepararlas para la desmetilación. Sin embargo, en ausencia de alfa-cetoglutarato esto no se puede hacer y por lo tanto hay hipermetilación del ADN de la célula, lo que sirve para promover la transición epitelial-mesenquimatosa (EMT) e inhibir la diferenciación celular. Se observa un fenómeno similar para la familia Jumonji C de KDM que requiere una hidroxilación para realizar la desmetilación en el grupo metilo épsilon-amino. normalmente, los TET hidroxilan las 5-metilcitosinas para prepararlas para la desmetilación. Sin embargo, en ausencia de alfa-cetoglutarato esto no se puede hacer y por lo tanto hay hipermetilación del ADN de la célula, lo que sirve para promover la transición epitelial-mesenquimatosa (EMT) e inhibir la diferenciación celular. Se observa un fenómeno similar para la familia Jumonji C de KDM que requiere una hidroxilación para realizar la desmetilación en el grupo metilo épsilon-amino.Además, la incapacidad de las prolil hidroxilasas para catalizar reacciones da como resultado la estabilización del factor alfa inducible por hipoxia, que es necesario para promover la degradación de este último (ya que en condiciones de poco oxígeno no habrá sustrato adecuado para la hidroxilación). Esto da como resultado un fenotipo pseudohipóxico en la célula cancerosa que promueve la angiogénesis, la reprogramación metabólica, el crecimiento celular y la migración.
Regulación
Regulación alostérica por metabolitos. La regulación del ciclo del ácido cítrico está determinada en gran medida por la inhibición del producto y la disponibilidad del sustrato. Si se permitiera que el ciclo se desarrollara sin control, se podrían desperdiciar grandes cantidades de energía metabólica en la sobreproducción de coenzimas reducidas, como NADH y ATP. El principal sustrato eventual del ciclo es ADP, que se convierte en ATP. Una cantidad reducida de ADP provoca la acumulación del precursor NADH que, a su vez, puede inhibir varias enzimas. NADH, un producto de todas las deshidrogenasas en el ciclo del ácido cítrico con la excepción de la succinato deshidrogenasa, inhibe la piruvato deshidrogenasa, la isocitrato deshidrogenasa, la α-cetoglutarato deshidrogenasa y también la citrato sintasa. La acetil-coA inhibe la piruvato deshidrogenasa, mientras que la succinil-CoA inhibe la alfa-cetoglutarato deshidrogenasa y la citrato sintasa. Cuando se probó in vitro con enzimas TCA,ATP inhibe la citrato sintasa y la α-cetoglutarato deshidrogenasa; sin embargo, los niveles de ATP no cambian más del 10% in vivo entre el descanso y el ejercicio vigoroso. No existe un mecanismo alostérico conocido que pueda explicar los grandes cambios en la velocidad de reacción de un efector alostérico cuya concentración cambia menos del 10%.
El citrato se utiliza para la inhibición de la retroalimentación, ya que inhibe la fosfofructocinasa, una enzima implicada en la glucólisis que cataliza la formación de fructosa 1,6-bisfosfato, un precursor del piruvato. Esto evita una alta tasa de flujo constante cuando hay una acumulación de citrato y una disminución del sustrato para la enzima.
Regulación por calcio. El calcio también se utiliza como regulador en el ciclo del ácido cítrico. Los niveles de calcio en la matriz mitocondrial pueden alcanzar decenas de niveles micromolares durante la activación celular. Activa la piruvato deshidrogenasa fosfatasa que a su vez activa el complejo piruvato deshidrogenasa. El calcio también activa la isocitrato deshidrogenasa y la α-cetoglutarato deshidrogenasa. Esto aumenta la velocidad de reacción de muchos de los pasos del ciclo y, por lo tanto, aumenta el flujo a lo largo de la vía.
Regulación transcripcional. Trabajos recientes han demostrado un vínculo importante entre los intermediarios del ciclo del ácido cítrico y la regulación de los factores inducibles por hipoxia (HIF). HIF desempeña un papel en la regulación de la homeostasis del oxígeno y es un factor de transcripción que se dirige a la angiogénesis, la remodelación vascular, la utilización de glucosa, el transporte de hierro y la apoptosis. El HIF se sintetiza de manera constitutiva, y la hidroxilación de al menos uno de los dos residuos críticos de prolina media su interacción con el complejo de ligasa de ubiquitina E3 de von Hippel Lindau, que los dirige para una rápida degradación. Esta reacción es catalizada por prolil 4-hidroxilasas. El fumarato y el succinato se han identificado como potentes inhibidores de las prolil hidroxilasas, lo que conduce a la estabilización del HIF.
Principales vías metabólicas que convergen en el ciclo del ácido cítrico
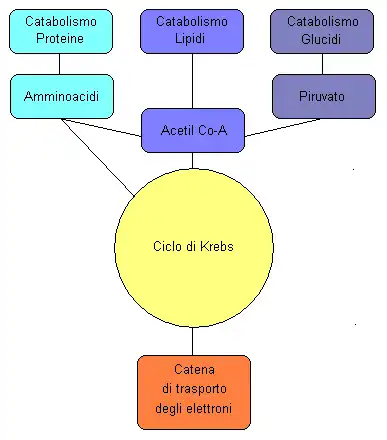
Varias vías catabólicas convergen en el ciclo del ácido cítrico. La mayoría de estas reacciones agregan intermediarios al ciclo del ácido cítrico y, por lo tanto, se conocen como reacciones anapleróticas, del griego que significa "llenar". Estos aumentan la cantidad de acetil CoA que el ciclo puede transportar, lo que aumenta la capacidad de la mitocondria para realizar la respiración si esto es un factor limitante. Los procesos que eliminan intermediarios del ciclo se denominan reacciones "catapleróticas".
En esta sección y en la siguiente, los intermedios del ciclo del ácido cítrico se indican en cursiva para distinguirlos de otros sustratos y productos finales.
Las moléculas de piruvato producidas por la glucólisis se transportan activamente a través de la membrana mitocondrial interna y hacia la matriz. Aquí pueden oxidarse y combinarse con la coenzima A para formar CO 2, acetil-CoA y NADH, como en el ciclo normal.
Sin embargo, también es posible que el piruvato sea carboxilado por la piruvato carboxilasa para formar oxaloacetato. Esta última reacción "llena" la cantidad de oxaloacetato en el ciclo del ácido cítrico y, por lo tanto, es una reacción anaplerótica, que aumenta la capacidad del ciclo para metabolizar acetil-CoA cuando las necesidades de energía del tejido (p. ej., en el músculo) aumentan repentinamente por la actividad.
En el ciclo del ácido cítrico, todos los intermedios (p. ej., citrato, isocitrato, alfa-cetoglutarato, succinato, fumarato, malato y oxaloacetato) se regeneran durante cada turno del ciclo. Por lo tanto, agregar más de cualquiera de estos intermediarios a la mitocondria significa que esa cantidad adicional se retiene dentro del ciclo, aumentando todos los demás intermediarios a medida que uno se convierte en el otro. Por lo tanto, la adición de cualquiera de ellos al ciclo tiene un efecto anaplerótico y su eliminación tiene un efecto cataplerótico. Estas reacciones anapleróticas y catapleróticas, durante el transcurso del ciclo, aumentarán o disminuirán la cantidad deoxaloacetato disponible para combinar con acetil-CoA para formar ácido cítrico. Esto, a su vez, aumenta o disminuye la tasa de producción de ATP por parte de la mitocondria y, por lo tanto, la disponibilidad de ATP para la célula.
Acetil-CoA, por otro lado, derivado de la oxidación del piruvato, o de la beta-oxidación de ácidos grasos, es el único combustible que ingresa al ciclo del ácido cítrico. Con cada vuelta del ciclo se consume una molécula de acetil-CoA por cada molécula de oxaloacetato presente en la matriz mitocondrial, y nunca se regenera. Es la oxidación de la porción de acetato de la acetil-CoA la que produce CO 2 y agua, con la energía del O 2 así liberada capturada en forma de ATP. Los tres pasos de la beta-oxidación se asemejan a los pasos que ocurren en la producción de oxalacetato a partir de succinato en el ciclo TCA. Acil-CoA se oxida a trans-Enoil-CoA mientras que FAD se reduce a FADH 2, que es similar a la oxidación de succinato a fumarato. A continuación, la trans-enoil-CoA se hidrata a través del doble enlace a beta-hidroxiacil-CoA, al igual que el fumarato se hidrata a malato. Por último, la beta-hidroxiacil-CoA se oxida a beta-cetoacil-CoA mientras que el NAD+ se reduce a NADH, que sigue el mismo proceso que la oxidación del malato a oxaloacetato.
En el hígado, la carboxilación del piruvato citosólico en oxaloacetato intramitocondrial es un paso temprano en la ruta gluconeogénica que convierte el lactato y la alanina desaminada en glucosa, bajo la influencia de niveles altos de glucagón y/o epinefrina en la sangre. Aquí, la adición de oxaloacetato a la mitocondria no tiene un efecto anaplerótico neto, ya que otro intermedio del ciclo del ácido cítrico (malato) se elimina inmediatamente de la mitocondria para convertirse en oxaloacetato citosólico, que finalmente se convierte en glucosa, en un proceso que es casi al revés de la glucólisis.
En el catabolismo de proteínas, las proteasas descomponen las proteínas en sus aminoácidos constituyentes. Sus esqueletos de carbono (es decir, los aminoácidos desaminados) pueden entrar en el ciclo del ácido cítrico como productos intermedios (p. ej. , alfa-cetoglutarato derivado del glutamato o la glutamina), que tienen un efecto anaplerótico en el ciclo o, en el caso de la leucina, la isoleucina, lisina, fenilalanina, triptófano y tirosina, se convierten en acetil-CoA que puede quemarse hasta CO 2 y agua, o utilizarse para formar cuerpos cetónicos, que también pueden quemarse únicamente en tejidos distintos del hígado donde se forman, o excretado a través de la orina o el aliento.Por lo tanto, estos últimos aminoácidos se denominan aminoácidos "cetogénicos", mientras que los que entran en el ciclo del ácido cítrico como intermediarios solo pueden eliminarse catapleróticamente entrando en la vía gluconeogénica a través del malato, que se transporta fuera de la mitocondria para convertirse en oxaloacetato citosólico y, en última instancia, en glucosa. Estos son los llamados aminoácidos "glucogénicos". La alanina, la cisteína, la glicina, la serina y la treonina desaminadas se convierten en piruvato y, en consecuencia, pueden entrar en el ciclo del ácido cítrico como oxaloacetato (una reacción anaplerótica) o como acetil-CoA para eliminarse como CO2 y agua .
En el catabolismo de las grasas, los triglicéridos se hidrolizan para descomponerlos en ácidos grasos y glicerol. En el hígado, el glicerol se puede convertir en glucosa a través de fosfato de dihidroxiacetona y gliceraldehído-3-fosfato a través de la gluconeogénesis. En muchos tejidos, especialmente el corazón y el músculo esquelético, los ácidos grasos se descomponen a través de un proceso conocido como oxidación beta, que da como resultado la producción de acetil-CoA mitocondrial, que se puede utilizar en el ciclo del ácido cítrico. La oxidación beta de ácidos grasos con un número impar de puentes de metileno produce propionil-CoA, que luego se convierte en succinil-CoA y se alimenta al ciclo del ácido cítrico como un intermediario anaplerótico.
La energía total obtenida de la descomposición completa de una molécula de glucosa (de seis carbonos) por glucólisis, la formación de 2 moléculas de acetil-CoA, su catabolismo en el ciclo del ácido cítrico y la fosforilación oxidativa equivale a unas 30 moléculas de ATP en eucariotas. El número de moléculas de ATP derivadas de la oxidación beta de un segmento de 6 carbonos de una cadena de ácido graso y la posterior oxidación de las 3 moléculas de acetil-CoA resultantes es 40.
Los intermedios del ciclo del ácido cítrico sirven como sustratos para procesos biosintéticos
En este subapartado, al igual que en el anterior, los intermedios TCA se identifican en cursiva.
Varios de los intermedios del ciclo del ácido cítrico se utilizan para la síntesis de compuestos importantes, que tendrán efectos catapleróticos significativos en el ciclo. Acetil-CoA no puede ser transportado fuera de la mitocondria. Para obtener acetil-CoA citosólico, el citrato se elimina del ciclo del ácido cítrico y se transporta a través de la membrana mitocondrial interna hacia el citosol. Allí es escindido por ATP citrato liasa en acetil-CoA y oxaloacetato. El oxaloacetato se devuelve a la mitocondria como malato (y luego se vuelve a convertir en oxaloacetato para transferir más acetil-CoA fuera de la mitocondria). El acetil-CoA citosólico se utiliza para la síntesis de ácidos grasos y la producción de colesterol. El colesterol, a su vez, se puede utilizar para sintetizar las hormonas esteroides, las sales biliares y la vitamina D.
Los esqueletos de carbono de muchos aminoácidos no esenciales están hechos de intermediarios del ciclo del ácido cítrico. Para convertirlos en aminoácidos, los alfa cetoácidos formados a partir de los intermedios del ciclo del ácido cítrico tienen que adquirir sus grupos amino del glutamato en una reacción de transaminación, en la que el fosfato de piridoxal es un cofactor. En esta reacción, el glutamato se convierte en alfa-cetoglutarato, que es un intermedio del ciclo del ácido cítrico. Los intermedios que pueden proporcionar los esqueletos de carbono para la síntesis de aminoácidos son el oxaloacetato, que forma aspartato y asparagina; y alfa-cetoglutarato que forma glutamina, prolina y arginina.
De estos aminoácidos, el aspartato y la glutamina se utilizan, junto con átomos de carbono y nitrógeno de otras fuentes, para formar las purinas que se utilizan como bases en el ADN y el ARN, así como en ATP, AMP, GTP, NAD, FAD y CoA.
Las pirimidinas se ensamblan parcialmente a partir de aspartato (derivado de oxaloacetato). Las pirimidinas, timina, citosina y uracilo, forman las bases complementarias de las bases de purina en el ADN y el ARN, y también son componentes de CTP, UMP, UDP y UTP.
La mayoría de los átomos de carbono en las porfirinas provienen del intermedio del ciclo del ácido cítrico, succinil-CoA. Estas moléculas son un componente importante de las hemoproteínas, como la hemoglobina, la mioglobina y varios citocromos.
Durante la gluconeogénesis, el oxalacetato mitocondrial se reduce a malato, que luego se transporta fuera de la mitocondria para oxidarse nuevamente a oxalacetato en el citosol. Luego, el oxaloacetato citosólico se descarboxila a fosfoenolpiruvato mediante la fosfoenolpiruvato carboxiquinasa, que es el paso limitante de la velocidad en la conversión de casi todos los precursores gluconeogénicos (como los aminoácidos glucogénicos y el lactato) en glucosa por el hígado y el riñón.
Debido a que el ciclo del ácido cítrico está involucrado tanto en procesos catabólicos como anabólicos, se conoce como vía anfibólica.
Evan MWDuo Haga clic en genes, proteínas y metabolitos a continuación para vincular a los artículos respectivos.
- ^ El mapa de ruta interactivo se puede editar en WikiPathways: "TCACycle_WP78".
La glucosa alimenta el ciclo TCA a través del lactato circulante
El papel metabólico del lactato es bien reconocido como combustible para tejidos y tumores. En el ciclo de Cori clásico, los músculos producen lactato que luego es absorbido por el hígado para la gluconeogénesis. Nuevos estudios sugieren que el lactato se puede utilizar como fuente de carbono para el ciclo TCA.
Evolución
Se cree que los componentes del ciclo del ácido cítrico se derivaron de bacterias anaerobias y que el propio ciclo del TCA puede haber evolucionado más de una vez. Teóricamente, existen varias alternativas al ciclo TCA; sin embargo, el ciclo TCA parece ser el más eficiente. Si varias alternativas de TCA hubieran evolucionado de forma independiente, todas parecen haber convergido en el ciclo de TCA.
Contenido relacionado
Alquino
Deshidrogenasa
Dominancia (genética)