Alquino
En química orgánica, un alquino es un hidrocarburo insaturado que contiene al menos un triple enlace carbono-carbono. Los alquinos acíclicos más simples con un solo enlace triple y ningún otro grupo funcional forman una serie homóloga con la fórmula química general C n H 2 n -2. Los alquinos se conocen tradicionalmente como acetilenos, aunque el nombre acetileno también se refiere específicamente a C 2 H 2, conocido formalmente como etino utilizando la nomenclatura IUPAC. Como otros hidrocarburos, los alquinos son generalmente hidrófobos.
Estructura y unión
En el acetileno, los ángulos de enlace H–C≡C son 180°. En virtud de este ángulo de enlace, los alquinos tienen forma de varilla. En consecuencia, los alquinos cíclicos son raros. La bencina no se puede aislar. La distancia del enlace C≡C de 121 picómetros es mucho más corta que la distancia C=C en los alquenos (134 pm) o el enlace C–C en los alcanos (153 pm).
 Alquinos ilustrativos:
Alquinos ilustrativos:
a, acetileno,
b, dos representaciones de propino,
c, 1-butino,
d, 2-butino,
e, el 1-fenilhepta-1,3,5-triino natural y
f, el cicloheptino tenso. Los enlaces triples están resaltados en
azul.
El triple enlace es muy fuerte con una fuerza de enlace de 839 kJ/mol. El enlace sigma contribuye con 369 kJ/mol, el primer enlace pi contribuye con 268 kJ/mol y el segundo enlace pi con una fuerza de enlace de 202 kJ/mol. El enlace generalmente se analiza en el contexto de la teoría de los orbitales moleculares, que reconoce que el triple enlace surge de la superposición de los orbitales s y p. En el lenguaje de la teoría del enlace de valencia, los átomos de carbono en un enlace alquino tienen hibridación sp: cada uno tiene dos orbitales p no hibridados y dos orbitales híbridos sp. La superposición de un orbital sp de cada átomo forma un enlace sp-sp sigma. Cada orbital p en un átomo se superpone con uno en el otro átomo, formando dos enlaces pi, dando un total de tres enlaces. El orbital sp restante en cada átomo puede formar un enlace sigma con otro átomo, por ejemplo, con átomos de hidrógeno en el acetileno original.
Alquinos terminales e internos
Los alquinos internos presentan sustituyentes de carbono en cada carbono acetilénico. Los ejemplos simétricos incluyen difenilacetileno y 3-hexino.
Los alquinos terminales tienen la fórmula RC 2 H. Un ejemplo es el metilacetileno (propino usando la nomenclatura IUPAC). Los alquinos terminales, como el propio acetileno, son ligeramente ácidos, con valores de p K a de alrededor de 25. Son mucho más ácidos que los alquenos y los alcanos, que tienen valores de p K a de alrededor de 40 y 50, respectivamente. El hidrógeno ácido en los alquinos terminales puede ser reemplazado por una variedad de grupos que dan como resultado halo-, silil- y alcoxoalquinos. Los carbaniones generados por la desprotonación de alquinos terminales se denominan acetiluros.
Nombrar alquinos
En la nomenclatura química sistemática, los alquinos se nombran con el sistema de prefijos griegos sin letras adicionales. Los ejemplos incluyen etino u octino. En cadenas madre con cuatro o más carbonos, es necesario decir dónde se encuentra el triple enlace. Para octino, uno puede escribir 3-octino u oct-3-ino cuando el enlace comienza en el tercer carbono. El número más bajo posible se le da al triple enlace. Cuando no están presentes grupos funcionales superiores, la cadena madre debe incluir el triple enlace, incluso si no es la cadena de carbono más larga posible en la molécula. El etino se denomina comúnmente acetileno por su nombre trivial.
En química, el sufijo -ino se usa para indicar la presencia de un triple enlace. En química orgánica, el sufijo suele seguir la nomenclatura de la IUPAC. Sin embargo, los compuestos inorgánicos que presentan insaturación en forma de enlaces triples se pueden indicar mediante una nomenclatura sustitutiva con los mismos métodos que se usan con los alquinos (es decir, el nombre del compuesto saturado correspondiente se modifica reemplazando el "-ano" que termina con "-ino").. "-diyne" se usa cuando hay dos triples enlaces, y así sucesivamente. La posición de insaturación se indica mediante un localizador numérico que precede inmediatamente al sufijo "-yne", o "localizadores" en el caso de enlaces triples múltiples. Los localizadores se eligen de modo que los números sean lo más bajos posible. "-yne"
A veces, se inserta un número entre guiones antes de indicar entre qué átomos se encuentra el triple enlace. Este sufijo surgió como una forma colapsada del final de la palabra "acetileno". La "-e" final desaparece si va seguida de otro sufijo que empieza por vocal.
Síntesis
Agrietamiento
Comercialmente, el alquino dominante es el propio acetileno, que se utiliza como combustible y precursor de otros compuestos, por ejemplo, acrilatos. Cientos de millones de kilogramos se producen anualmente por oxidación parcial de gas natural:2 canales 4 +3/2 O 2 → HC≡CH + 3 H 2 O
El propino, también industrialmente útil, también se prepara mediante craqueo térmico de hidrocarburos.
Deshidrohalogenación y reacciones relacionadas
Los alquinos se preparan a partir de dihaluros de 1,2- y 1,1-alquilo mediante doble deshidrohalogenación. La reacción proporciona un medio para generar alquinos a partir de alquenos, que primero se halogenan y luego se deshidrohalogenan. Por ejemplo, el fenilacetileno se puede generar a partir de estireno mediante bromación seguida del tratamiento del dibromuro de estireno resultante con amida de sodio en amoníaco: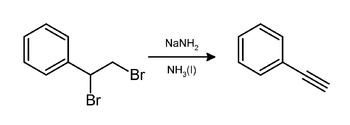
A través del reordenamiento de Fritsch-Buttenberg-Wiechell, los alquinos se preparan a partir de bromuros de vinilo. Los alquinos se pueden preparar a partir de aldehídos mediante la reacción de Corey-Fuchs y de aldehídos o cetonas mediante la homologación de Seyferth-Gilbert.
Los cloruros de vinilo son susceptibles a la deshidrocloración. Los cloruros de vinilo están disponibles a partir de aldehídos utilizando el reactivo (clorometileno) trifenilfosforano.
Reacciones, incluidas las aplicaciones
Con un grupo funcional reactivo, los alquinos participan en muchas reacciones orgánicas. Este uso fue iniciado por Ralph Raphael, quien en 1955 escribió el primer libro describiendo su versatilidad como intermediarios en síntesis.
Hidrogenación
Al ser más insaturados que los alquenos, los alquinos característicamente experimentan reacciones que muestran que están "doblemente insaturados". Los alquinos son capaces de agregar dos equivalentes de H 2, mientras que un alqueno agrega solo un equivalente. Dependiendo de los catalizadores y las condiciones, los alquinos agregan uno o dos equivalentes de hidrógeno. La hidrogenación parcial, que se detiene después de la adición de un solo equivalente para dar el alqueno, suele ser más deseable ya que los alcanos son menos útiles:

La aplicación a mayor escala de esta tecnología es la conversión de acetileno en etileno en refinerías (el craqueo al vapor de alcanos produce un pequeño porcentaje de acetileno, que se hidrogena selectivamente en presencia de un catalizador de paladio/plata). Para alquinos más complejos, se recomienda ampliamente el catalizador de Lindlar para evitar la formación del alcano, por ejemplo, en la conversión de fenilacetileno en estireno. De manera similar, la halogenación de alquinos da los dihaluros de alqueno o tetrahaluros de alquilo:RC≡CR′ + H 2 → cis-RCH=CR′HRCH=CR′H + H 2 → RCH 2 CR′H 2
La adición de un equivalente de H 2 a los alquinos internos da cis-alquenos.
Adición de halógenos y reactivos relacionados
Los alquinos característicamente son capaces de agregar dos equivalentes de halógenos y haluros de hidrógeno.RC≡CR′ + 2 Br 2 → RCBr 2 CR′Br 2
La adición de enlaces E-H no polares a través de C≡C es general para silanos, boranos e hidruros relacionados. La hidroboración de alquinos da boranos vinílicos que se oxidan al aldehído o cetona correspondiente. En la reacción tiol-ina, el sustrato es un tiol.
La adición de haluros de hidrógeno ha sido de interés durante mucho tiempo. En presencia de cloruro de mercurio como catalizador, el acetileno y el cloruro de hidrógeno reaccionan para dar cloruro de vinilo. Si bien este método ha sido abandonado en Occidente, sigue siendo el principal método de producción en China.
Hidratación
La reacción de hidratación del acetileno da acetaldehído. La reacción procede mediante la formación de alcohol vinílico, que se tautomeriza para formar el aldehído. Esta reacción fue una vez un proceso industrial importante, pero ha sido desplazada por el proceso Wacker. Esta reacción ocurre en la naturaleza, siendo el catalizador acetileno hidratasa.
La hidratación del fenilacetileno da acetofenona, y la hidratación catalizada por (Ph 3 P)AuCH 3 de 1,8-nonadiino a 2,8-nonanodiona:PhC≡CH + H 2 O → PhCOCH 3HC≡C(CH 2) 5 C≡CH + 2H 2 O → CH 3 CO(CH 2) 5 COCH 3
Tautomerismo
Los alquil alquinos terminales exhiben tautomerismo. El propino existe en equilibrio con el aleno:HC≡C-CH 3 ⇌ CH 2 =C=CH 2
Cicloadiciones y oxidación
Los alquinos sufren diversas reacciones de cicloadición. La reacción de Diels-Alder con 1,3-dienos da 1,4-ciclohexadienos. Esta reacción general ha sido ampliamente desarrollada. Los alquinos electrofílicos son dienófilos especialmente efectivos. El "cicloaducto" derivado de la adición de alquinos a la 2-pirona elimina el dióxido de carbono para dar el compuesto aromático. Otras cicloadiciones especializadas incluyen reacciones de múltiples componentes como la trimerización de alquinos para dar compuestos aromáticos y la cicloadición [2+2+1] de un alquino, alqueno y monóxido de carbono en la reacción de Pauson-Khand. Los reactivos que no son de carbono también se someten a ciclación, por ejemplo, la cicloadición de Huisgen de alquino de azida para dar triazoles. Los procesos de cicloadición que involucran alquinos a menudo son catalizados por metales, por ejemplo, metátesis de enino y metátesis de alquino,RC≡CR + R′C≡CR′ ⇌ 2 RC≡CR′
La escisión oxidativa de los alquinos se produce mediante cicloadición a óxidos metálicos. El más famoso, el permanganato de potasio convierte los alquinos en un par de ácidos carboxílicos.
Reacciones específicas para alquinos terminales
Los alquinos terminales se convierten fácilmente en muchos derivados, por ejemplo, mediante reacciones de acoplamiento y condensaciones. A través de la condensación con formaldehído y acetileno se produce butinodiol:2 CH 2 O + HC≡CH → HOCH 2 CCCH 2 OH
En la reacción de Sonogashira, los alquinos terminales se acoplan con haluros de arilo o vinilo:![]()
Esta reactividad explota el hecho de que los alquinos terminales son ácidos débiles, cuyos valores típicos de p K a alrededor de 25 los ubican entre los del amoníaco (35) y el etanol (16):RC≡CH + MX → RC≡CM + HX (MX = NaNH 2, LiBu, RMgX)
Las reacciones de los alquinos con ciertos cationes metálicos, por ejemplo, Ag y Cu, también dan acetiluros. Por lo tanto, unas pocas gotas de hidróxido de diaminoplata(I) (Ag(NH 3) 2 OH) reaccionan con los alquinos terminales señalados por la formación de un precipitado blanco del acetiluro de plata. Esta reactividad es la base de las reacciones de acoplamiento de alquinos, incluido el acoplamiento de Cadiot-Chodkiewicz, el acoplamiento de Glaser y el acoplamiento de Eglinton:
En la reacción de Favorskii y en las alquinilaciones en general, los alquinos terminales se suman a los compuestos carbonílicos para dar el hidroxialquino.
Complejos metálicos
Los alquinos forman complejos con los metales de transición. Dichos complejos también se producen en reacciones de alquinos catalizadas por metales, como la trimerización de alquinos. Los alquinos terminales, incluido el propio acetileno, reaccionan con el agua para dar aldehídos. La transformación normalmente requiere catalizadores metálicos para dar este resultado de adición anti-Markovnikov.
Alquinos en la naturaleza y la medicina.
Según Ferdinand Bohlmann, el primer compuesto acetilénico natural, el éster de dehidromatricaria, se aisló de una especie de Artemisia en 1826. En los casi dos siglos que siguieron, se han descubierto e informado más de mil acetilenos naturales. Los poliynos, un subconjunto de esta clase de productos naturales, se han aislado de una amplia variedad de especies de plantas, cultivos de hongos superiores, bacterias, esponjas marinas y corales. Algunos ácidos como el ácido tarírico contienen un grupo alquino. Diynes y triynes, especies con el enlace RC≡C–C≡CR′ y RC≡C–C≡C–C≡CR′ respectivamente, ocurren en ciertas plantas (Ichthyothere, Chrysanthemum, Cicuta, Oenanthey otros miembros de las familias Asteraceae y Apiaceae). Algunos ejemplos son la cicutoxina, la enantotoxina y el falcarinol. Estos compuestos son altamente bioactivos, por ejemplo, como nematocidas. El 1-fenilhepta-1,3,5-triino es ilustrativo de un triino natural.
Los alquinos se encuentran en algunos productos farmacéuticos, incluido el noretinodrel anticonceptivo. Un triple enlace carbono-carbono también está presente en medicamentos comercializados como el antirretroviral Efavirenz y el antifúngico Terbinafina. Las moléculas llamadas ene-diynes presentan un anillo que contiene un alqueno ("ene") entre dos grupos alquino ("diyne"). Estos compuestos, por ejemplo, la caliqueamicina, son algunos de los fármacos antitumorales más agresivos que se conocen, tanto que la subunidad ene-diyne a veces se denomina "ojiva". Los ene-diynes se reorganizan a través de la ciclación de Bergman, generando intermediarios radicales altamente reactivos que atacan el ADN dentro del tumor.
Contenido relacionado
Etanol
Arseniuro de galio
Bórax