Calor latente
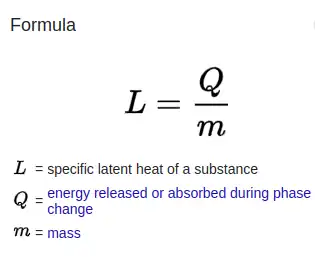
El calor latente es la cantidad de energía que se libera o absorbe por un cuerpo o sistema termodinámico durante una transición a temperatura constante. Esta transición es generalmente una transición de fase de primer orden. Es decir, el calor latente es aquel que un cuerpo recibe o libera sin que cambie su temperatura. Este calor permanece "oculto" o "latente" dentro del sistema, y su presencia suele resultar en un cambio de estado de la materia.
Al calor latente se le conoce también como energía latente, y un modo práctico de entender el calor latente es considerarlo como una energía "escondida" que entra o sale de un cuerpo y puede cambiar el estado de la materia pero no su temperatura. Ejemplos comunes incluyen el calor latente de fusión, en la transición de sólido a líquido, y el calor latente de vaporización, que se relaciona con la transición de líquido a gas. Ambos procesos ocurren bajo condiciones específicas de temperatura y presión.
La término calor latente fue introducida por primera vez alrededor de 1762 por el químico británico Joseph Black. La palabra proviene del latín "latere", que significa "estar escondido". Black empleó este concepto en el ámbito de la calorimetría, observando cómo la transferencia de calor podía provocar un cambio de volumen en un cuerpo, manteniendo constante su temperatura.
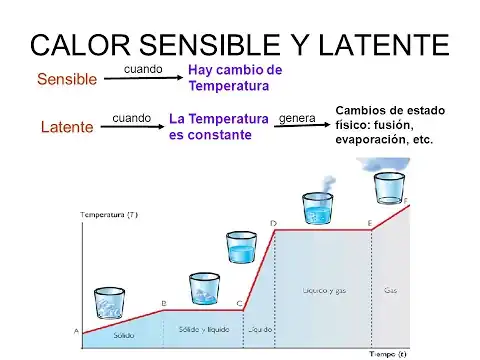
Es importante diferenciar el calor latente del calor sensible. Mientras que el calor latente está asociado con cambios de estado sin variación de temperatura, el calor sensible implica la transferencia de energía que resulta en un cambio de temperatura en el cuerpo, sin alterar su estado.
Diferencia entre calor latente y sensible
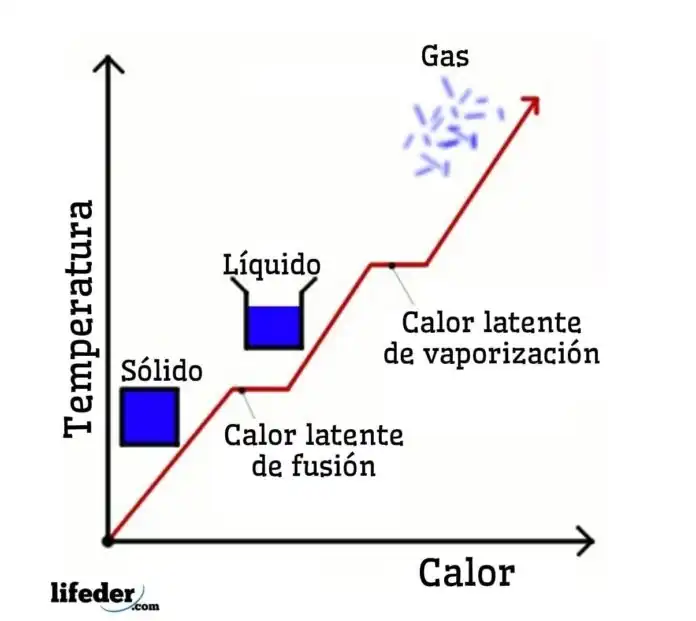
Ambos términos "calor sensible" y "calor latente" se refieren a la energía transferida entre un cuerpo y su entorno, pero se diferencian por la ocurrencia o no de un cambio de temperatura. El "calor sensible" se percibe en una proceso como un cambio en la temperatura del cuerpo, mientras el "calor latente", aunque es energía transferida al cuerpo, no se percibe en un cambio de temperatura.
El calor sensible se refiere a la energía térmica que causa un cambio en la temperatura de una sustancia sin alterar su fase. Cuando se agrega o se retira calor sensible de una sustancia, su temperatura aumenta o disminuye respectivamente, pero su estado físico (sólido, líquido o gaseoso) permanece igual. Este cambio de temperatura se puede medir con un termómetro y está directamente relacionado con la capacidad calorífica específica de la sustancia. Por ejemplo, cuando calientas agua en una olla, la temperatura del agua aumenta antes de que comience a hervir; este aumento en la temperatura se debe a la absorción de calor sensible.
Por otro lado, el calor latente es la energía térmica absorbida o liberada por una sustancia durante un cambio de fase, sin un cambio en la temperatura. Esta energía se utiliza para alterar la estructura interna de la sustancia, permitiéndole transitar entre los estados sólido, líquido y gaseoso. El calor latente se categoriza en dos tipos: calor latente de fusión (para la fusión y solidificación) y calor latente de vaporización (para la ebullición y condensación). Por ejemplo, cuando el hielo se derrite para formar agua, absorbe calor de su entorno, pero su temperatura permanece constante a 0°C (32°F) hasta que todo el hielo se ha derretido. Este calor absorbido es el calor latente de fusión.
La diferencia clave entre el calor sensible y el calor latente radica en sus efectos sobre una sustancia. El calor sensible cambia la temperatura de una sustancia sin cambiar su fase, y este cambio es directamente observable y medible. Sin embargo, el calor latente está involucrado en cambiar la fase de una sustancia a temperatura constante. Este cambio de fase es un concepto crítico en varios campos, incluyendo la meteorología, HVAC (calefacción, ventilación y aire acondicionado) e ingeniería. Comprender la interacción del calor sensible y latente es esencial para el control efectivo de la temperatura y la humedad, la predicción del tiempo y en el diseño de sistemas de calefacción y refrigeración.
HSD
Calor latente específico
Un calor latente específico (L) expresa la cantidad de energía en forma de calor (Q) necesaria para efectuar completamente un cambio de fase de una unidad de masa (m), generalmente 1 kg, de una sustancia como propiedad intensiva:
Las propiedades intensivas son características del material y no dependen del tamaño o extensión de la muestra. Comúnmente citados y tabulados en la literatura están el calor latente específico de fusión y el calor latente específico de vaporización para muchas sustancias.
A partir de esta definición, el calor latente para una masa dada de una sustancia se calcula mediante
donde:Q es la cantidad de energía liberada o absorbida durante el cambio de fase de la sustancia (en kJ o en BTU),m es la masa de la sustancia (en kg o en lb), yL es el calor latente específico para una sustancia particular (kJ kg o en BTU lb), ya sea L f para fusión o L v para vaporización.
Tabla de calores latentes específicos
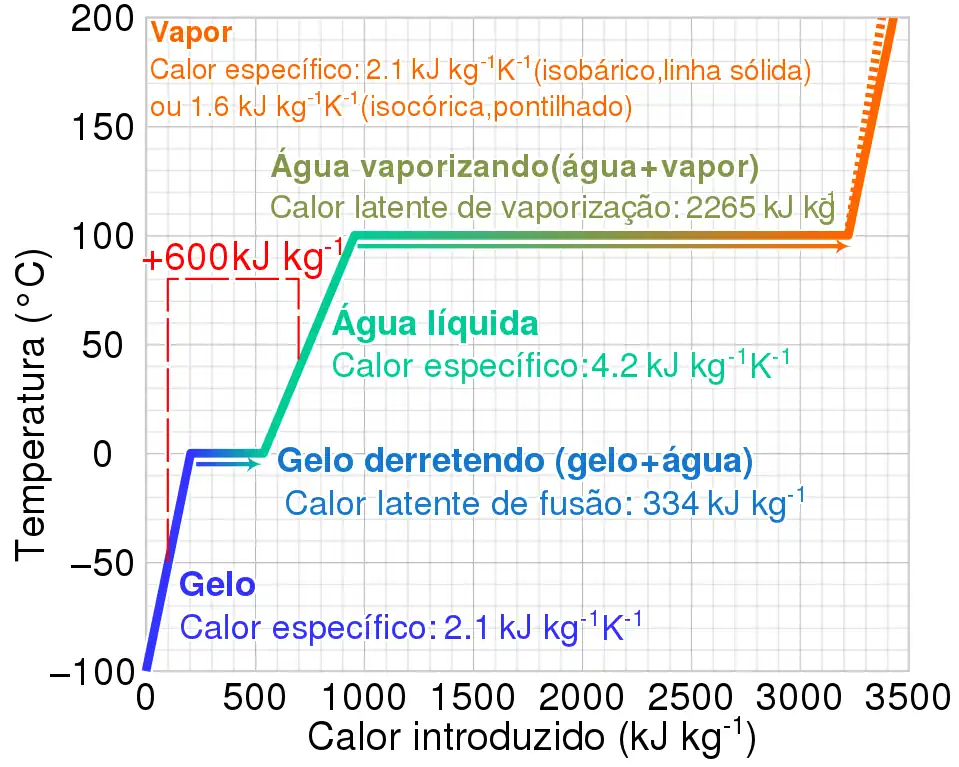
La siguiente tabla muestra los calores latentes específicos y el cambio de temperatura de fase (a presión estándar) de algunos fluidos y gases comunes.
| Sustancia | SLH defusión(kJ/kg) | Punto de fusión(°C) | SLH devaporización(kJ/kg) | Punto de ebullición(°C) |
|---|---|---|---|---|
| Alcohol etílico | 108 | −114 | 855 | 78.3 |
| Amoníaco | 332.17 | −77,74 | 1369 | −33,34 |
| Dióxido de carbono | 184 | −78 | 574 | |
| Helio | 21 | −268,93 | ||
| Hidrógeno(2) | 58 | −259 | 455 | −253 |
| Plomo | 23.0 | 327.5 | 871 | 1750 |
| Metano | 59 | −182,6 | 511 | −161,6 |
| Nitrógeno | 25.7 | −210 | 200 | −196 |
| Oxígeno | 13.9 | −219 | 213 | −183 |
| Refrigerante R134a | −101 | 215.9 | −26,6 | |
| Refrigerante R152a | −116 | 326.5 | -25 | |
| Silicio | 1790 | 1414 | 12800 | 3265 |
| tolueno | 72.1 | −93 | 351 | 110.6 |
| Trementina | 293 | |||
| Agua | 334 | 0 | 2264.705 | 100 |
Variación con la temperatura (o la presión)
A medida que la temperatura (o la presión) aumenta hasta el punto crítico, el calor latente de vaporización cae a cero.
Ejemplos de usos en la vida real
El uso original del término, tal como lo introdujo Black, se aplicó a sistemas que se mantuvieron intencionalmente a temperatura constante. Tal uso se refería al calor latente de expansión y varios otros calores latentes relacionados. Estos calores latentes se definen independientemente del marco conceptual de la termodinámica.
Cuando un cuerpo se calienta a temperatura constante por radiación térmica en un campo de microondas, por ejemplo, puede expandirse en una cantidad descrita por su calor latente con respecto al volumen o calor latente de expansión, o aumentar su presión en una cantidad descrita por su calor latente. calor con respecto a la presión. El calor latente es energía liberada o absorbida por un cuerpo o un sistema termodinámico durante un proceso a temperatura constante. Dos formas comunes de calor latente son el calor latente de fusión (fusión) y el calor latente de vaporización (ebullición). Estos nombres describen la dirección del flujo de energía cuando se cambia de una fase a la siguiente: de sólido a líquido y de líquido a gas.
En ambos casos el cambio es endotérmico, lo que significa que el sistema absorbe energía. Por ejemplo, cuando el agua se evapora, se requiere energía para que las moléculas de agua superen las fuerzas de atracción entre ellas, la transición de agua a vapor requiere un aporte de energía.
Si el vapor luego se condensa en un líquido sobre una superficie, entonces la energía latente del vapor absorbida durante la evaporación se libera como calor sensible del líquido sobre la superficie.
El gran valor de la entalpía de condensación del vapor de agua es la razón por la que el vapor es un medio de calentamiento mucho más efectivo que el agua hirviendo y es más peligroso.
Meteorología
En meteorología, el flujo de calor latente es el flujo de energía desde la superficie de la Tierra hacia la atmósfera que está asociado con la evaporación o transpiración del agua en la superficie y la subsiguiente condensación del vapor de agua en la troposfera. Es un componente importante del presupuesto energético de la superficie de la Tierra. El flujo de calor latente se ha medido comúnmente con la técnica de la relación de Bowen o, más recientemente, desde mediados del siglo XX, con el método de covarianza de Eddy.
Calor latente específico para la condensación de agua en las nubes
El calor latente específico de condensación del agua en el rango de temperatura de −25 °C a 40 °C se aproxima mediante la siguiente función cúbica empírica:
donde la temperatura 
Para la sublimación y la deposición desde y hacia el hielo, el calor latente específico es casi constante en el rango de temperatura de -40 °C a 0 °C y se puede aproximar mediante la siguiente función cuadrática empírica:
Historia del descubrimiento del calor latente
La palabra inglesa latente proviene del latín latēns, que significa yacer escondido. El término calor latente fue introducido en la calorimetría alrededor de 1750 por Joseph Black, encargado por los productores de whisky escocés en busca de cantidades ideales de combustible y agua para su proceso de destilación, para estudiar los cambios del sistema, como el volumen y la presión, cuando el sistema termodinámico se mantuvo constante. temperatura en un baño termal. Black compararía el cambio de temperatura de dos cantidades idénticas de agua, calentadas por medios idénticos, una de las cuales, digamos, se derritió del hielo, mientras que la otra se calentó simplemente desde un estado líquido frío. Al comparar las temperaturas resultantes, pudo concluir que, por ejemplo, la temperatura de la muestra de hielo derretida era 140 °F más baja que la de la otra muestra, por lo que al derretir el hielo absorbió 140 "grados de calor" que no se podían medir con el termómetro, pero necesitaba ser suministrado, por lo que fue "
Más tarde, James Prescott Joule caracterizó la energía latente como la energía de interacción en una determinada configuración de partículas, es decir, una forma de energía potencial, y el calor sensible como una energía que indicaba el termómetro, relacionando esta última con la energía térmica.
Contenido relacionado
Constante de Boltzmann
Escala rankine
Constante de Stefan-Boltzmann



