Zwitterion
En química, un zwitterion (TSVIT-ə-rye-ən; del alemán Zwitter [ˈtsvɪtɐ] 'hermafrodita'), también llamado sal interna o ion dipolar, es una molécula que contiene un número igual de grupos funcionales con carga positiva y negativa. Con los aminoácidos, por ejemplo, en solución se establecerá un equilibrio químico entre el "padre" molécula y el zwitterión.
Las betaínas son zwitteriones que no pueden isomerizarse a una forma totalmente neutra, como cuando la carga positiva se encuentra en un grupo de amonio cuaternario. De manera similar, una molécula que contiene un grupo fosfonio y un grupo carboxilato no puede isomerizarse.
Aminoácidos
El equilibrio se establece en dos etapas. En la primera etapa, se transfiere un protón del grupo carboxilo a una molécula de agua:
- <math alttext="{displaystyle {ce {H2N(R)CO2H + H2O H2N(R)CO2- + H3O+}}}" xmlns="http://www.w3.org/1998/Math/MathML">H2N()R)CO2H+H2O↽ ↽ − − − − ⇀ ⇀ H2N()R)CO2− − +H3O+{displaystyle {ce {H2N(R)CO2H + H2O }}}}<img alt="{displaystyle {ce {H2N(R)CO2H + H2O H2N(R)CO2- + H3O+}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/667d4231cf3618d1f3ab3f7b3c0ff133bef23d9e" style="vertical-align: -1.005ex; width:48.452ex; height:3.343ex;"/>
En la segunda etapa, se transfiere un protón del ion hidronio al grupo amina:
- <math alttext="{displaystyle {ce {H2N(R)CO2- + H3O+ H3N+ (R)CO2- + H2O}}}" xmlns="http://www.w3.org/1998/Math/MathML">H2N()R)CO2− − +H3O+↽ ↽ − − − − ⇀ ⇀ H3N+()R)CO2− − +H2O{displaystyle {ce {H2N(R)CO2- + H3O+ }}}<img alt="{displaystyle {ce {H2N(R)CO2- + H3O+ H3N+ (R)CO2- + H2O}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/74010bcbff08b03790c49668c258ce7191d70d05" style="vertical-align: -1.005ex; width:48.676ex; height:3.343ex;"/>
En general, la reacción es una reacción de isomerización
- <math alttext="{displaystyle {ce {H2N(R)CO2H H3N+ (R)CO2-}}}" xmlns="http://www.w3.org/1998/Math/MathML">H2N()R)CO2H↽ ↽ − − − − ⇀ ⇀ H3N+()R)CO2− − {displaystyle {ce {cH2N(R)CO2H = {}}}}<img alt="{displaystyle {ce {H2N(R)CO2H H3N+ (R)CO2-}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/e8fcbc39a16d0ed3746f937cdbd2dfa16652e180" style="vertical-align: -1.005ex; width:33.56ex; height:3.343ex;"/>
La relación de las concentraciones de las dos especies en solución es independiente del pH ya que es igual al valor de la constante de equilibrio K para la reacción de isomerización:
- K=[H3N+()R)CO2− − ][H2N()R)CO2H]{displaystyle K={frac {ce {cH3N+ (R)CO2-}}}}}}}} {cH2N(R)CO2H)}}}}}} {cH2N(R)CO2H}}}}}}}}} {cH}}} {cH}}}}} {ccH3N}}}}}}}}}} {
donde [X] representa la concentración de la especie química X en equilibrio. Generalmente se asume que K > 1, es decir, que el zwitterión es el isómero de aminoácido predominante en solución acuosa. Se ha sugerido, sobre la base del análisis teórico, que el zwitterión se estabiliza en solución acuosa mediante enlaces de hidrógeno con moléculas de agua solvente. El análisis de los datos de difracción de neutrones para la glicina mostró que estaba en forma zwitteriónica en estado sólido y confirmó la presencia de enlaces de hidrógeno. Se han utilizado cálculos teóricos para mostrar que los iones de zwitter también pueden estar presentes en la fase gaseosa para algunos casos diferentes de la simple transferencia de ácido carboxílico a amina.
Los valores de pKa para la desprotonación de los aminoácidos comunes abarcan el rango aproximado 2,15±0,2. Esto también es consistente con que el zwitterión sea el isómero predominante que está presente en una solución acuosa. A modo de comparación, el ácido propiónico del ácido carboxílico simple (CH3CH 2CO2H) tiene un valor pKa de 4,88.
Otros compuestos
El ácido sulfámico cristaliza en forma de zwitterión.
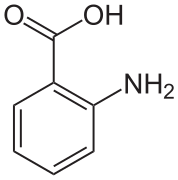
En los cristales de ácido antranílico hay dos moléculas en la celda unitaria. Una molécula está en forma de zwitterión, la otra no.
En estado sólido, el H4EDTA es un zwitterión con dos protones transferidos desde los grupos de ácido carboxílico a los átomos de nitrógeno.
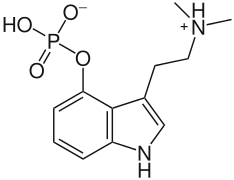
En la psilocibina, el protón del grupo dimetilamino es lábil y puede saltar al grupo fosfato para formar un compuesto que no es un zwitterión.
Estudios teóricos
Se puede obtener información sobre el equilibrio en la solución a partir de los resultados de los cálculos teóricos. Por ejemplo, se predice que el fosfato de piridoxal, una forma de vitamina B6, en solución acuosa tiene un equilibrio que favorece una forma tautomérica en la que un protón se transfiere del grupo fenólico -OH al átomo de nitrógeno.
Debido a que los tautómeros son compuestos diferentes, a veces tienen estructuras lo suficientemente diferentes como para que se puedan detectar de forma independiente en su mezcla. Esto permite el análisis experimental del equilibrio.
Betaínas y compuestos similares
El compuesto trimetilglicina, que se aisló de la remolacha azucarera, se denominó "betaína". Posteriormente, se descubrieron otros compuestos que contienen el mismo motivo estructural, un átomo de nitrógeno cuaternario con un grupo carboxilato unido a él a través de un enlace –CH2–. En la actualidad, todos los compuestos cuya estructura incluye este motivo se conocen como betaínas. Las betaínas no se isomerizan porque los grupos químicos unidos al átomo de nitrógeno no son lábiles. Estos compuestos pueden clasificarse como zwitteriones permanentes, ya que la isomerización a una molécula sin cargas eléctricas no se produce o es muy lenta.
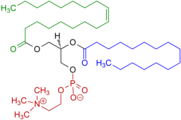
Otros ejemplos de iones de zwitter permanentes incluyen fosfatidilcolinas, que también contienen un átomo de nitrógeno cuaternario, pero con un grupo fosfato con carga negativa en lugar de un grupo carboxilato; sulfobetaínas, que contienen un átomo de nitrógeno cuaternario y un grupo sulfonato cargado negativamente; y tensioactivos pulmonares tales como dipalmitoilfosfatidilcolina. La lauramidopropil betaína es el componente principal de la cocamidopropil betaína.
Zwitteriones conjugados
Los compuestos conjugados fuertemente polarizados (zwitteriones conjugados) suelen ser muy reactivos, comparten un carácter dirradical, activan enlaces fuertes y moléculas pequeñas, y sirven como intermediarios transitorios en la catálisis. Las entidades donadoras-aceptoras son de gran utilidad en fotoquímica (transferencia de electrones fotoinducida), electrónica orgánica, conmutación y detección.
Contenido relacionado
Mezcla racémica
Ecuación de Nernst
Dalton (unidad)

![{displaystyle K={frac {{ce {[H3N+ (R)CO2- ]}}}{{ce {[H2N(R)CO2H]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/db1a09f78bfaf6d512d9f530361cd2e279dc7200)