Constante de faraday
En química física, la constante de Faraday, denotada por el símbolo F y a veces estilizada como ℱ, es la carga eléctrica por mol de cargas elementales.... (leer más)
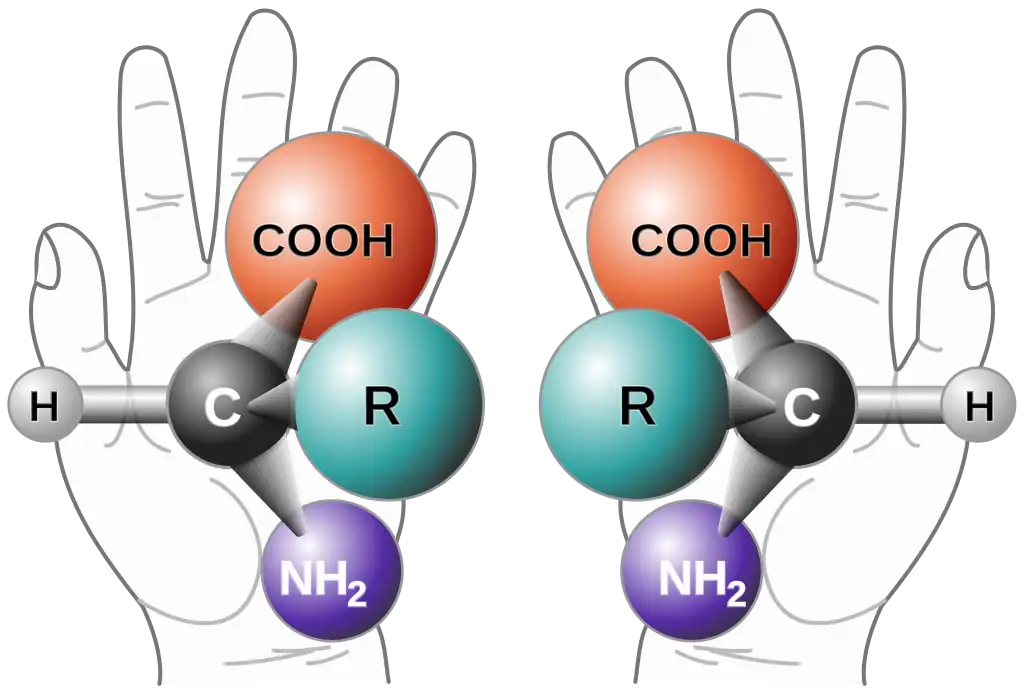
Una mezcla racémica o racemato, es una mezcla que contiene proporciones iguales de dos formas especulares de una molécula quiral o de una sal. Estas formas especulares se denominan enantiómeros. Los enantiómeros generalmente son zurdos (levógiros) o diestros (dextrógiros) según cómo roten la luz polarizada. Las mezclas racémicas tienen cantidades iguales de enantiómeros zurdos y diestros.
Para comprender los enantiómeros, se pueden usar como ejemplo la mano izquierda y derecha de una persona: ambas son imágenes espejo (especulares) una de la otra, pero no se pueden superponer entre sí.
Aunque las mezclas racémicas son poco comunes en la naturaleza, su importancia es significativa en la industria química. Muchos compuestos, especialmente en el ámbito farmacéutico, se producen y utilizan en su forma racémica. Esto se debe a que la síntesis de un enantiómero puro puede ser más compleja y costosa en comparación con la producción de una mezcla racémica.
Los enantiómeros levógiros hacen girar la luz polarizada hacia la izquierda, mientras que los enantiómeros dextrógiros la hacen girar hacia la derecha. El equilibrio entre enantiómeros hace que los efectos sobre la luz se cancelan mutuamente, haciendo la mezcla ópticamente inactiva.
La relevancia de las mezclas racémicas radica en sus propiedades y aplicaciones. En algunos casos, solo uno de los enantiómeros es responsable del efecto deseado en aplicaciones como medicamentos, mientras que el otro puede ser inactivo o incluso tener efectos adversos. Por ello, el estudio y comprensión de las mezclas racémicas es crucial en la investigación y desarrollo de nuevos compuestos en diversas áreas, incluyendo la farmacéutica y la química orgánica.
HSD
La primera mezcla racémica conocida fue el ácido racémico, que Louis Pasteur descubrió que era una mezcla de los dos isómeros enantioméricos del ácido tartárico. Separó manualmente los cristales de una mezcla a mano, a partir de una solución acuosa de la sal de sodio y amonio del ácido tartárico racemato. Pasteur se benefició del hecho de que la sal de tartrato de amonio da cristales enantioméricos con distintas formas cristalinas (a 77 °F). Razonando desde la escala macroscópica hasta la molecular, calculó que las moléculas tenían que tener imágenes especulares no superponibles.
Una muestra con un solo enantiómero es un compuesto enantioméricamente puro o enantiopuro.
Del ácido racémico que se encuentra en las uvas; del latín racemus, que significa racimo de uvas. Este ácido, cuando se produce naturalmente en las uvas, es solo la versión derecha de la molécula, más conocida como ácido tartárico. En muchos idiomas germánicos, el ácido racémico se denomina "ácido de uva", p. alemán traubensäure y sueco druvsyra. Carl von Linné dio a la baya del saúco roja el nombre científico Sambucus racemosa ya que el nombre sueco, druvfläder, significa 'uva de saúco', llamada así porque sus bayas crecen en un racimo parecido a una uva.
Una mezcla racémica se indica con el prefijo (±)- o dl- (para los azúcares, el prefijo dl-), lo que indica una mezcla igual (1:1) de isómeros dextro y levo. También el prefijo rac- (o racem-) o los símbolos RS y SR (todos en letras cursivas).
Si la relación no es 1:1 (o no se conoce), el prefijo (+)/(−), d/l- o d/l- (con una barra inclinada).
La IUPAC desaconseja el uso de d y l.
Un racemato es ópticamente inactivo (aquiral), lo que significa que dichos materiales no rotan la polarización de la luz polarizada en el plano. Aunque los dos enantiómeros giran la luz polarizada en un plano en direcciones opuestas, las rotaciones se cancelan entre sí porque están presentes en cantidades iguales de enantiómeros negativos (-) en sentido antihorario (levorrotatorios) y positivos (+) en sentido horario (dextrorrotatorios).
En contraste con los dos enantiómeros puros, que tienen propiedades físicas idénticas excepto por la dirección de rotación de la luz polarizada plana, un racemato a veces tiene propiedades diferentes de cualquiera de los enantiómeros puros. Los diferentes puntos de fusión son los más comunes, pero también son posibles diferentes solubilidades y puntos de ebullición.
Los productos farmacéuticos pueden estar disponibles como racemato o como enantiómero puro, que pueden tener diferentes potencias. Debido a que los sistemas biológicos tienen muchas asimetrías quirales, los enantiómeros puros frecuentemente tienen efectos biológicos muy diferentes; los ejemplos incluyen glucosa y metanfetamina.
Hay cuatro formas de cristalizar un racemato; tres de los cuales H. W. B. Roozeboom había distinguido en 1899:
La separación de un racemato en sus componentes, los enantiómeros individuales, se denomina resolución quiral. Existen varios métodos para esta separación, incluida la cristalización, la cromatografía y el uso de varios reactivos.
Sin una influencia quiral (por ejemplo, un catalizador quiral, un solvente o un material de partida), una reacción química que genera un producto quiral siempre generará un racemato. Eso puede hacer que la síntesis de un racemato sea más barata y fácil que hacer el enantiómero puro, porque no requiere condiciones especiales. Este hecho también lleva a la pregunta de cómo evolucionó la homoquiralidad biológica en lo que se supone que es una tierra primordial racémica.
Se dice que los reactivos y las reacciones que producen las mezclas racémicas son "no estereoespecíficos" o "no estereoselectivo", por su indecisión en un estereoisomerismo particular. Un escenario frecuente es el de una especie plana (como un átomo de carbono sp2 o un carbocatión intermedio) que actúa como electrófilo. El nucleófilo tendrá un 50 % de probabilidad de 'dar en el blanco'. cualquiera de los dos lados de la agrupación plana, produciendo así una mezcla racémica:
Algunas moléculas de fármacos son quirales y los enantiómeros tienen diferentes efectos sobre las entidades biológicas. Se pueden vender como un enantiómero o como una mezcla racémica. Los ejemplos incluyen talidomida, ibuprofeno, cetirizina y salbutamol. Una droga bien conocida que tiene diferentes efectos dependiendo de su proporción de enantiómeros es la anfetamina. Adderall es una mezcla desigual de ambos enantiómeros de anfetamina. Una sola dosis de Adderall combina las sales neutras de sulfato de dextroanfetamina y anfetamina, con el isómero dextro de sacarato de anfetamina y monohidrato de aspartato de D/L-anfetamina. La Benzedrina original era una mezcla racémica, y la dextroanfetamina aislada se introdujo más tarde en el mercado como Dexedrina. El analgésico recetado tramadol también es un racemato.
En algunos casos (p. ej., ibuprofeno y talidomida), los enantiómeros se interconvierten o se racemizan in vivo. Esto significa que la preparación de un enantiómero puro para la medicación carece en gran medida de sentido. Sin embargo, a veces las muestras que contienen enantiómeros puros pueden fabricarse y venderse a un costo mayor en los casos en que el uso requiera específicamente un isómero (p. ej., para un reactivo estereoespecífico); comparar omeprazol y esomeprazol. Se puede pasar de un fármaco racémico a un fármaco específico quiral para obtener un mejor perfil de seguridad o un índice terapéutico mejorado. Este proceso se denomina cambio quiral y el fármaco enantiopuro resultante se denomina cambio quiral. Como ejemplos, esomeprazol es un interruptor quiral de (±)-omeprazol y levocetirizina es un interruptor quiral de (±)-cetirizina.
Si bien a menudo solo un enantiómero del fármaco puede estar activo, hay casos en los que el otro enantiómero es dañino, como el salbutamol y la talidomida. El enantiómero (R) de la talidomida es efectivo contra las náuseas matutinas, mientras que el enantiómero (S) es teratogénico y causa defectos de nacimiento. Dado que el fármaco se vuelve racemizante, no se puede considerar seguro para el uso de mujeres en edad fértil, y su uso está estrictamente controlado cuando se usa para tratar otras enfermedades.
La metanfetamina está disponible con receta bajo la marca Desoxyn. El componente activo de Desoxyn es clorhidrato de dextrometanfetamina. Este es el isómero diestro de la metanfetamina. El isómero zurdo de la metanfetamina, la levometanfetamina, es un fármaco de venta libre que actúa menos a nivel central y más a nivel periférico.
La regla de Wallach (propuesta por primera vez por Otto Wallach) establece que los cristales racémicos tienden a ser más densos que sus contrapartes quirales. Esta regla ha sido corroborada por análisis de bases de datos cristalográficas.
En química física, la constante de Faraday, denotada por el símbolo F y a veces estilizada como ℱ, es la carga eléctrica por mol de cargas elementales.... (leer más)
Un agente reductor es una sustancia química que pierde o dona electrones a otra sustancia cuando ocurre una reacción química de reducción-oxidación... (leer más)
La Ley de Graham es un principio de la física de los gases, este principio establece que la velocidad de difusión y efusión de un gas, es inversamente... (leer más)