Vapor
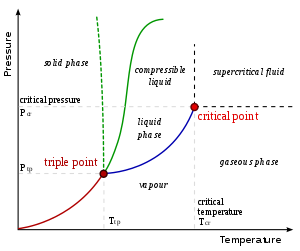
En física, un vapor (inglés americano) o vapor (inglés británico e inglés canadiense; consulte las diferencias ortográficas) es una sustancia en fase gaseosa a una temperatura inferior que su temperatura crítica, lo que significa que el vapor se puede condensar a líquido aumentando la presión sobre él sin reducir la temperatura. Un vapor es diferente de un aerosol. Un aerosol es una suspensión de partículas diminutas de líquido, sólido o ambos dentro de un gas.
Por ejemplo, el agua tiene una temperatura crítica de 647 K (374 °C; 705 °F), que es la temperatura más alta a la que puede existir agua líquida. En la atmósfera, a temperaturas ordinarias, el agua gaseosa (conocida como vapor de agua) se condensará en un líquido si su presión parcial aumenta lo suficiente.
Un vapor puede coexistir con un líquido (o un sólido). Cuando esto es cierto, las dos fases estarán en equilibrio y la presión parcial del gas será igual a la presión de equilibrio del vapor del líquido (o sólido).
Propiedades
Vapor se refiere a una fase gaseosa a una temperatura en la que la misma sustancia también puede existir en estado líquido o sólido, por debajo de la temperatura crítica de la sustancia. (Por ejemplo, el agua tiene una temperatura crítica de 374 °C (647 K), que es la temperatura más alta a la que puede existir agua líquida). Si el vapor está en contacto con una fase líquida o sólida, las dos fases estarán en un estado de equilibrio. El término gas se refiere a una fase fluida comprimible. Los gases fijos son gases para los que no se puede formar ningún líquido o sólido a la temperatura del gas, como el aire a temperaturas ambiente típicas. Un líquido o sólido no tiene que hervir para liberar un vapor.
El vapor es responsable de los procesos familiares de formación y condensación de nubes. Se emplea comúnmente para llevar a cabo los procesos físicos de destilación y extracción de espacio de cabeza de una muestra líquida antes de la cromatografía de gases.
Las moléculas constituyentes de un vapor poseen movimiento de vibración, rotación y traslación. Estos movimientos se consideran en la teoría cinética de los gases.
Presión de vapor
La presión de vapor es la presión de equilibrio de un líquido o un sólido a una temperatura específica. La presión de vapor de equilibrio de un líquido o sólido no se ve afectada por la cantidad de contacto con la interfaz líquida o sólida.
El punto de ebullición normal de un líquido es la temperatura a la que la presión de vapor es igual a la presión atmosférica normal.
Para los sistemas de dos fases (por ejemplo, dos fases líquidas), la presión de vapor de las fases individuales es igual. En ausencia de atracciones entre especies más fuertes entre moléculas similares o diferentes, la presión de vapor sigue la ley de Raoult, que establece que la presión parcial de cada componente es el producto de la presión de vapor del componente puro. y su fracción molar en la mezcla. La presión de vapor total es la suma de las presiones parciales de los componentes.
Ejemplos
- Los perfumes contienen sustancias químicas que vaporizan a diferentes temperaturas y a diferentes velocidades en los acuerdos de olores, conocidos como notas.
- El vapor de agua atmosférica se encuentra cerca de la superficie de la tierra, y puede condensarse en pequeñas gotas líquidas y formar fenómenos meteorológicos, como la niebla, la niebla y el haar.
- Lámparas de vapor de mercurio y sodio producen luz de átomos en estados excitados.
- Los líquidos inflamables no se queman cuando se enciende. Es la nube de vapor sobre el líquido que quemará si la concentración de vapor está entre el límite inferior inflamable (LFL) y el límite superior inflamable (UFL), del líquido inflamable.
Los cigarrillos electrónicos producen aerosoles, no vapores.
Medición de vapor
Al estar en fase gaseosa, la cantidad de vapor presente se cuantifica por la presión parcial del gas. Además, los vapores obedecen la fórmula barométrica en un campo gravitacional, tal como lo hacen los gases atmosféricos convencionales.
Contenido relacionado
Kobelita
Media vida
Enzima