Trímero (química)
En química, un trímero (del griego antiguo tri- 'tres' y -mer ' ;partes') es una molécula o anión poliatómico formado por combinación o asociación de tres moléculas o iones de una misma sustancia. En la jerga técnica, un trímero es un tipo de oligómero derivado de tres precursores idénticos que a menudo compiten con la polimerización.
Ejemplos
Trimerización de alquinos

En 1866, Marcelino Berthelot informó del primer ejemplo de ciclotrimerización, la conversión de acetileno en benceno. Este proceso fue comercializado:
Trimerización del nitrilo
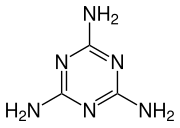
Las 1,3,5-triazinas simétricas se preparan mediante trimerización de ciertos nitrilos como el cloruro de cianógeno.
El cloruro de cianógeno y el bromuro de cianógeno se trimerizan a temperaturas elevadas sobre un catalizador de carbono. El cloruro da cloruro cianúrico:
El bromuro tiene una vida útil prolongada cuando se refrigera. Al igual que el cloruro, sufre una trimerización exotérmica para formar bromuro cianúrico. Esta reacción está catalizada por trazas de bromo, sales metálicas, ácidos y bases. Por esta razón, los experimentadores evitan las muestras de color marrón.
Una ruta industrial para obtener ácido cianúrico implica la descomposición térmica de la urea, con liberación de amoníaco. La conversión comienza aproximadamente a 175 °C:
- [C(O)NH]3 + 3 NH3}}}" xmlns="http://www.w3.org/1998/Math/MathML">3H2N− − CO− − NH2restablecimiento restablecimiento [C()O)NH]3+3NH3{displaystyle {ce {3 H2N-CO-NH2 - titulada [C(O)NH]3 + 3 NH3}}
[C(O)NH]3 + 3 NH3}}}" aria-hidden="true" class="mwe-math-fallback-image-inline mw-invert" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/6de156d81639cf3dcee9ba7233f13135ba2bfa91" style="vertical-align: -1.005ex; width:42.889ex; height:3.009ex;"/>
La síntesis endotérmica de melamina se puede entender en dos pasos.
Primero, la urea se descompone en ácido ciánico y amoníaco en una reacción endotérmica:
- HOCN + NH3}}}" xmlns="http://www.w3.org/1998/Math/MathML">()NH2)2COrestablecimiento restablecimiento HOCN+NH3{displaystyle {ce {(NH2)2CO - titulada HOCN + NH3}}
HOCN + NH3}}}" aria-hidden="true" class="mwe-math-fallback-image-inline mw-invert" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/9ea1259df26b9086e027c373f73c45a74db13086" style="vertical-align: -1.005ex; width:30.339ex; height:3.009ex;"/>
Luego en el segundo paso, el ácido cianínico polimeriza para formar ácido cianurico, que se condensa con el amoníaco liberado del primer paso para liberar melamina y agua.
- [C(O)NH]3}}}" xmlns="http://www.w3.org/1998/Math/MathML">3HOCNrestablecimiento restablecimiento [C()O)NH]3{fnMicrosoft Sans Serif}}
[C(O)NH]3}}}" aria-hidden="true" class="mwe-math-fallback-image-inline mw-invert" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/e6a34f3b03c3ba201baf55fca465c07bf72526c7" style="vertical-align: -1.005ex; width:24.747ex; height:3.009ex;"/>
- C3H6N6 + 3 H2O}}}" xmlns="http://www.w3.org/1998/Math/MathML">[C()O)NH]3+3NH3restablecimiento restablecimiento C3H6N6+3H2O{displaystyle {ce {}}}
C3H6N6 + 3 H2O}}}" aria-hidden="true" class="mwe-math-fallback-image-inline mw-invert" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/622a370fe2c00b97f4012e0e3294ddc0741bcc0f" style="vertical-align: -1.005ex; width:42.478ex; height:3.009ex;"/>
Esta agua luego reacciona con el ácido ciánico presente, lo que ayuda a impulsar la reacción de trimerización, generando dióxido de carbono y amoníaco.
- 3 CO2 + 3NH3}}}" xmlns="http://www.w3.org/1998/Math/MathML">3HOCN+3H2Orestablecimiento restablecimiento 3CO2+3NH3{displaystyle {ce {3 HOCN + 3 H2O - titulada 3 CO2 + 3NH3}}
3 CO2 + 3NH3}}}" aria-hidden="true" class="mwe-math-fallback-image-inline mw-invert" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/65922665c2a286e29b34247440ab67f2436c4ad9" style="vertical-align: -1.005ex; width:37.634ex; height:2.843ex;"/>
En total, el segundo paso es exotérmico:
- C3H6N6 + 3 CO2 + 3NH3}}}" xmlns="http://www.w3.org/1998/Math/MathML">6HCNO+3NH3restablecimiento restablecimiento C3H6N6+3CO2+3NH3{displaystyle {ce {6 HCNO + 3 NH3 - confianza C3H6N6 + 3 CO2 + 3NH3}}
C3H6N6 + 3 CO2 + 3NH3}}}" aria-hidden="true" class="mwe-math-fallback-image-inline mw-invert" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/aa2c542c4093d7d3c719fd8b0bbe6322ba90f937" style="vertical-align: -1.005ex; width:48.736ex; height:2.843ex;"/>
pero el proceso general es endotérmico.
Trimerización de dienos
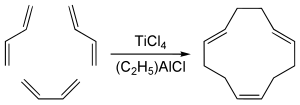
El isómero 1,5,9-trans-trans-cis del ciclododecatrieno, que tiene cierta importancia industrial, se obtiene mediante ciclotrimerización de butadieno con tetracloruro de titanio y un cocatalizador de organoaluminio:
La ruptura de los dobles enlaces carbono-heteroforma forma 1,3,5-heterociclos saturados simétricos
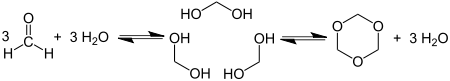
Ciclotrimerización de formaldehído ofrece 1,3,5-Trioxane:
El 1,3,5-tritiano es el trímero cíclico de la especie tioformaldehído, que de otro modo sería inestable. Este heterociclo consta de un anillo de seis miembros con puentes de metileno y grupos tioéter alternos. Se prepara mediante tratamiento de formaldehído con sulfuro de hidrógeno.
Tres moléculas de acetaldehído se condensan para formar paraldehído, un trímero cíclico que contiene enlaces simples C-O.
Catalizando y deshidratando con ácido sulfúrico, la trimerización de acetona mediante condensación aldólica produce mesitileno.
Trisiloxanos
El dimetilsilanodiol se deshidrata a un trímero de Me2SiO así como polidimetilsiloxano. La reacción ilustra la competencia entre trimerización y polimerización. El polímero y el trímero se derivan formalmente de la hipotética sila-cetona Me2Si=O, aunque esto La especie no es intermedia.
Química de coordinación
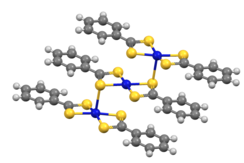
Los complejos de ditiobenzoato [M(S2CPh) 2] cristalizan como trímeros (M = Ni, Pd).
Contenido relacionado
Ley de Fick
Miscibilidad
Masa molar