Trimerización de alquinos
Una trimerización de alquino es una reacción de cicloadición [2+2+2] en la que tres unidades de alquino (C≡C) reaccionan para formar un anillo de benceno. La reacción requiere un catalizador metálico. El proceso es de interés histórico además de ser aplicable a la síntesis orgánica. Al ser una reacción de cicloadición, tiene una alta economía atómica. Se han desarrollado muchas variaciones, incluida la ciclación de mezclas de alquinos y alquenos, así como de alquinos y nitrilos.
Mecanismo y estereoquímica
La trimerización del acetileno a benceno es altamente exergónica y se produce con un cambio de energía libre de 142 kcal/mol a temperatura ambiente. Sin embargo, las barreras cinéticas impiden que la reacción se desarrolle sin problemas. El gran avance se produjo en 1948, cuando Walter Reppe y W. J. Schweckendiek informaron de sus resultados en tiempos de guerra que mostraban que los compuestos de níquel son catalizadores eficaces:
- C6R3H3}}}" xmlns="http://www.w3.org/1998/Math/MathML">3RC2Hrestablecimiento restablecimiento C6R3H3{displaystyle {ce {3 RC2H] C6R3H3}}}
C6R3H3}}}" aria-hidden="true" class="mwe-math-fallback-image-inline mw-invert" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/74a6b048d1c0f32ae80a532da14ec3ef094d9a3b" style="vertical-align: -1.005ex; width:21.126ex; height:2.843ex;"/>
Desde este descubrimiento, se han informado de muchas otras ciclotrimerizaciones.
Mecanismo
En términos de mecanismo, las reacciones comienzan con la formación de complejos metal-alquino. La combinación de dos alquinos dentro de la esfera de coordinación produce un metalaciclopentadieno. A partir del intermediario metalociclopentadieno, se pueden considerar muchas vías, incluidos metalocicloheptatrienos, metalanobornadienos y una estructura más complicada que presenta un ligando carbenoide.
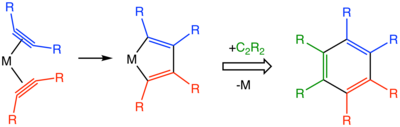
Los catalizadores utilizados incluyen ciclopentadienilcobalto dicarbonilo y catalizador de Wilkinson.
Estereoquímica y regioquímica
La trimerización de alquinos asimétricos da dos bencenos isoméricos. Por ejemplo, el fenilacetileno produce 1,3,5- y 1,2,4-C6R3H3. El patrón de sustitución alrededor del producto areno se determina en dos pasos: formación del intermedio metalociclopentadieno e incorporación del tercer equivalente de alquino. Se ha invocado el volumen estérico de los socios de acoplamiento alquino y del catalizador como elementos controladores de la regioselectividad.

Se han empleado catalizadores quirales en combinación con arinos para producir productos atropisoméricos no racémicos.
Alcance y limitaciones
Los catalizadores para la ciclotrimerización son selectivos para los triples enlaces, lo que le da a la reacción un alcance de sustrato bastante amplio. Se toleran muchos grupos funcionales. La trimerización intermolecular regioselectiva de alquinos asimétricos sigue siendo un problema sin resolver.
Quizás el desarrollo más útil en esta área, al menos desde la perspectiva comercial, sea la cotrimerización de nitrilos y alquinos. Esta reacción es una ruta práctica para algunas piridinas sustituidas.
Algunos catalizadores se desactivan mediante la formación de complejos η4 estables de 18 electrones. Se han observado complejos de ciclobutadieno, ciclohexadieno y areno como catalizadores inactivados fuera de ciclo. Además de los polímeros, dímeros y trímeros de alto orden, que se originan a partir de bajas regio y quimioselectividades, se han observado productos secundarios eninos derivados de la dimerización de alquinos. Los catalizadores de rodio son particularmente hábiles en la formación de eninos (ver más abajo). Para la catálisis del níquel, la formación de anillos más grandes (particularmente ciclooctatetraeno) puede ser un problema.
Aplicaciones sintéticas
La trimerización de Alkyne no tiene ningún valor práctico, aunque la reacción fue muy influyente. La cotrimerización de alquinos y nitriles en presencia de catalizadores organocobalto se ha comercializado para la producción de piridinas sustitutas.
La ciclación que involucra sustratos en los que algunas o todas las unidades de alquino están unidas entre sí puede proporcionar sistemas de anillos fusionados. La longitud de las ataduras controla los tamaños de los anillos adicionales. La adición de un 1,5-diino con un alquino produce un benzociclobuteno, una estructura tensa que luego puede inducirse a sufrir más reacciones.
Las tres unidades de alquino se pueden unir, lo que lleva a la creación de tres anillos en un solo paso, con cada uno de los dos tamaños de anillo adicionales controlados por las respectivas longitudes de la correa.
Los triinos abarrotados pueden ciclarse a productos que exhiben quiralidad helicoidal. En un ejemplo notable por la formación de tres nuevos anillos aromáticos en un solo paso, el triino que se muestra se transforma en el producto helicoidal mediante tratamiento con ciclopentadienilcobalto dicarbonilo. En 2004, este proceso aún no se había vuelto asimétrico, pero los productos podían separarse mediante HPLC quiral. La ciclación realizada con un diino y un alquino separado proporciona un mayor control. Usando ciclopentadienilcobalto dicarbonilo disponible comercialmente, CpCo(CO)2, como catalizador, el bis(trimetilsilil)acetileno (BTMSA) reaccionará con un benceno diino-1,2-disustituido para formar un sistema aromático de antroquinona:
El benceno, generado in situ a partir de un anillo de benceno que lleva sustituyentes triflato y trimetilsililo distribuidos orto, se puede utilizar para generar un arino en lugar de un acetileno y combinarlo con un diino adecuado. Un derivado de benceno de este tipo reacciona con 1,7-octadiino en presencia de un catalizador adecuado para generar un sistema de naftaleno. Este es un ejemplo de reacción hexadehidro Diels-Alder.

La trimerización de tres moléculas de 2-butino (dimetilacetileno) produce hexametilbenceno. La reacción está catalizada por tritetrahidrofuranato de trifenilcromo o por un complejo de triisobutilaluminio y tetracloruro de titanio.

La trimerización de tres moléculas de difenilacetileno produce hexafenilbenceno. La reacción está catalizada por dicobalto octacarbonilo.

Comparación con otros métodos
La ciclotrimerización presenta una alternativa a la funcionalización de compuestos aromáticos preformados mediante sustitución electrófila o nucleófila, cuya regioselectividad a veces puede ser difícil de controlar.
Otros métodos para la formación directa de anillos aromáticos a partir de precursores insaturados sustituidos incluyen la reacción de Dötz, la benzanulación [4+2] catalizada por paladio de eninos con alquinos y la cicloadición de eninos [4+2] mediada por ácido de Lewis. con alquinos. La ciclación de especies de bencino transitorias con alquinos, catalizada por paladio, también puede producir compuestos aromáticos sustituidos.
Contenido relacionado
Ley de Fick
Miscibilidad
Masa molar




