Tiocianato
tiocianatos son sales que contienen el anión tiocianato [SCN]−< /sup> (también conocido como rodanuro o rodanato). [SCN]- es la base conjugada del ácido tiociánico. Las sales comunes incluyen las sales incoloras tiocianato de potasio y tiocianato de sodio. El tiocianato de mercurio (II) se utilizaba antiguamente en pirotecnia.
El tiocianato es análogo al ion cianato, [OCN]−, en el que el oxígeno se reemplaza por azufre. [SCN]− es uno de los pseudohaluros, debido a la similitud de sus reacciones con la del haluro. iones. El tiocianato solía conocerse como rodanida (de la palabra griega que significa rosa) debido al color rojo de sus complejos con el hierro.
El tiocianato se produce mediante la reacción de azufre elemental o tiosulfato con cianuro:
La segunda reacción es catalizada por la tiosulfato sulfurtransferasa, una enzima mitocondrial hepática, y por otras transferasas de azufre, que en conjunto son responsables de alrededor del 80% del metabolismo del cianuro en el cuerpo.
Química biológica del tiocianato en medicina
Se sabe que el tiocianato es una parte importante en la biosíntesis de hipotiocianita mediante una lactoperoxidasa. Por lo tanto, la ausencia total de tiocianato o tiocianato reducido en el cuerpo humano (por ejemplo, fibrosis quística) es perjudicial para el sistema de defensa del huésped humano.
El tiocianato es un potente inhibidor competitivo del simportador de yoduro de sodio de la tiroides. El yodo es un componente esencial de la tiroxina. Dado que los tiocianatos disminuirán el transporte de yoduro hacia las células foliculares de la tiroides, disminuirán la cantidad de tiroxina producida por la glándula tiroides. Por lo tanto, es mejor que los pacientes con hipotiroidismo con deficiencia de yoduro eviten los alimentos que contienen tiocianato.
A principios del siglo XX, el tiocianato se utilizaba en el tratamiento de la hipertensión, pero ya no se utiliza debido a la toxicidad asociada. Sin embargo, el nitroprusiato de sodio, cuyo metabolito es el tiocianato, todavía se utiliza para el tratamiento de una emergencia hipertensiva. El rodanés cataliza la reacción del nitroprusiato de sodio con el tiosulfato para formar el metabolito tiocianato. El tiocianato también es un metabolito de la desintoxicación de cianuros por parte del rodanés.
Química de coordinación
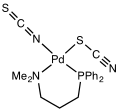
El tiocianato comparte su carga negativa aproximadamente por igual entre el azufre y el nitrógeno. Como consecuencia, el tiocianato puede actuar como nucleófilo en azufre o nitrógeno: es un ligando ambidentado. [SCN]− también puede unir dos (M−SCN−M) o incluso tres metales (>SCN− o −SCN<). La evidencia experimental lleva a la conclusión general de que los metales de clase A (ácidos duros) tienden a formar complejos de tiocianato con enlaces N, mientras que los metales de clase B (ácidos blandos) tienden a formar S. -complejos de tiocianato unidos. Otros factores, p. a veces están involucradas la cinética y la solubilidad, y puede ocurrir isomería de enlace, por ejemplo [Co(NH3)5(NCS)]Cl2 y [Co(NH3)5(SCN)]Cl2. [SCN] se considera un ligando débil. ([NCS] es un ligando fuerte)
Prueba de hierro(III) y cobalto(II)
Si se añade [SCN]- a una solución con iones de hierro (III), se forma una solución de color rojo sangre debido principalmente a la formación de [Fe(SCN)(H2O)5]2 +, es decir pentaaqua(tiocianato-N)hierro(III). También se forman cantidades menores de otros compuestos hidratados: p. Fe(SCN)3 y [Fe(SCN)4]−.
Del mismo modo, el Co2+ forma un complejo azul con el tiocianato. Tanto los complejos de hierro como los de cobalto se pueden extraer en disolventes orgánicos como el éter dietílico o el alcohol amílico. Esto permite la determinación de estos iones incluso en soluciones fuertemente coloreadas. La determinación de Co(II) en presencia de Fe(III) es posible añadiendo KF a la solución, que forma complejos incoloros y muy estables con Fe(III), que ya no reaccionan con SCN−.
Los fosfolípidos o algunos detergentes ayudan a la transferencia de tiocianatohierro a disolventes clorados como el cloroformo y se pueden determinar de esta manera.
Contenido relacionado
Ley de Fick
Masa molar
Miscibilidad




