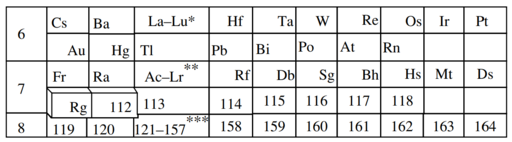
Tabla periódica extendida
Una tabla periódica extendida teoriza sobre elementos químicos más allá de los actualmente conocidos en la tabla periódica y probados. A partir de 2022, el elemento con el número atómico más alto conocido es oganesson (Z = 118), que completa el séptimo período (fila) en la tabla periódica. Todos los elementos en el octavo período y más allá siguen siendo puramente hipotéticos.
Los elementos más allá de 118 se colocarán en períodos adicionales cuando se descubran, dispuestos (como en los períodos existentes) para ilustrar tendencias periódicas recurrentes en las propiedades de los elementos en cuestión. Se espera que cualquier período adicional contenga una mayor cantidad de elementos que el séptimo período, ya que se calcula que tienen un llamado bloque g adicional, que contiene al menos 18 elementos con orbitales g parcialmente llenos en cada período. Glenn T. Seaborg sugirió una tabla de ocho períodos que contiene este bloque en 1969. El primer elemento del bloque g puede tener el número atómico 121 y, por lo tanto, tendría el nombre sistemático unbiunio. A pesar de muchas búsquedas, no se han sintetizado ni descubierto elementos en esta región en la naturaleza.
De acuerdo con la aproximación orbital en las descripciones mecánicas cuánticas de la estructura atómica, el bloque g correspondería a elementos con orbitales g parcialmente llenos, pero los efectos de acoplamiento espín-órbita reducen sustancialmente la validez de la aproximación orbital para elementos de alto número atómico. La versión de Seaborg del período extendido tenía los elementos más pesados siguiendo el patrón establecido por los elementos más ligeros, ya que no tenía en cuenta los efectos relativistas. Los modelos que tienen en cuenta los efectos relativistas predicen que el patrón se romperá. Pekka Pyykkö y Burkhard Fricke utilizaron modelos informáticos para calcular las posiciones de los elementos hasta Z = 172 y descubrieron que varios estaban desplazados de la regla de Madelung.Como resultado de la incertidumbre y la variabilidad en las predicciones de las propiedades químicas y físicas de los elementos más allá de 120, actualmente no hay consenso sobre su ubicación en la tabla periódica ampliada.
Es probable que los elementos de esta región sean muy inestables con respecto a la desintegración radiactiva y sufran desintegración alfa o fisión espontánea con vidas medias extremadamente cortas, aunque se supone que el elemento 126 se encuentra dentro de una isla de estabilidad que es resistente a la fisión pero no a la alfa. decadencia. También pueden ser posibles otras islas de estabilidad más allá de los elementos conocidos, incluida una teorizada en torno al elemento 164, aunque el alcance de los efectos estabilizadores de los proyectiles nucleares cerrados es incierto. No está claro cuántos elementos más allá de la isla de estabilidad esperada son físicamente posibles, si el período 8 está completo o si hay un período 9. La Unión Internacional de Química Pura y Aplicada (IUPAC) define que un elemento existe si su vida útil es más largo que 10segundos (0,01 picosegundos o 10 femtosegundos), que es el tiempo que tarda el núcleo en formar una nube de electrones.
Ya en 1940, se notó que una interpretación simplista de la ecuación relativista de Dirac se topa con problemas con los orbitales electrónicos en Z > 1/α ≈ 137, lo que sugiere que los átomos neutros no pueden existir más allá del elemento 137, y que una tabla periódica de elementos basada en en los orbitales electrónicos, por lo tanto, se descompone en este punto. Por otro lado, un análisis más riguroso calcula que el límite análogo es Z ≈ 173 donde la subcapa 1s se sumerge en el mar de Dirac, y que en cambio no son átomos neutros que no pueden existir más allá del elemento 173, sino núcleos desnudos, por lo que no plantean obstáculo para una mayor extensión del sistema periódico. Los átomos más allá de este número atómico crítico se llaman átomos supercríticos.
Historia
La existencia de elementos más pesados más allá de los actínidos se propuso por primera vez en 1895, cuando el químico danés Hans Peter Jørgen Julius Thomsen predijo que el torio y el uranio formaban parte de un período de 32 elementos que terminaría en un elemento químicamente inactivo con peso atómico 292 (no muy lejos de los 294 conocidos hoy por el primer y único isótopo descubierto de oganesson). En 1913, el físico sueco Johannes Rydberg predijo de manera similar que el próximo gas noble después del radón tendría el número atómico 118, y derivó puramente formalmente congéneres aún más pesados del radón en Z = 168, 218, 290, 362 y 460, exactamente donde el Aufbau principio prediría que serían. Niels Bohr predijo en 1922 la estructura electrónica de este próximo gas noble en Z = 118, y sugirió que la razón por la cual los elementos más allá del uranio no se veían en la naturaleza era porque eran demasiado inestables. El físico e ingeniero alemán Richard Swinne publicó un artículo de revisión en 1926 que contenía predicciones sobre los elementos transuránicos (él pudo haber acuñado el término) en el que anticipó las predicciones modernas de una isla de estabilidad: había formulado la hipótesis desde 1914 de que las vidas medias no deberían disminuir estrictamente con el número atómico, pero sugirió en cambio que podría haber algunos elementos de vida más larga en Z = 98–102 y Z = 108–110, y especuló que tales elementos podrían existir en el núcleo de la Tierra, en meteoritos de hierro o en el casquetes polares de Groenlandia donde habían estado encerrados desde su supuesto origen cósmico. Para 1955, estos elementos fueron llamadoselementos superpesados.
Las primeras predicciones sobre las propiedades de los elementos superpesados no descubiertos se realizaron en 1957, cuando se exploró por primera vez el concepto de capas nucleares y se teorizó que existía una isla de estabilidad alrededor del elemento 126. En 1967, se realizaron cálculos más rigurosos y la isla de estabilidad se teorizó que estaba centrado en el flerovium entonces no descubierto (elemento 114); este y otros estudios posteriores motivaron a muchos investigadores a buscar elementos superpesados en la naturaleza o intentar sintetizarlos en aceleradores. En la década de 1970 se realizaron muchas búsquedas de elementos superpesados, todas con resultados negativos. A partir de abril de 2022, se ha intentado la síntesis de todos los elementos hasta el unbiseptio incluido (Z = 127), excepto el unbitrio (Z = 123),siendo el elemento más pesado sintetizado con éxito el oganesson en 2002 y el descubrimiento más reciente el de tennessine en 2010.
Como se predijo que algunos elementos superpesados se encontraban más allá de la tabla periódica de siete períodos, Glenn T. Seaborg propuso por primera vez un octavo período adicional que contenía estos elementos en 1969. Este modelo continuó el patrón en elementos establecidos e introdujo un nuevo bloque g y serie de superactínidos que comienza en el elemento 121, elevando el número de elementos en el período 8 en comparación con los períodos conocidos. Sin embargo, estos primeros cálculos no consideraron los efectos relativistas que rompen las tendencias periódicas y hacen imposible la extrapolación simple. En 1971, Fricke calculó la tabla periódica hasta Z = 172, y descubrió que efectivamente algunos elementos tenían propiedades diferentes que rompen el patrón establecido,y un cálculo de 2010 de Pekka Pyykkö también señaló que varios elementos podrían comportarse de manera diferente a lo esperado. Se desconoce hasta dónde podría extenderse la tabla periódica más allá de los 118 elementos conocidos, ya que se prevé que los elementos más pesados sean cada vez más inestables. Glenn T. Seaborg sugirió que, en términos prácticos, el final de la tabla periódica podría llegar alrededor de Z = 120 debido a la inestabilidad nuclear.
Estructuras predichas de una tabla periódica extendida
Actualmente no hay consenso sobre la ubicación de los elementos más allá del número atómico 120 en la tabla periódica.
Todos estos elementos hipotéticamente no descubiertos son nombrados por el estándar de nombre de elemento sistemático de la Unión Internacional de Química Pura y Aplicada (IUPAC), que crea un nombre genérico para usar hasta que el elemento haya sido descubierto, confirmado y aprobado un nombre oficial. Estos nombres generalmente no se usan en la literatura y se los menciona por sus números atómicos; por lo tanto, el elemento 164 generalmente no se llamaría "unhexquadium" o "Uhq" (el nombre y símbolo sistemático de la IUPAC), sino "elemento 164" con el símbolo "164", "(164)" o "E164".
Principio de aufbau
En el elemento 118, se supone que los orbitales 1s, 2s, 2p, 3s, 3p, 3d, 4s, 4p, 4d, 4f, 5s, 5p, 5d, 5f, 6s, 6p, 6d, 7s y 7p están llenos, con los orbitales restantes vacíos. Una simple extrapolación del principio de Aufbau predeciría la octava fila para llenar orbitales en el orden 8s, 5g, 6f, 7d, 8p; pero después del elemento 120, la proximidad de las capas de electrones hace que la colocación en una tabla simple sea problemática.
| vtmitabla periodica extendida | ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 1hora | 2el | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2 | 3litros | 4ser | 5B _ | 6C _ | 7norte | 8O _ | 9F _ | 10ne | ||||||||||||||||||||||||||||||||||||||||||
| 3 | 11na | 12mg | 13Al | 14años | 15P _ | 16S | 17cl _ | 18Ar | ||||||||||||||||||||||||||||||||||||||||||
| 4 | 19K _ | 20Ca | 21sc | 22Ti | 23V_ | 24Cr | 25millones | 26 defebrero | 27años | 28Ni | 29cu | 30Zn | 31años | 32años | 33como | 34se | 35habitaciones | 36coronas | ||||||||||||||||||||||||||||||||
| 5 | 37rb | 38años | 39años | 40coronas | 41nota | 42meses | 43Tc | 44ru | 45Rh | 46PD | 47Ag | 48CD | 49en | 50Sn | 51segundos | 52Te | 53yo | 54Xe | ||||||||||||||||||||||||||||||||
| 6 | 55C | 56años | 57La | 58d.C. | 59_ | 60nd | 61p. m. | 62cm | 63euros | 64Di-s | 65TB_ | 66años | 67años | 68Er | 69toneladas | 70Yb | 71Lu | 72hf | 73años | 74W_ | 75Re | 76años | 77Ir | 78puntos | 79au | 80Hg | 81mil | 82Pb | 83Bi | 84Po | 85a las | 86Rn | ||||||||||||||||||
| 7 | 87franco | 88Ra | 89Ac | 90jul | 91pa | 92tu | 93_ | 94PU | 95a. m. | 96cm | 97negro | 98Cf. | 99es | 100FM | 101MD | 102No | 103litros | 104RF | 105DB | 106Sg | 107BH | 108horas | 109toneladas | 110Ds | 111g | 112cn | 113euros | 114fl | 115Mc | 116niveles | 117centavos | 118Og | ||||||||||||||||||
| 8 | 119_ | 120Ubn | 121Ubú | 122_ | 123Ub | 124_ | 125Ubp | 126_ | 127Ub_ | 128Ubo | 129Ube | 130Utn | 131Utu | 132Utb | 133Utt | 134_ | 135Upp | 136uth | 137Ud. | 138hasta | 139_ | 140Uqn | 141_ | 142Uqb | 143Uqt | 144_ | 145Uqp | 146_ | 147uqs | 148_ | 149_ | 150arriba | 151_ | 152arriba | 153arriba | 154Upq | 155arriba | 156hasta | 157arriba | 158hasta | 159arriba | 160uh | 161_ | 162_ | 163_ | 164_ | 165caballos de fuerza | 166_ | 167uh | 168oh |
Leyenda
- v
- t
- mi
| bloque s | bloque g | bloque f | bloque d | bloque p |
Pyykkö
No todos los modelos muestran los elementos superiores siguiendo el patrón establecido por los elementos más ligeros. Pekka Pyykkö, por ejemplo, usó modelos informáticos para calcular las posiciones de los elementos hasta Z = 172 y sus posibles propiedades químicas en un artículo publicado en 2011. Descubrió que varios elementos fueron desplazados de la regla de ordenación de energía de Madelung como resultado de orbitales superpuestos; esto se debe al papel cada vez mayor de los efectos relativistas en los elementos pesados.

Fricke
Burkhard Fricke et al., quienes realizaron cálculos hasta el elemento 184 en un artículo publicado en 1971, también encontraron algunos elementos desplazados del principio de Aufbau como consecuencia de efectos relativistas.
| H | Él | |||||||||||||||||||||||||||||||
| li | Ser | B | C | norte | O | F | Nordeste | |||||||||||||||||||||||||
| N / A | magnesio | Alabama | Si | PAGS | S | cl | Arkansas | |||||||||||||||||||||||||
| k | California | Carolina del Sur | ti | V | cr | Minnesota | Fe | Co | Ni | cobre | zinc | Georgia | ge | Como | Se | hermano | kr | |||||||||||||||
| Rb | señor | Y | Zr | Nótese bien | Mes | tc | ru | Rh | PD | Agricultura | Discos compactos | En | sn | Sb | Te | yo | Xe | |||||||||||||||
| cs | Licenciado en Letras | La | Ce | PR | Dakota del Norte | Pm | pequeño | UE | Di-s | Tuberculosis | dy | Ho | Eh | Tm | Yb | Lu | H.f. | Ejército de reserva | W | Re | Os | ir | punto | Au | Hg | Tl | Pb | Bi | Correos | A | Rn | |
| fr | Real academia de bellas artes | C.A | el | Pensilvania | tu | Notario público | PU | Soy | Cm | negro | Cf. | ES | FM | Maryland | No | Lr | radiofrecuencia | DB | sg | bh | hs | Monte | Ds | Rg | cn | Nueva Hampshire | Florida | Mc | Lv | ts | og | |
| 119 | 120 | 121 | 122–141 | 142 | 143 | 144 | 145 | 146 | 147 | 148 | 149 | 150 | 151 | 152 | 153 | 154 | 155 | 156 | 157 | 158 | 159 | 160 | 161 | 162 | 163 | 164 | ||||||
| 165 | 166 | 167 | 168 | 169 | 170 | 171 | 172 |
Nefedov
Nefedov [ ru ], Trzhaskovskaya y Yarzhemskii realizaron cálculos hasta 164 (resultados publicados en 2006). Contrariamente a Pyykkö, así como a Fricke et al., consideraron que los elementos 158 a 164 eran homólogos de los grupos 4 a 10, y no 6 a 12, notando similitudes de configuraciones electrónicas con los metales de transición del período 5. Los elementos 111 y 112 se desplazan del plano para reflejar diferentes configuraciones de Au y Hg.
 Forma sugerida por Nefedov et al. (fragmento, forma abreviada de 8 columnas para los elementos pesados)
Forma sugerida por Nefedov et al. (fragmento, forma abreviada de 8 columnas para los elementos pesados)
Kulsha
El químico computacional Andrey Kulsha ha sugerido dos formas de la tabla periódica extendida. Según sus propiedades químicas probables, los elementos 157–172 se colocan como congéneres del octavo período del itrio al xenón en el quinto período; esto concuerda con los cálculos de 2006 de Nefedov et al. En la primera sugerencia de Kulsha (2011, después de la publicación del artículo de Pyykkö), los elementos 121–138 y 139–156 se colocan como dos filas separadas (llamadas juntas "elementos de ultratransición"), relacionadas por la adición de una subcapa de 5g en el núcleo, como imitan respectivamente a los lantánidos y actínidos. En su segunda sugerencia (2016), los elementos 121–142 forman un bloque g (ya que tienen una actividad de 5 g), mientras que los elementos 143–156 forman un bloque f colocado bajo actinio a través de nobelio.
 Primera forma sugerida de Kulsha
Primera forma sugerida de Kulsha
 Segunda forma sugerida de Kulsha
Segunda forma sugerida de Kulsha
Búsquedas de elementos no descubiertos
Intentos de síntesis
Se han realizado intentos fallidos de sintetizar los elementos del período 8 hasta el unbiseptio, excepto el unbitrio. Los intentos de sintetizar ununennium, el primer elemento del período 8, están en curso a partir de 2022.
Ununenio
La síntesis del elemento 119 (ununenio) se intentó por primera vez en 1985 bombardeando un objetivo de einstenio-254 con iones de calcio-48 en el acelerador superHILAC en Berkeley, California:99ES+20California→ 119* → sin átomos
No se identificaron átomos, lo que lleva a una sección transversal límite de 300 nb. Cálculos posteriores sugieren que la sección transversal de la reacción 3n (que daría como resultado 119 y tres neutrones como productos) sería en realidad seiscientas mil veces menor que este límite superior, a 0,5 pb.
De abril a septiembre de 2012, se intentó sintetizar los isótopos 119 y 119 bombardeando un objetivo de berkelio-249 con titanio-50 en el Centro GSI Helmholtz para la Investigación de Iones Pesados en Darmstadt, Alemania. Según la sección transversal predicha teóricamente, se esperaba que se sintetizara un átomo de ununenio dentro de los cinco meses posteriores al comienzo del experimento. Además, como el berkelio-249 se descompone en californio-249 (el siguiente elemento) con una vida media corta de 327 días, esto permitió buscar los elementos 119 y 120 simultáneamente.97negro+22ti→ 119* → 119 + 30norte97negro+22ti→ 119* → 119 + 40norte
Originalmente, se planeó que el experimento continuara hasta noviembre de 2012, pero se detuvo antes de tiempo para hacer uso del objetivo Bk para confirmar la síntesis de tennessina (cambiando así los proyectiles a Ca). Se predijo que esta reacción entre Bk y Ti sería la reacción práctica más favorable para la formación del elemento 119, ya que es bastante asimétrica, aunque también algo fría. (La reacción entre Es y Ca sería superior, pero es difícil preparar cantidades de miligramos de Es para un objetivo). Sin embargo, el cambio necesario de la "bala de plata" Ca aTi divide el rendimiento esperado del elemento 119 por aproximadamente veinte, ya que el rendimiento depende en gran medida de la asimetría de la reacción de fusión.
Debido a las vidas medias cortas pronosticadas, el equipo de GSI utilizó nueva electrónica "rápida" capaz de registrar eventos de descomposición en microsegundos. No se identificaron átomos del elemento 119, lo que implica una sección transversal límite de 70 fb. La sección transversal real prevista es de alrededor de 40 fb, que está en los límites de la tecnología actual.
El equipo del Instituto Conjunto para la Investigación Nuclear en Dubna, Rusia, planeó comenzar los experimentos sobre la síntesis de los elementos 119 y 120 usando las reacciones Bk+ Ti y Cf+ Ti en 2019 usando un nuevo complejo experimental. El equipo de RIKEN en Japón también planeó realizar intentos con estos elementos a partir de 2018 con objetivos Cm utilizando las reacciones Cm+ V y Cm+ Cr. El primero ha estado en marcha desde junio de 2018.
Unbinilio
Tras su éxito en la obtención de oganesón por la reacción entre Cf y Ca en 2006, el equipo del Instituto Conjunto para la Investigación Nuclear (JINR) en Dubna inició experimentos similares en marzo-abril de 2007, con la esperanza de crear el elemento 120 (unbinilium) a partir de núcleos. de Fe y Pu. Se predice que los isótopos de unbinilium tienen vidas medias de desintegración alfa del orden de microsegundos. El análisis inicial reveló que no se produjeron átomos del elemento 120, proporcionando un límite de 400 fb para la sección transversal a la energía estudiada.94PU+26Fe→ 120* → sin átomos
El equipo ruso planeó mejorar sus instalaciones antes de volver a intentar la reacción.
En abril de 2007, el equipo del Centro GSI Helmholtz para la Investigación de Iones Pesados en Darmstadt, Alemania, intentó crear el elemento 120 usando uranio-238 y níquel-64:92tu+28Ni→ 120* → sin átomos
No se detectaron átomos proporcionando un límite de 1,6 pb para la sección transversal a la energía proporcionada. El GSI repitió el experimento con mayor sensibilidad en tres ejecuciones separadas en abril-mayo de 2007, enero-marzo de 2008 y septiembre-octubre de 2008, todas con resultados negativos, alcanzando un límite de sección transversal de 90 fb.
En junio-julio de 2010, y nuevamente en 2011, después de actualizar su equipo para permitir el uso de objetivos más radiactivos, los científicos del GSI intentaron la reacción de fusión más asimétrica:96Cm+24cr→ 120 → sin átomos
Se esperaba que el cambio en la reacción quintuplicara la probabilidad de sintetizar el elemento 120, ya que el rendimiento de tales reacciones depende en gran medida de su asimetría. Se observaron tres señales correlacionadas que coincidían con las energías de desintegración alfa predichas de 120 y su hija Og, así como con la energía de desintegración conocida experimentalmente de su nieta Lv. Sin embargo, la vida útil de estas posibles desintegraciones fue mucho más larga de lo esperado y los resultados no pudieron confirmarse.
En agosto-octubre de 2011, un equipo diferente de GSI que utilizó las instalaciones de TASCA probó una reacción nueva, aún más asimétrica:98Cf.+22ti→ 120* → sin átomos
Debido a su asimetría, se predijo que la reacción entre Cf y Ti sería la reacción práctica más favorable para sintetizar unbinilium, aunque también es algo fría. No se identificaron átomos de unbinilium, lo que implica una sección transversal límite de 200 fb. Jens Volker Kratz predijo que la sección transversal máxima real para producir el elemento 120 mediante cualquiera de estas reacciones sería de alrededor de 0,1 fb; en comparación, el récord mundial de la sección transversal más pequeña de una reacción exitosa fue de 30 fb para la reacción Bi(Zn,n)Nh, y Kratz predijo una sección transversal máxima de 20 fb para producir el elemento vecino 119.Si estas predicciones son precisas, entonces el elemento de síntesis 119 estaría en los límites de la tecnología actual, y el elemento de síntesis 120 requeriría nuevos métodos.
Unbiunio
La síntesis del elemento 121 (unbiunio) se intentó por primera vez en 1977 bombardeando un objetivo de uranio-238 con iones de cobre-65 en la Gesellschaft für Schwerionenforschung en Darmstadt, Alemania:92tu+29cobre→ 121* → sin átomos
No se identificaron átomos.
Unbibio
Los primeros intentos de sintetizar el elemento 122 (unbibium) se realizaron en 1972 por Flerov et al. en el Instituto Conjunto para la Investigación Nuclear (JINR), utilizando las reacciones de fusión en caliente inducidas por iones pesados:92tu+30zinc→ 122* → sin átomos
Estos experimentos fueron motivados por las primeras predicciones sobre la existencia de una isla de estabilidad en N = 184 y Z > 120. No se detectaron átomos y se midió un límite de rendimiento de 5 nb (5000 pb). Los resultados actuales (ver flerovium) han demostrado que la sensibilidad de estos experimentos fue demasiado baja en al menos 3 órdenes de magnitud.
En 2000, el Centro Helmholtz de Investigación de Iones Pesados de Gesellschaft für Schwerionenforschung (GSI) realizó un experimento muy similar con una sensibilidad mucho mayor:92tu+30zinc→ 122* → sin átomos
Estos resultados indican que la síntesis de estos elementos más pesados sigue siendo un desafío importante y se requieren mejoras adicionales en la intensidad del haz y la eficiencia experimental. La sensibilidad debe aumentarse a 1 fb en el futuro para obtener resultados de mayor calidad.
Otro intento fallido de sintetizar el elemento 122 se llevó a cabo en 1978 en el Centro GSI Helmholtz, donde se bombardeó un objetivo de erbio natural con iones de xenón-136:68Eh+54Xe→ 122* → sin átomos
En particular, se esperaba que la reacción entre Er y Xe produjera emisores alfa con vidas medias de microsegundos que se descompondrían en isótopos de flerovio con vidas medias que podrían aumentar hasta varias horas, ya que se predice que el flerovio se encuentra cerca del centro. de la isla de la estabilidad. Después de doce horas de irradiación, no se encontró nada en esta reacción. Tras un intento fallido similar de sintetizar el elemento 121 a partir de U y Cu, se concluyó que la vida media de los núcleos superpesados debe ser inferior a un microsegundo o las secciones transversales son muy pequeñas. Investigaciones más recientes sobre la síntesis de elementos superpesados sugieren que ambas conclusiones son ciertas.Los dos intentos en la década de 1970 para sintetizar el elemento 122 fueron impulsados por la investigación que investigaba si los elementos superpesados podrían existir potencialmente de forma natural.
Entre 2000 y 2004 se realizaron varios experimentos que estudiaban las características de fisión de varios núcleos de compuestos superpesados como el 122* en el Laboratorio de Reacciones Nucleares de Flerov. Se utilizaron dos reacciones nucleares, a saber, Cm + Fe y Pu + Ni.
Unbicuadio
Los científicos de GANIL (Grand Accélérateur National d'Ions Lourds) intentaron medir la fisión directa y retardada de núcleos compuestos de elementos con Z = 114, 120 y 124 para investigar los efectos de capa en esta región y señalar el siguiente protón esférico. caparazón. Esto se debe a que tener capas nucleares completas (o, de manera equivalente, tener un número mágico de protones o neutrones) conferiría más estabilidad a los núcleos de tales elementos superpesados, acercándose así a la isla de estabilidad. En 2006, con los resultados completos publicados en 2008, el equipo proporcionó los resultados de una reacción que implicaba el bombardeo de un objetivo de germanio natural con iones de uranio:92tu+32ge→ 124* → fisión
El equipo informó que habían podido identificar la fisión de núcleos compuestos con vidas medias > 10 s. Este resultado sugiere un fuerte efecto estabilizador en Z = 124 y apunta a la siguiente capa de protones en Z > 120, no en Z = 114 como se pensaba anteriormente. Un núcleo compuesto es una combinación suelta de nucleones que aún no se han organizado en capas nucleares. No tiene estructura interna y se mantiene unido solo por las fuerzas de colisión entre el objetivo y los núcleos del proyectil. Se estima que requiere alrededor de 10 s para que los nucleones se organicen en capas nucleares, momento en el que el núcleo compuesto se convierte en un nucleido, y la IUPAC utiliza este número como la vida media mínima que debe tener un isótopo declarado para ser potencialmente reconocido como descubierto. Por lo tanto, los experimentos de GANIL no cuentan como un descubrimiento del elemento 124.
La fisión del núcleo compuesto 124 también se estudió en 2006 en el acelerador de iones pesados ALPI en tándem en el Laboratori Nazionali di Legnaro (Laboratorios Nacionales de Legnaro) en Italia:90el+34Se→ 124* → fisión
De manera similar a los experimentos anteriores realizados en el JINR (Instituto Conjunto para la Investigación Nuclear), los fragmentos de fisión se agruparon alrededor de núcleos doblemente mágicos como Sn (Z = 50, N = 82), lo que revela una tendencia de los núcleos superpesados a expulsar tales núcleos doblemente mágicos en la fisión.. También se encontró que el número promedio de neutrones por fisión del núcleo compuesto 124 (en relación con los sistemas más livianos) aumentó, lo que confirma que la tendencia de los núcleos más pesados que emiten más neutrones durante la fisión continúa en la región de masa superpesada.
Unbipencio
El primer y único intento de sintetizar el elemento 125 (unbipentium) se realizó en Dubna en 1970-1971 utilizando iones de zinc y un objetivo de americio-243:95Soy+30zinc→ 125* → sin átomos
No se detectaron átomos y se determinó un límite de sección transversal de 5 nb. Este experimento fue motivado por la posibilidad de una mayor estabilidad para los núcleos alrededor de Z ~ 126 y N ~ 184, aunque investigaciones más recientes sugieren que la isla de estabilidad puede encontrarse en un número atómico más bajo (como el copernicio, Z = 112), y el la síntesis de elementos más pesados como el elemento 125 requerirá experimentos más sensibles.
Unbihexio
El primer y único intento de sintetizar el elemento 126 (unbihexio), que no tuvo éxito, fue realizado en 1971 en el CERN (Organización Europea para la Investigación Nuclear) por René Bimbot y John M. Alexander utilizando la reacción de fusión en caliente:90el+36kr→ 126* → sin átomos
Se observaron partículas alfa de alta energía (13-15 MeV) y se tomaron como posible evidencia de la síntesis del elemento 126. Experimentos posteriores fallidos con mayor sensibilidad sugieren que la sensibilidad de 10 mb de este experimento era demasiado baja; por lo tanto, la formación de núcleos del elemento 126 en esta reacción es muy poco probable.
Unbiseptium
El primer y único intento de sintetizar el elemento 127 (unbiseptium), que no tuvo éxito, se realizó en 1978 en el acelerador UNILAC en el Centro GSI Helmholtz, donde se bombardeó un objetivo de tantalio natural con iones de xenón-136:73Ejército de reserva+54Xe→ 127* → sin átomos
Búsquedas en la naturaleza
Un estudio realizado en 1976 por un grupo de investigadores estadounidenses de varias universidades propuso que los elementos primordiales superpesados, principalmente el livermorio, los elementos 124, 126 y 127, podrían ser una causa de daño por radiación inexplicable (particularmente radiohalos) en minerales. Esto llevó a muchos investigadores a buscarlos en la naturaleza desde 1976 hasta 1983. Un grupo dirigido por Tom Cahill, profesor de la Universidad de California en Davis, afirmó en 1976 que habían detectado partículas alfa y rayos X con las energías adecuadas para causan el daño observado, apoyando la presencia de estos elementos. En particular, la presencia de núcleos de vida larga (del orden de 10 años) de los elementos 124 y 126, junto con sus productos de descomposición, con una abundancia de 10en relación con sus posibles congéneres uranio y plutonio, se conjeturó. Otros afirmaron que no se había detectado ninguno y cuestionaron las características propuestas de los núcleos superpesados primordiales. En particular, citaron que cualquiera de estos núcleos superpesados debe tener una capa de neutrones cerrada en N = 184 o N = 228, y esta condición necesaria para una mayor estabilidad solo existe en isótopos deficientes en neutrones de livermorio o isótopos ricos en neutrones de los otros elementos que no ser beta-estable a diferencia de la mayoría de los isótopos naturales. También se propuso que esta actividad fuera causada por transmutaciones nucleares en el cerio natural, lo que generó más ambigüedad sobre esta supuesta observación de elementos superpesados.
El 24 de abril de 2008, un grupo dirigido por Amnon Marinov en la Universidad Hebrea de Jerusalén afirmó haber encontrado átomos individuales de 122 en depósitos de torio naturales con una abundancia de entre 10 y 10 en relación con el torio. La afirmación de Marinov et al. fue criticado por una parte de la comunidad científica. Marinov afirmó que había enviado el artículo a las revistas Nature y Nature Physics, pero ambas lo rechazaron sin enviarlo a revisión por pares. Se afirmó que los 122 átomos eran isómeros superdeformados o hiperdeformados, con una vida media de al menos 100 millones de años.
En 2008, se publicó una crítica de la técnica, utilizada anteriormente para supuestamente identificar isótopos de torio más ligeros mediante espectrometría de masas, en Physical Review C. Una refutación del grupo Marinov se publicó en Physical Review C después del comentario publicado.
Una repetición del experimento con torio usando el método superior de espectrometría de masas con acelerador (AMS) no pudo confirmar los resultados, a pesar de una sensibilidad 100 veces mayor. Este resultado genera dudas considerables sobre los resultados de la colaboración de Marinov con respecto a sus afirmaciones de isótopos de vida prolongada de torio, roentgenio y elemento 122. Todavía es posible que solo existan rastros de unbibium en algunas muestras de torio, aunque esto es poco probable..
La posible extensión de los elementos superpesados primordiales en la Tierra hoy en día es incierta. Incluso si se confirma que causaron el daño por radiación hace mucho tiempo, es posible que ahora se hayan reducido a meros rastros, o incluso que hayan desaparecido por completo. También es incierto si tales núcleos superpesados se pueden producir naturalmente, ya que se espera que la fisión espontánea termine el proceso r responsable de la formación de elementos pesados entre el número de masa 270 y 290, mucho antes de que se formen elementos más allá de 120.
Una hipótesis reciente trata de explicar el espectro de la estrella de Przybylski por el flerovium y el elemento 120 de origen natural.
Propiedades predichas de los elementos del octavo período
El elemento 118, oganesson, es el elemento más pesado que se ha sintetizado. Los siguientes dos elementos, los elementos 119 y 120, deben formar una serie 8s y ser un metal alcalino y alcalinotérreo respectivamente. Más allá del elemento 120, se espera que comience la serie de superactínidos, cuando los electrones 8s y el llenado de las subcapas 8p 1/2, 7d 3/2, 6f y 5g determinen la química de estos elementos. No se dispone de cálculos CCSD completos y precisos para elementos más allá de 122 debido a la extrema complejidad de la situación: los orbitales 5g, 6f y 7d deberían tener aproximadamente el mismo nivel de energía, y en la región del elemento 160, los 9s, 8p 3 /2 y 9p 1/2los orbitales también deben tener aproximadamente la misma energía. Esto hará que las capas de electrones se mezclen, de modo que el concepto de bloque ya no se aplica muy bien, y también dará como resultado nuevas propiedades químicas que harán que sea muy difícil colocar algunos de estos elementos en una tabla periódica.
 Valores propios de energía (en eV) para los electrones más externos de elementos con Z = 100 a 172, predichos mediante cálculos de Dirac-Fock. Los signos − y + se refieren a orbitales con número cuántico azimutal disminuido o aumentado a partir de la división espín-órbita respectivamente: p− es p
Valores propios de energía (en eV) para los electrones más externos de elementos con Z = 100 a 172, predichos mediante cálculos de Dirac-Fock. Los signos − y + se refieren a orbitales con número cuántico azimutal disminuido o aumentado a partir de la división espín-órbita respectivamente: p− es p
1/2, p+ es p
3/2, d− es d
3/2, d+ es d
5/ 2, f− es f
5/2, f+ es f
7/2, g− es g
7/2 y g+ es g
9/2.
Propiedades químicas y físicas
Elementos 119 y 120
| Propiedad | 119 | 120 |
|---|---|---|
| peso atómico estándar | [322] | [325] |
| Grupo | 1 | 2 |
| Configuración electrónica de valencia | 8s | 8s |
| Estados de oxidación estables | 1, 3 | 2, 4 |
| Primera energía de ionización | 463,1 kJ/mol | 563,3 kJ/mol |
| Radio metálico | 260 horas | 200 p. m. |
| Densidad | 3 g/cm2 | 7 g/cm2 |
| Punto de fusion | 0–30 °C (32–86 °F) | 680 °C (1300 °F) |
| Punto de ebullición | 630 °C (1200 °F) | 1700 °C (3100 °F) |
Los primeros dos elementos del período 8 serán ununennium y unbinilium, elementos 119 y 120. Sus configuraciones electrónicas deberían tener el orbital 8s lleno. Este orbital está relativistamente estabilizado y contraído; por lo tanto, los elementos 119 y 120 deberían parecerse más al rubidio y al estroncio que a sus vecinos inmediatos anteriores, el francio y el radio. Otro efecto de la contracción relativista del orbital 8s es que los radios atómicos de estos dos elementos deben ser aproximadamente los mismos que los del francio y el radio. Deberían comportarse como metales alcalinos y alcalinotérreos normales (aunque menos reactivos que sus vecinos verticales inmediatos), normalmente formando estados de oxidación +1 y +2 respectivamente, pero la desestabilización relativista de la subcapa 7p 3/2 y las energías de ionización relativamente bajas de el 7p3/2 electrones también deberían hacer posibles estados de oxidación más altos como +3 y +4 (respectivamente).
Superactínidos
Se puede considerar que los superactínidos van desde los elementos 121 al 157, que se pueden clasificar como los elementos 5g y 6f del octavo período, junto con el primer elemento 7d. En la serie de superactínidos, las conchas 7d 3/2, 8p 1/2, 6f 5/2 y 5g 7/2 deben llenarse todas simultáneamente. Esto crea situaciones muy complicadas, tanto que se han realizado cálculos CCSD completos y precisos solo para los elementos 121 y 122. El primer superactínido, unbiunio (elemento 121), debería ser similar al lantano y al actinio:su estado de oxidación principal debería ser +3, aunque la proximidad de los niveles de energía de las subcapas de valencia puede permitir estados de oxidación más altos, al igual que en los elementos 119 y 120. La estabilización relativista de la subcapa 8p debería dar como resultado un electrón de valencia de estado fundamental 8s 8p configuración para el elemento 121, en contraste con las configuraciones ds de lantano y actinio; sin embargo, esta configuración anómala no parece afectar su química calculada, que sigue siendo similar a la del actinio.Se prevé que su primera energía de ionización sea de 429,4 kJ/mol, que sería inferior a la de todos los elementos conocidos excepto los metales alcalinos potasio, rubidio, cesio y francio: este valor es incluso inferior al del metal alcalino del período 8 ununenio (463,1 kJ/mol). De manera similar, la próxima superactínida, unbibium (elemento 122), puede ser similar al cerio y al torio, con un estado de oxidación principal de +4, pero tendría una configuración electrónica de valencia de estado fundamental 7d 8s 8p u 8s 8p, a diferencia del torio 6d 7s configuración. Por lo tanto, su primera energía de ionización sería menor que la del torio (Th: 6,3 eV; elemento 122: 5,6 eV) debido a la mayor facilidad para ionizar el 8p 1/2 del unbibium.electrón que el electrón 6d del torio. El colapso del propio orbital 5g se retrasa hasta alrededor del elemento 125; Se espera que las configuraciones electrónicas de la serie isoelectrónica de 119 electrones sean [Og]8s para los elementos 119 a 122, [Og]6f para los elementos 123 y 124, y [Og]5g para el elemento 125 en adelante.
En los primeros superactínidos, se prevé que las energías de enlace de los electrones agregados sean lo suficientemente pequeñas como para que puedan perder todos sus electrones de valencia; por ejemplo, el unbihexio (elemento 126) podría formar fácilmente un estado de oxidación +8, y pueden ser posibles estados de oxidación aún más altos para los siguientes elementos. También se predice que el elemento 126 mostrará una variedad de otros estados de oxidación: cálculos recientes han sugerido que puede ser posible un monofluoruro 126F estable, como resultado de una interacción de enlace entre el orbital 5g en el elemento 126 y el orbital 2p en el flúor. Otros estados de oxidación predichos incluyen +2, +4 y +6; Se espera que +4 sea el estado de oxidación más habitual del unbihexio.Se predice que los superactínidos desde unbipentium (elemento 125) hasta unbiennium (elemento 129) exhiben un estado de oxidación +6 y forman hexafluoruros, aunque se predice que 125F 6 y 126F 6 se unen relativamente débilmente. Se espera que las energías de disociación de enlace aumenten considerablemente en el elemento 127 y aún más en el elemento 129. Esto sugiere un cambio de carácter iónico fuerte en los fluoruros del elemento 125 a un carácter más covalente, que involucra el orbital 8p, en los fluoruros del elemento 129. El enlace en estos hexafluoruros de superactinida se da principalmente entre la subcapa 8p más alta de la superactinida y la subcapa 2p del flúor, a diferencia de cómo el uranio usa sus orbitales 5f y 6d para unirse en el hexafluoruro de uranio.
A pesar de la capacidad de los primeros superactínidos para alcanzar altos estados de oxidación, se ha calculado que los electrones de 5 g serán los más difíciles de ionizar; Se espera que los iones 125 y 126 tengan una configuración 5g, similar a la configuración 5f del ion Np. Similar comportamiento se observa en la baja actividad química de los electrones 4f en los lantánidos; esto es consecuencia de que los orbitales 5g son pequeños y están profundamente enterrados en la nube de electrones. La presencia de electrones en los orbitales g, que no existen en la configuración electrónica del estado fundamental de ningún elemento actualmente conocido, debería permitir que se formen orbitales híbridos actualmente desconocidos e influyan en la química de los superactínidos de nuevas maneras, aunque la ausencia de gLos electrones en elementos conocidos dificultan la predicción de la química de los superactínidos.
| 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 132 | 142 | 143 | 144 | 145 | 146 | 148 | 153 | 154 | 155 | 156 | 157 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Compuesto | 121X 3 | 122X 4 | 123X 5 | 124X 6 | 125F125F 6125O2 | 126F126F 6126O 4 | 127F 6 | 128F 6 | 129F129F 6 | 142X 4142X 6 | 143F 6 | 144X 6144O2144F 8144O 4 | 145F 6 | 148O 6 | |||||||
| análogos | LaX 3AcX 3 | CeX 4ThX 4 | NPO2 | ThF 4 | UF6UO __2PuF 8PuO 4 | UNO 6 | |||||||||||||||
| Estados de oxidación | 3 | 4 | 5 | 6 | 1, 6, 7 | 1, 2, 4, 6, 8 | 6 | 6 | dieciséis | 6 | 4, 6 | 6, 8 | 3, 4, 5, 6, 8 | 6 | 8 | 12 | 3 | 0, 2 | 3, 5 | 2 | 3 |
En los superactínidos posteriores, los estados de oxidación deberían ser más bajos. Por el elemento 132, el estado de oxidación más estable predominante será solo +6; esto se reduce aún más a +3 y +4 por el elemento 144, y al final de la serie de superactínidos será solo +2 (y posiblemente incluso 0) porque el caparazón 6f, que se está llenando en ese punto, está muy adentro la nube de electrones y los electrones 8s y 8p 1/2 están ligados con demasiada fuerza para ser químicamente activos. El caparazón de 5g debe llenarse en el elemento 144 y el caparazón de 6f alrededor del elemento 154, y en esta región de los superactínidos el 8p 1/2los electrones están tan fuertemente ligados que ya no son químicamente activos, por lo que solo unos pocos electrones pueden participar en las reacciones químicas. Cálculos de Fricke et al. prediga que en el elemento 154, la capa 6f está llena y no hay d- u otras funciones de onda de electrones fuera de las capas químicamente inactivas 8s y 8p 1/2. Esto puede hacer que el elemento 154 sea bastante poco reactivo con las propiedades similares a las de los gases nobles. No obstante, los cálculos de Pyykkö esperan que en el elemento 155, la capa 6f todavía sea químicamente ionizable: 155 debería tener una capa 6f completa, y el cuarto potencial de ionización debería estar entre los del terbio y el disprosio, ambos conocidos en el estado +4..
De manera similar a las contracciones de lantánidos y actínidos, debe haber una contracción de superactínidos en la serie de superactínidos donde los radios iónicos de los superactínidos son más pequeños de lo esperado. En los lantánidos, la contracción es de unas 4,4 pm por elemento; en los actínidos, es de unas 3 pm por elemento. La contracción es mayor en los lantánidos que en los actínidos debido a la mayor localización de la función de onda 4f en comparación con la función de onda 5f. Las comparaciones con las funciones de onda de los electrones externos de los lantánidos, actínidos y superactínidos conducen a una predicción de una contracción de alrededor de 2 pm por elemento en los superactínidos; aunque esto es menor que las contracciones en los lantánidos y actínidos, su efecto total es mayor debido al hecho de que 32 electrones están llenos en las capas 5g y 6f profundamente enterradas,
Pekka Pyykkö divide estos superactínidos en tres series: una serie 5g (elementos 121 a 138), una serie 8p 1/2 (elementos 139 a 140) y una serie 6f (elementos 141 a 155), y también señala que habría un gran superposición entre los niveles de energía y que los orbitales 6f, 7d u 8p 1/2 también podrían estar ocupados en los primeros átomos o iones de superactínidos. También espera que se comporten más como "superlantánidos", en el sentido de que los electrones 5g serían en su mayoría químicamente inactivos, de manera similar a cómo solo uno o dos electrones 4f en cada lantánido se ionizan en compuestos químicos. También predijo que los posibles estados de oxidación de los superactínidos podrían aumentar mucho en la serie 6f, hasta valores como +12 en el elemento 148.
Andrey Kulsha ha llamado a los treinta y seis elementos 121 a 156 elementos de "ultransición" y ha propuesto dividirlos en dos series de dieciocho cada una, una de los elementos 121 a 138 y otra de los elementos 139 a 156. La primera sería análoga a la los lantánidos, con estados de oxidación que van principalmente de +4 a +6, ya que domina el relleno de la capa de 5 g y los elementos vecinos son muy similares entre sí, creando una analogía con el uranio, el neptunio y el plutonio. La segunda sería análoga a los actínidos: al principio (alrededor de los elementos en los 140s) se esperarían estados de oxidación muy altos a medida que la capa 6f sube por encima de la 7d, pero después de eso los estados de oxidación típicos bajarían y en elementos en el 150s en adelante el 8p 1/2los electrones dejarían de ser químicamente activos. Debido a que las dos filas están separadas por la adición de una subcapa completa de 5 g, también podrían considerarse análogas entre sí.
Como ejemplo de los superactínidos tardíos, se espera que el elemento 156 exhiba principalmente el estado de oxidación +2, debido a su configuración electrónica con electrones 7d fácilmente eliminados sobre un [Og]5g 6f 8s 8p estable1/2centro. Por lo tanto, puede considerarse un congénere más pesado del nobelio, que también tiene un par de electrones 7s fácilmente eliminados sobre un núcleo [Rn]5f estable, y generalmente se encuentra en el estado +2 (se requieren oxidantes fuertes para obtener nobelio en el +3 estado). Su primera energía de ionización debería ser de unos 400 kJ/mol y su radio metálico de unos 170 picómetros. Con una masa atómica relativa de alrededor de 445 u, debería ser un metal muy pesado con una densidad de alrededor de 26 g/cm.
Elementos 157 a 166
Se espera que los metales de transición 7d en el período 8 sean los elementos 157 a 166. Aunque los electrones 8s y 8p 1/2 están tan fuertemente ligados a estos elementos que no deberían poder participar en ninguna reacción química, los 9s y 9p Se espera que los niveles 1/2 estén fácilmente disponibles para la hibridación. Estos elementos 7d deberían ser similares a los elementos 4d del itrio al cadmio. En particular, el elemento 164 con una configuración electrónica 7d 9s muestra claras analogías con el paladio con su configuración electrónica 4d 5s.
No se espera que los metales nobles de esta serie de metales de transición sean tan nobles como sus homólogos más ligeros, debido a la ausencia de una capa exterior para protegerse y también porque la capa 7d está fuertemente dividida en dos subcapas debido a efectos relativistas. Esto hace que las primeras energías de ionización de los metales de transición 7d sean más pequeñas que las de sus congéneres más ligeros.
El interés teórico en la química del unhexquadio está motivado en gran medida por las predicciones teóricas de que, especialmente los isótopos 164 y 164 (con 164 protones y 308 o 318 neutrones), estarían en el centro de una hipotética segunda isla de estabilidad (la primera está centrada en copernicium, particularmente los isótopos Cn, Cn y Cn que se espera que tengan vidas medias de siglos o milenios).
Los cálculos predicen que los electrones 7d del elemento 164 (unhexquadio) deberían participar muy fácilmente en las reacciones químicas, por lo que debería poder mostrar estados de oxidación estables +6 y +4 además del estado normal +2 en soluciones acuosas con ligandos fuertes.. Por tanto, el elemento 164 debería poder formar compuestos como 164(CO) 4, 164(PF 3) 4 (tanto tetraédricos como los correspondientes compuestos de paladio) y 164(CN)2(lineal), que tiene un comportamiento muy diferente al del plomo, cuyo elemento 164 sería un homólogo más pesado si no fuera por los efectos relativistas. No obstante, el estado divalente sería el principal en solución acuosa (aunque los estados +4 y +6 serían posibles con ligandos más fuertes), y el unhexquadio(II) debería comportarse de manera más similar al plomo que el unhexquadium(IV) y el unhexquadium(VI).
Se espera que el elemento 164 sea un ácido de Lewis suave y tenga un parámetro de suavidad de Ahrlands cercano a 4 eV. Debe ser como máximo moderadamente reactivo, teniendo una primera energía de ionización que debe estar alrededor de 685 kJ/mol, comparable a la del molibdeno. Debido a las contracciones de lantánidos, actínidos y superactínidos, el elemento 164 debería tener un radio metálico de solo 158 pm, muy cercano al del magnesio mucho más liviano, a pesar de su peso atómico esperado de alrededor de 474 u, que es aproximadamente 19,5 veces el peso atómico. de magnesio Este pequeño radio y alto peso hacen que se espere que tenga una densidad extremadamente alta de alrededor de 46 g·cm, más del doble que el osmio, actualmente el elemento más denso conocido, con 22,61 g·cm.; el elemento 164 debería ser el segundo elemento más denso de los primeros 172 elementos de la tabla periódica, siendo sólo su vecino unhextrium (elemento 163) más denso (47 g·cm). El elemento metálico 164 debería tener una energía cohesiva muy grande (entalpía de cristalización) debido a sus enlaces covalentes, lo que muy probablemente resulta en un punto de fusión alto. En estado metálico, el elemento 164 debería ser bastante noble y análogo al paladio y al platino. Fricke et al. sugirieron algunas similitudes formales con el oganesón, ya que ambos elementos tienen configuraciones de capa cerrada y energías de ionización similares, aunque señalan que mientras que el oganesón sería un gas noble muy malo, el elemento 164 sería un buen metal noble.
Los elementos 165 (unhexpentium) y 166 (unhexhexium), los dos últimos metales 7d, deben comportarse de manera similar a los metales alcalinos y alcalinotérreos cuando se encuentran en los estados de oxidación +1 y +2 respectivamente. Los electrones 9s deberían tener energías de ionización comparables a las de los electrones 3s de sodio y magnesio, debido a los efectos relativistas que hacen que los electrones 9s estén mucho más fuertemente unidos de lo que predicen los cálculos no relativistas. Los elementos 165 y 166 normalmente deberían exhibir los estados de oxidación +1 y +2 respectivamente, aunque las energías de ionización de los electrones 7d son lo suficientemente bajas como para permitir estados de oxidación más altos como +3 para el elemento 165. El estado de oxidación +4 para el elemento 166 es menor probablemente, creando una situación similar a la de los elementos más ligeros en los grupos 11 y 12 (particularmente oro y mercurio).Al igual que con el mercurio, pero no con el copernicio, se espera que la ionización de los elementos 166 a 166 dé como resultado una configuración 7d correspondiente a la pérdida de los electrones s pero no de los electrones d, lo que lo hace más análogo al grupo 12 más ligero y "menos relativista". elementos zinc, cadmio y mercurio, que esencialmente no tienen carácter de metal de transición.
| Propiedad | 156 | 157 | 158 | 159 | 160 | 161 | 162 | 163 | 164 | 165 | 166 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| peso atómico estándar | [445] | [448] | [452] | [456] | [459] | [463] | [466] | [470] | [474] | [477] | [481] |
| Grupo | grupo Yb(4) | 3(5) | 4(6) | 5(7) | 6(8) | 7(9) | 8(10) | 9(11) | 10(12, 14, 18) | 11(1, 13) | 12(2, 14) |
| Configuración electrónica de valencia | 7d | 7d | 7d | 7d | 7d | 7d | 7d | 7d | 7d | 7d 9s | 7d 9s |
| Estados de oxidación estables | 2 | 3 | 4 | 1, 5 | 2, 6 | 3, 7 | 4, 8 | 5 | 0, 2, 4, 6 | 1, 3 | 2 |
| Primera energía de ionización | 400 kJ/mol | 450 kJ/mol | 520 kJ/mol | 340 kJ/mol | 420 kJ/mol | 470 kJ/mol | 560 kJ/mol | 620 kJ/mol | 690 kJ/mol | 520 kJ/mol | 630 kJ/mol |
| Radio metálico | 170 horas | 163 horas | 157 horas | 152 horas | 148 horas | 148 horas | 149 horas | 152 horas | 158 horas | 250 horas | 200 p. m. |
| Densidad | 26 g/cm2 | 28 g/cm2 | 30 g/cm2 | 33 g/cm2 | 36 g/cm2 | 40 g/cm2 | 45 g/cm2 | 47 g/cm2 | 46 g/cm2 | 7 g/cm2 | 11 g/cm2 |
Elementos 167 a 172
Se espera que los siguientes seis elementos de la tabla periódica sean los últimos elementos del grupo principal en su período, y es probable que sean similares a los elementos 5p desde el indio hasta el xenón. En los elementos 167 a 172, el 9p 1/2 y el 8p 3/2se llenarán las conchas. Sus valores propios de energía están tan juntos que se comportan como una subcapa p combinada, similar a las subcapas 2p y 3p no relativistas. Por lo tanto, el efecto de par inerte no ocurre y se espera que los estados de oxidación más comunes de los elementos 167 a 170 sean +3, +4, +5 y +6 respectivamente. Se espera que el elemento 171 (unseptunio) muestre algunas similitudes con los halógenos, mostrando varios estados de oxidación que van de -1 a +7, aunque se espera que sus propiedades físicas sean más cercanas a las de un metal. Se espera que su afinidad electrónica sea de 3,0 eV, lo que le permite formar H171, análogo a un haluro de hidrógeno. Se espera que el ion 171 sea una base blanda, comparable al yoduro (I). Se espera que el elemento 172 (unseptbium) sea un gas noble con un comportamiento químico similar al del xenón, ya que sus energías de ionización deberían ser muy similares (Xe, 1170,4 kJ/mol; elemento 172, 1090 kJ/mol). La única diferencia principal entre ellos es que se espera que el elemento 172, a diferencia del xenón, sea un líquido o un sólido a temperatura y presión estándar debido a su peso atómico mucho más alto. Se espera que el unseptbio sea un ácido de Lewis fuerte, que forme fluoruros y óxidos, de forma similar a su congénere más ligero, el xenón.Debido a la analogía de los elementos 165–172 con los períodos 2 y 3, Fricke et al. los consideró para formar un noveno período de la tabla periódica, mientras que ellos consideraron que el octavo período terminaba en el elemento de metal noble 164. Este noveno período sería similar al segundo y tercer período en que se espera que no tenga transición. rieles.
| Propiedad | 167 | 168 | 169 | 170 | 171 | 172 |
|---|---|---|---|---|---|---|
| peso atómico estándar | [485] | [489] | [493] | [496] | [500] | [504] |
| Grupo | 13 | 14 | 15 | dieciséis | 17 | 18 |
| Configuración electrónica de valencia | 9s 9p | 9s 9p | 9s 9p 8p | 9s 9p 8p | 9s 9p 8p | 9s 9p 8p |
| Estados de oxidación estables | 3 | 4 | 5 | 6 | −1, 3, 7 | 0, 4, 6, 8 |
| Primera energía de ionización | 620 kJ/mol | 720 kJ/mol | 800 kJ/mol | 890 kJ/mol | 984 kJ/mol | 1090 kJ/mol |
| Radio metálico o covalente | 190 horas | 180 horas | 175 horas | 170 horas | 165 horas | 220 horas |
| Densidad | 17 g/cm2 | 19 g/cm2 | 18 g/cm2 | 17 g/cm2 | 16 g/cm2 | 9 g/cm2 |
Más allá del elemento 172
Más allá del elemento 172, debería comenzar otra larga serie de transición como los superactínidos, llenando al menos las capas 6g, 7f y 8d (con 10s, 10p 1/2 y 6h 11/2 demasiado altas en energía para contribuir al principio de la serie). Estos electrones estarían unidos muy débilmente, lo que podría hacer que se alcancen estados de oxidación extremadamente altos, aunque los electrones se unirían más estrechamente a medida que aumenta la carga iónica.
En el elemento 173 (unseptrium), el electrón más externo entraría en la subcapa 6g 7/2. Debido a que las interacciones espín-órbita crearían una brecha de energía muy grande entre las subcapas 8p 3/2 y 6g 7/2, se espera que este electrón más externo se una muy débilmente y se pierda muy fácilmente para formar un catión 173. Como resultado, se espera que el elemento 173 se comporte químicamente como un metal alcalino, y mucho más reactivo que incluso el cesio (el francio y el elemento 119 son menos reactivos que el cesio debido a efectos relativistas).
El elemento 184 (unoctquadium) fue un objetivo significativo en las primeras predicciones, ya que originalmente se especuló que 184 sería un número mágico de protones: se prevé que tenga una configuración electrónica de [172] 6g 7f 8d, con al menos los electrones 7f y 8d químicamente activo. Se espera que su comportamiento químico sea similar al del uranio y el neptunio, ya que es probable que una mayor ionización más allá del estado +6 (que corresponde a la eliminación de los electrones 6g) no sea rentable; el estado +4 debería ser más común en solución acuosa, con +5 y +6 alcanzables en compuestos sólidos.
Fin de la tabla periódica
Se desconoce el número de elementos físicamente posibles. Una estimación baja es que la tabla periódica puede terminar poco después de la isla de estabilidad, que se espera que se centre en Z = 126, ya que la extensión de las tablas periódica y de nucleidos está restringida por las líneas de goteo de protones y neutrones y la estabilidad hacia alfa. descomposición y fisión espontánea. Un cálculo de Y. Gambhir et al. , analizando la energía de enlace nuclear y la estabilidad en varios canales de desintegración, sugiere un límite para la existencia de núcleos unidos en Z = 146. Algunos, como Walter Greiner, predijeron que puede que no haya un final para la tabla periódica. Otras predicciones de un final para la tabla periódica incluyen Z = 128 (John Emsley) y Z = 155 (Albert Khazan).
Elementos por encima del número atómico 137
Es una "leyenda popular" entre los físicos que Richard Feynman sugirió que los átomos neutros no podrían existir para números atómicos mayores que Z = 137, sobre la base de que la ecuación relativista de Dirac predice que la energía del estado fundamental del electrón más interno en tal átomo sería un número imaginario. Aquí, el número 137 surge como el inverso de la constante de estructura fina. Según este argumento, los átomos neutros no pueden existir más allá del número atómico 137 y, por lo tanto, una tabla periódica de elementos basada en orbitales electrónicos se descompone en este punto. Sin embargo, este argumento supone que el núcleo atómico es puntual. Un cálculo más preciso debe tener en cuenta el tamaño pequeño, pero distinto de cero, del núcleo, que se prevé que empujará el límite aún más a Z ≈ 173.
Modelo bohr
El modelo de Bohr presenta dificultad para átomos con número atómico mayor que 137, ya que la velocidad de un electrón en un orbital electrónico 1s, v, está dada por
donde Z es el número atómico y α es la constante de estructura fina, una medida de la fuerza de las interacciones electromagnéticas. Bajo esta aproximación, cualquier elemento con un número atómico mayor que 137 requeriría electrones 1s para viajar más rápido que c, la velocidad de la luz. Por lo tanto, el modelo de Bohr no relativista es inexacto cuando se aplica a dicho elemento.
Ecuación relativista de Dirac
La ecuación relativista de Dirac da la energía del estado fundamental como
donde m es la masa en reposo del electrón. Para Z > 137, la función de onda del estado fundamental de Dirac es oscilatoria, en lugar de limitada, y no hay brecha entre los espectros de energía positiva y negativa, como en la paradoja de Klein. Cálculos más precisos que toman en cuenta los efectos del tamaño finito del núcleo indican que la energía de enlace primero excede 2 mc para Z > Z cr ≈ 173. Para Z > Z cr, si el orbital más interno (1s) no está lleno, el El campo eléctrico del núcleo sacará un electrón del vacío, lo que resultará en la emisión espontánea de un positrón.Esta inmersión de la subcapa 1s en el continuo negativo a menudo se ha considerado como un "final" de la tabla periódica, aunque tratamientos más detallados sugieren un resultado menos sombrío.
Los átomos con números atómicos superiores a Z cr ≈ 173 se han denominado átomos supercríticos. Los átomos supercríticos no pueden ionizarse totalmente porque su subcapa 1s se llenaría mediante la creación espontánea de un par en el que se crea un par electrón-positrón a partir del continuo negativo, con el electrón unido y el positrón escapando. Sin embargo, el fuerte campo alrededor del núcleo atómico está restringido a una región muy pequeña del espacio, por lo que el principio de exclusión de Pauli prohíbe la creación espontánea de pares una vez que se llenan las subcapas que se han sumergido en el continuo negativo. Los elementos 173-184 se han denominado átomos débilmente supercríticos, ya que para ellos solo la capa 1s se ha sumergido en el continuo negativo; el 2p 1/2Se espera que la capa se una alrededor del elemento 185 y la capa 2s alrededor del elemento 245. Hasta ahora, los experimentos no han logrado detectar la creación espontánea de pares a partir del ensamblaje de cargas supercríticas a través de la colisión de núcleos pesados (por ejemplo, la colisión de plomo con uranio para dar momentáneamente una Z efectiva de 174; el uranio con uranio da Z efectivo = 184 y el uranio con californio da Z efectivo = 190).
Incluso si pasar Z cr no es un problema, la concentración creciente de la densidad 1s cerca del núcleo probablemente haría que estos electrones fueran más vulnerables a la captura de electrones K a medida que se acerca a Z cr. Para elementos tan pesados, estos electrones 1s probablemente pasarían una fracción significativa de tiempo tan cerca del núcleo que en realidad están dentro de él. Esto puede plantear otro límite a la tabla periódica.
Materia de quarks
También se ha postulado que en la región más allá de A > 300, puede existir un "continente de estabilidad" completo que consiste en una fase hipotética de materia estable de quarks, que comprende quarks que fluyen libremente hacia arriba y hacia abajo en lugar de quarks unidos a protones y neutrones. Se teoriza que tal forma de materia es un estado fundamental de materia bariónica con una mayor energía de enlace por barión que la materia nuclear, lo que favorece la descomposición de la materia nuclear más allá de este umbral de masa en materia de quarks. Si este estado de la materia existe, posiblemente podría sintetizarse en las mismas reacciones de fusión que conducen a núcleos superpesados normales, y se estabilizaría contra la fisión como consecuencia de su unión más fuerte que es suficiente para superar la repulsión de Coulomb.
Cálculos recientes sugieren la estabilidad de las pepitas de materia de quarks up-down (udQM) frente a los núcleos convencionales más allá de A ~ 266, y también muestran que las pepitas de udQM se vuelven supercríticas antes (Z cr ~ 163, A ~ 609) que los núcleos convencionales (Z cr ~ 177, A ~ 480).
Propiedades nucleares
Números mágicos y la isla de la estabilidad
La estabilidad de los núcleos disminuye considerablemente con el aumento del número atómico después del curio, elemento 96, de modo que todos los isótopos con un número atómico superior a 101 se desintegran radiactivamente con una vida media inferior a un día, a excepción del dubnio-268. Ningún elemento con número atómico superior a 82 (después del plomo) tiene isótopos estables. Sin embargo, por razones que aún no se conocen muy bien, hay un ligero aumento de la estabilidad nuclear alrededor de los números atómicos 110-114, lo que lleva a la aparición de lo que se conoce en física nuclear como la "isla de estabilidad". Este concepto, propuesto por el profesor de la Universidad de California Glenn Seaborg, explica por qué los elementos superpesados duran más de lo previsto.
Los cálculos según el método Hartree-Fock-Bogoliubov utilizando la interacción Skyrme no relativista han propuesto Z = 126 como una capa de protones cerrada. En esta región de la tabla periódica, N = 184, N = 196 y N = 228 se han sugerido como capas de neutrones cerradas. Por lo tanto, los isótopos de mayor interés son 126, 126 y 126, ya que estos pueden tener una vida mucho más larga que otros isótopos. Se predice que el elemento 126, que tiene un número mágico de protones, es más estable que otros elementos en esta región y puede tener isómeros nucleares con vidas medias muy largas. También es posible que la isla de estabilidad esté centrada en 122, que puede ser esférica y doblemente mágica.
Teniendo en cuenta la deformación nuclear y los efectos relativistas, un análisis de los niveles de partículas individuales predice nuevos números mágicos para núcleos superpesados en Z = 126, 138, 154 y 164 y N = 228, 308 y 318. Por lo tanto, además de los isla de estabilidad centrada en Cn, Cn y Fl, pueden existir más islas de estabilidad alrededor del doblemente mágico 126, así como 164 o 164. Se prevé que estos núcleos sean beta-estables y se descompongan por emisión alfa o fisión espontánea con relativamente largo vidas medias y confieren estabilidad adicional a los isótonos vecinos N = 228 y los elementos 152–168, respectivamente.Por otro lado, el mismo análisis sugiere que los cierres de capas de protones pueden ser relativamente débiles o incluso inexistentes en algunos casos, como el 126, lo que significa que tales núcleos podrían no ser doblemente mágicos y la estabilidad estará determinada principalmente por fuertes cierres de capas de neutrones. Además, debido a las fuerzas de repulsión electromagnética enormemente mayores que deben ser superadas por la fuerza fuerte en la segunda isla (Z = 164), es posible que los núcleos alrededor de esta región solo existan como resonancias y no puedan permanecer juntos durante una cantidad significativa de tiempo. tiempo. También es posible que algunos de los superactínidos entre estas series en realidad no existan porque están demasiado lejos de ambas islas, en cuyo caso la tabla periódica podría terminar alrededor de Z = 130.
Más allá del elemento 164, la línea de fisibilidad que define el límite de estabilidad con respecto a la fisión espontánea puede converger con la línea de goteo de neutrones, poniendo un límite a la existencia de elementos más pesados. Sin embargo, se han predicho más números mágicos en Z = 210, 274 y 354 y N = 308, 406, 524, 644 y 772, con dos núcleos doblemente mágicos beta estables encontrados en 210 y 274; el mismo método de cálculo reprodujo las predicciones para Fl y 164. (Los núcleos doblemente mágicos predichos para Z = 354 son beta-inestables, siendo 354 deficiente en neutrones y 354 rico en neutrones). Aunque la estabilidad adicional hacia la desintegración alfa y la fisión son predicho para210 y 274, con vidas medias de hasta cientos de microsegundos para 210, no existirán islas de estabilidad tan significativas como las predichas en Z = 114 y 164. Como la existencia de elementos superpesados depende en gran medida de los efectos estabilizadores de estructuras cerradas. Los proyectiles, la inestabilidad nuclear y la fisión probablemente determinarán el final de la tabla periódica más allá de estas islas de estabilidad.
La Unión Internacional de Química Pura y Aplicada (IUPAC) define que un elemento existe si su vida útil es superior a 10 segundos, que es el tiempo que tarda el núcleo en formar una nube de electrones. Sin embargo, generalmente se considera que existe un nucleido si su tiempo de vida es superior a unos 10 segundos, que es el tiempo que tarda en formarse la estructura nuclear. En consecuencia, es posible que algunos valores de Z solo se puedan realizar en nucleidos y que los elementos correspondientes no existan.
También es posible que no existan más islas más allá de 126, ya que la estructura de la capa nuclear se borra (ya que se espera que la estructura de la capa de electrones esté alrededor de oganesson) y los modos de decaimiento de baja energía se vuelven fácilmente disponibles.
Propiedades de descomposición previstas de elementos no descubiertos
Como se cree que la principal isla de estabilidad se encuentra alrededor de Cn y Cn, los elementos no descubiertos más allá de oganesson pueden ser muy inestables y sufrir una descomposición alfa o una fisión espontánea en microsegundos o menos. Se desconoce la región exacta en la que las vidas medias exceden un microsegundo, aunque varios modelos sugieren que los isótopos de elementos más pesados que el unbinilium que se pueden producir en las reacciones de fusión con objetivos y proyectiles disponibles tendrán vidas medias por debajo de un microsegundo y, por lo tanto, es posible que no se utilicen. detectado. Se predice consistentemente que existirán regiones de estabilidad en N = 184 y N = 228, y posiblemente también en Z ~ 124 y N~ 198. Estos núcleos pueden tener vidas medias de unos pocos segundos y sufrir predominantemente decaimiento alfa y fisión espontánea, aunque también pueden existir ramas menores de decaimiento beta-plus (o captura de electrones). Fuera de estas regiones de estabilidad mejorada, se espera que las barreras de fisión disminuyan significativamente debido a la pérdida de los efectos de estabilización, lo que resulta en vidas medias de fisión inferiores a 10 segundos, especialmente en núcleos pares para los cuales el obstáculo es aún menor debido al emparejamiento de nucleones. En general, se espera que la vida media de desintegración alfa aumente con el número de neutrones, desde nanosegundos en los isótopos más deficientes en neutrones hasta segundos más cerca de la línea de estabilidad beta.Para los núcleos con solo unos pocos neutrones más que un número mágico, la energía de enlace cae sustancialmente, lo que da como resultado una ruptura en la tendencia y vidas medias más cortas. Los isótopos más deficientes en neutrones de estos elementos también pueden estar libres y emitir protones. También se ha propuesto la descomposición de cúmulos (emisión de partículas pesadas) como un modo de descomposición alternativo para algunos isótopos, lo que plantea otro obstáculo para la identificación de estos elementos.
Configuraciones electrónicas
Las siguientes son las configuraciones electrónicas esperadas de los elementos 119–173 y 184. El símbolo [Og] indica la configuración electrónica probable de oganesson (Z = 118), que actualmente es el último elemento conocido. Las configuraciones de los elementos en esta tabla se escriben comenzando con [Og] porque se espera que oganesson sea el último elemento anterior con una configuración de capa cerrada (gas inerte), 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 6s 6p 6d 7s 7p. De manera similar, el [172] en las configuraciones de los elementos 173 y 184 denota la probable configuración de armazón cerrado del elemento 172.
Más allá del elemento 123, no hay cálculos completos disponibles y, por lo tanto, los datos de esta tabla deben tomarse como tentativos. En el caso del elemento 123, y quizás también de elementos más pesados, se prevé que varias configuraciones electrónicas posibles tengan niveles de energía muy similares, por lo que es muy difícil predecir el estado fundamental. Se incluyen todas las configuraciones que se han propuesto (ya que se entendió que la regla de Madelung probablemente deje de funcionar aquí).
Las asignaciones de bloques predichas hasta 172 son de Kulsha, siguiendo los orbitales de valencia disponibles esperados. Sin embargo, no existe un consenso en la literatura sobre cómo deberían funcionar los bloques después del elemento 138.
Contenido relacionado
Acidez
Alcohol rectificado
Katal

