Solubilidad
En química, la solubilidad es la capacidad de una sustancia, el soluto, para formar una solución con otra sustancia, el solvente. La insolubilidad es la propiedad opuesta, la incapacidad del soluto para formar tal solución.
El grado de solubilidad de una sustancia en un solvente específico generalmente se mide como la concentración del soluto en una solución saturada, en la que no se puede disolver más soluto. En este punto, se dice que las dos sustancias están en el equilibrio de solubilidad. Para algunos solutos y solventes puede no haber tal límite, en cuyo caso se dice que las dos sustancias son "miscibles en todas las proporciones" (o simplemente "miscibles").
El soluto puede ser un sólido, un líquido o un gas, mientras que el solvente suele ser sólido o líquido. Ambos pueden ser sustancias puras o pueden ser ellos mismos soluciones. Los gases son siempre miscibles en todas las proporciones, excepto en situaciones muy extremas, y un sólido o un líquido pueden "disolverse" en un gas solo pasando primero al estado gaseoso.
La solubilidad depende principalmente de la composición del soluto y del disolvente (incluido su pH y la presencia de otras sustancias disueltas), así como de la temperatura y la presión. La dependencia a menudo se puede explicar en términos de interacciones entre las partículas (átomos, moléculas o iones) de las dos sustancias y de conceptos termodinámicos como entalpía y entropía.
Bajo ciertas condiciones, la concentración del soluto puede exceder su límite de solubilidad habitual. El resultado es una solución sobresaturada, que es metaestable y excluirá rápidamente el exceso de soluto si aparece un sitio de nucleación adecuado.
El concepto de solubilidad no se aplica cuando existe una reacción química irreversible entre las dos sustancias, como la reacción del hidróxido de calcio con el ácido clorhídrico; aunque uno podría decir, informalmente, que uno "disolvió" al otro. La solubilidad tampoco es lo mismo que la velocidad de solución, que es la rapidez con la que un soluto sólido se disuelve en un solvente líquido. Esta propiedad depende de muchas otras variables, como la forma física de las dos sustancias y la forma e intensidad de la mezcla.
El concepto y la medida de la solubilidad son extremadamente importantes en muchas ciencias además de la química, como la geología, la biología, la física y la oceanografía, así como en la ingeniería, la medicina, la agricultura e incluso en actividades no técnicas como pintar, limpiar, cocinar, y elaboración de cerveza. La mayoría de las reacciones químicas de interés científico, industrial o práctico solo ocurren después de que los reactivos se hayan disuelto en un solvente adecuado. El agua es, con mucho, el disolvente más común.
El término "soluble" se utiliza a veces para materiales que pueden formar suspensiones coloidales de partículas sólidas muy finas en un líquido. Sin embargo, la solubilidad cuantitativa de tales sustancias generalmente no está bien definida.
Cuantificación de la solubilidad
La solubilidad de un soluto específico en un solvente específico generalmente se expresa como la concentración de una solución saturada de los dos. Se puede utilizar cualquiera de las diversas formas de expresar la concentración de soluciones, como la masa, el volumen o la cantidad en moles del soluto para una masa, volumen o cantidad molar específica del disolvente o de la solución.
Por cantidad de disolvente
En particular, los manuales de química suelen expresar la solubilidad de una sustancia en un líquido en gramos de soluto por decilitro (100 mL) de solvente (g/dL); o, menos comúnmente, como gramos por litro (g/L). En cambio, la cantidad de solvente puede expresarse en masa, como en g/100 g" o g/kg. El número puede expresarse como un porcentaje en este caso, y la abreviatura "p/p" puede usarse para indicar "peso por peso”. (Los valores en g/L y g/kg son prácticamente los mismos para el agua, pero no para otros disolventes.)
Alternativamente, la cantidad de soluto se puede expresar en moles en lugar de en masa; si la cantidad de disolvente se da en kilogramos, el valor es la molalidad de la solución (mol/kg).
Por cantidad de solución
La solubilidad de una sustancia en un líquido también se puede expresar como la cantidad de soluto por cantidad de solución, en lugar de disolvente. Por ejemplo, siguiendo la práctica común en titulación, se puede expresar como moles de soluto por litro de solución (mol/L), la molaridad de esta última.
En contextos más especializados la solubilidad puede estar dada por la fracción molar (moles de soluto por moles totales de soluto más solvente) o por la fracción másica en equilibrio (masa de soluto por masa de soluto más solvente), ambos números adimensionales entre 0 y 1 que puede expresarse en porcentajes.
Solutos líquidos y gaseosos
Para soluciones de líquidos o gases en líquidos, las cantidades de ambas sustancias se pueden dar en volumen en lugar de en masa o cantidad molar; como litro de soluto por litro de solvente, o litro de soluto por litro de solución. El valor se puede dar como un porcentaje, y se puede usar la abreviatura "v/v" para "volumen por volumen" para indicar esta elección.
Conversión de valores de solubilidad
La conversión entre estas diversas formas de medir la solubilidad puede no ser trivial, ya que puede requerir conocer la densidad de la solución, que a menudo no se mide y no se puede predecir. Si bien la masa total se conserva por disolución, el volumen final puede ser diferente tanto del volumen del solvente como de la suma de los dos volúmenes.
Además, muchos sólidos (como ácidos y sales) se disociarán de formas no triviales cuando se disuelvan; por el contrario, el solvente puede formar complejos de coordinación con las moléculas o iones del soluto. En esos casos, la suma de los moles de moléculas de soluto y solvente no es realmente el total de moles de solución de partículas independientes. Para eludir ese problema, la solubilidad por mol de solución generalmente se calcula y cotiza como si el soluto no se disociara ni formara complejos, es decir, pretendiendo que la cantidad molar de solución es la suma de las cantidades molares de las dos sustancias..
Calificadores utilizados para describir el grado de solubilidad
El grado de solubilidad varía ampliamente, desde infinitamente soluble (sin límite, es decir, miscible) como el etanol en agua, hasta esencialmente insoluble, como el dióxido de titanio en agua. También se utilizan otros términos descriptivos para calificar el grado de solubilidad para una aplicación determinada. Por ejemplo, la Farmacopea de EE. UU. da los siguientes términos, de acuerdo con la masa m sv de solvente requerida para disolver una unidad de masa m su de soluto: (Las solubilidades de los ejemplos son aproximadas, para agua a 20-25 °C).
| Término | distancia | Ejemplo | g/dL | m sv / m su |
|---|---|---|---|---|
| muy soluble | <1 | nitrato de calcio | 158.7 | 0,63 |
| Totalmente soluble | 1 a 10 | cloruro de calcio | sesenta y cinco | 1.54 |
| Soluble | 10 a 30 | oxalato de sodio | 3.9 | 26 |
| Escasamente soluble | 30 a 100 | |||
| Ligeramente soluble | 100 a 1000 | sulfato de calcio | 0.21 | 490 |
| Muy poco soluble | 1000 a 10,000 | fosfato dicálcico | 0.02 | 5000 |
| Prácticamente insoluble o insoluble | ≥ 10.000 | sulfato de bario | 0.000245 | 409000 |
Los umbrales para describir algo como insoluble, o términos similares, pueden depender de la aplicación. Por ejemplo, una fuente afirma que las sustancias se describen como "insolubles" cuando su solubilidad es inferior a 0,1 g por 100 ml de disolvente.
Vista molecular
La solubilidad se produce en equilibrio dinámico, lo que significa que la solubilidad resulta de los procesos simultáneos y opuestos de disolución y unión de fases (p. ej., precipitación de sólidos). El equilibrio de solubilidad ocurre cuando los dos procesos proceden a velocidades iguales y opuestas.
El término solubilidad también se usa en algunos campos donde el soluto se altera por solvólisis. Por ejemplo, se dice que muchos metales y sus óxidos son "solubles en ácido clorhídrico", aunque de hecho el ácido acuoso degrada irreversiblemente el sólido para dar productos solubles. También es cierto que la mayoría de los sólidos iónicos se disuelven en disolventes polares, pero estos procesos son reversibles. En aquellos casos en los que el soluto no se recupera tras la evaporación del disolvente, el proceso se denomina solvólisis. El concepto termodinámico de solubilidad no se aplica directamente a la solvólisis.
Cuando un soluto se disuelve, puede formar varias especies en la solución. Por ejemplo, una suspensión acuosa de hidróxido ferroso, Fe(OH)
2, contendrá la serie [Fe(H 2 O) x (OH) x ] así como otras especies. Además, la solubilidad del hidróxido ferroso y la composición de sus componentes solubles dependen del pH. En general, la solubilidad en la fase solvente se puede dar solo para un soluto específico que sea termodinámicamente estable, y el valor de la solubilidad incluirá todas las especies en la solución (en el ejemplo anterior, todos los complejos que contienen hierro).
Factores que afectan la solubilidad
La solubilidad se define para fases específicas. Por ejemplo, se espera que la solubilidad en agua del aragonito y la calcita difiera, aunque ambos sean polimorfos del carbonato de calcio y tengan la misma fórmula química.
La solubilidad de una sustancia en otra está determinada por el equilibrio de fuerzas intermoleculares entre el solvente y el soluto, y el cambio de entropía que acompaña a la solvatación. Factores como la temperatura y la presión alterarán este equilibrio, cambiando así la solubilidad.
La solubilidad también puede depender en gran medida de la presencia de otras especies disueltas en el disolvente, por ejemplo, aniones formadores de complejos (ligandos) en líquidos. La solubilidad también dependerá del exceso o deficiencia de un ion común en la solución, fenómeno conocido como efecto de ion común. En menor medida, la solubilidad dependerá de la fuerza iónica de las soluciones. Los dos últimos efectos se pueden cuantificar utilizando la ecuación de equilibrio de solubilidad.
Para un sólido que se disuelve en una reacción redox, se espera que la solubilidad dependa del potencial (dentro del rango de potenciales bajo los cuales el sólido sigue siendo la fase termodinámicamente estable). Por ejemplo, se observa que la solubilidad del oro en agua a alta temperatura es casi un orden de magnitud mayor (es decir, unas diez veces mayor) cuando el potencial redox se controla utilizando un tampón redox Fe 3 O 4 -Fe 2 O 3 altamente oxidante que con un tampón Ni-NiO moderadamente oxidante.
La solubilidad (metaestable, en concentraciones cercanas a la saturación) también depende del tamaño físico del cristal o gota de soluto (o, estrictamente hablando, del área de superficie específica o área de superficie molar del soluto). Para la cuantificación, consulte la ecuación en el artículo sobre el equilibrio de solubilidad. Para cristales muy defectuosos, la solubilidad puede aumentar con el grado creciente de desorden. Ambos efectos ocurren debido a la dependencia de la constante de solubilidad de la energía de Gibbs del cristal. Los dos últimos efectos, aunque a menudo difíciles de medir, son de importancia práctica. Por ejemplo, proporcionan la fuerza impulsora para el envejecimiento del precipitado (el tamaño del cristal aumenta espontáneamente con el tiempo).
Temperatura
La solubilidad de un soluto dado en un solvente dado es función de la temperatura. Dependiendo del cambio de entalpía (Δ H) de la reacción de disolución, es decir, del carácter endotérmico (Δ H > 0) o exotérmico (Δ H < 0) de la reacción de disolución, la solubilidad de un compuesto dado puede aumentar o disminuir. con temperatura La ecuación de van 't Hoff relaciona el cambio de la constante de equilibrio de solubilidad (Ksp ) con el cambio de temperatura y el cambio de entalpía de reacción. Para la mayoría de los sólidos y líquidos, su solubilidad aumenta con la temperatura porque su reacción de disolución es endotérmica (Δ H > 0). En agua líquida a altas temperaturas (por ejemplo, la que se aproxima a la temperatura crítica), la solubilidad de los solutos iónicos tiende a disminuir debido al cambio de propiedades y estructura del agua líquida; la constante dieléctrica más baja da como resultado un solvente menos polar y un cambio en la energía de hidratación que afecta el Δ G de la reacción de disolución.
Los solutos gaseosos exhiben un comportamiento más complejo con la temperatura. A medida que aumenta la temperatura, los gases suelen volverse menos solubles en agua (reacción de disolución exotérmica relacionada con su hidratación) (hasta un mínimo, que es inferior a 120 °C para la mayoría de los gases permanentes), pero más solubles en disolventes orgánicos (reacción de disolución endotérmica relacionada con a su disolución).
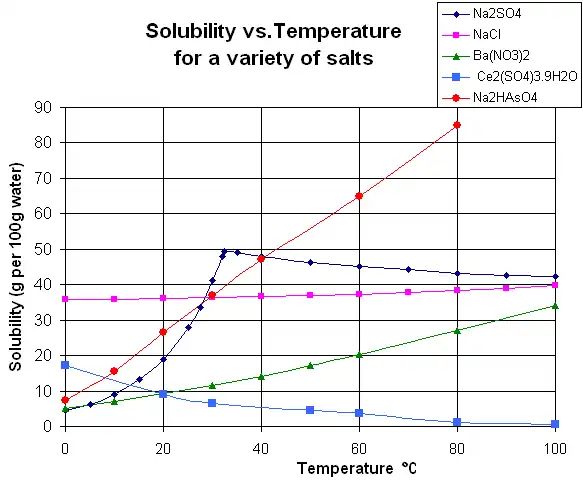
El gráfico muestra las curvas de solubilidad de algunas sales inorgánicas sólidas típicas en agua líquida (la temperatura está en grados Celsius, es decir, Kelvin menos 273,15). Muchas sales se comportan como el nitrato de bario y el arseniato de hidrógeno disódico, y muestran un gran aumento de solubilidad con la temperatura (Δ H > 0). Algunos solutos (p. ej., cloruro de sodio en agua) exhiben una solubilidad bastante independiente de la temperatura (Δ H ≈ 0). Algunos, como el sulfato de calcio (yeso) y el sulfato de cerio (III), se vuelven menos solubles en agua a medida que aumenta la temperatura (Δ H < 0). Este es también el caso del hidróxido de calcio (portlandita), cuya solubilidad a 70 °C es aproximadamente la mitad de su valor a 25 °C. La disolución de hidróxido de calcio en agua también es un proceso exotérmico (ΔH < 0) y obedece a la ecuación de van 't Hoff y al principio de Le Chatelier. Una disminución de la temperatura favorece la eliminación del calor de disolución del sistema y, por lo tanto, favorece la disolución de Ca(OH) 2: por lo tanto, la solubilidad de la portlandita aumenta a baja temperatura. Esta dependencia de la temperatura a veces se denomina solubilidad "retrógrada" o "inversa". Ocasionalmente, se observa un patrón más complejo, como con el sulfato de sodio, donde el cristal decahidratado menos soluble (mirabilita) pierde agua de cristalización a 32 °C para formar una fase anhidra más soluble (tenardita) con un cambio menor en la energía libre de Gibbs (Δ G) en la reacción de disolución.
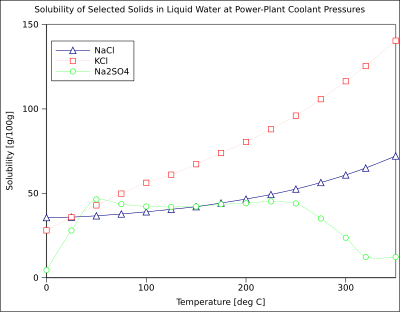
La solubilidad de los compuestos orgánicos casi siempre aumenta con la temperatura. La técnica de recristalización, utilizada para la purificación de sólidos, depende de las diferentes solubilidades de un soluto en solvente caliente y frío. Existen algunas excepciones, como ciertas ciclodextrinas.
Presión
Para las fases condensadas (sólidos y líquidos), la dependencia de la presión de la solubilidad es típicamente débil y generalmente se descuida en la práctica. Suponiendo una solución ideal, la dependencia se puede cuantificar como:
donde el indice 









La dependencia de la presión de la solubilidad ocasionalmente tiene un significado práctico. Por ejemplo, el ensuciamiento por precipitación de campos y pozos de petróleo por sulfato de calcio (que disminuye su solubilidad al disminuir la presión) puede resultar en una disminución de la productividad con el tiempo.
Solubilidad de los gases
La ley de Henry se utiliza para cuantificar la solubilidad de los gases en disolventes. La solubilidad de un gas en un solvente es directamente proporcional a la presión parcial de ese gas sobre el solvente. Esta relación es similar a la ley de Raoult y se puede escribir como:
donde 


La solubilidad de los gases a veces también se cuantifica utilizando el coeficiente de solubilidad de Bunsen.
En presencia de pequeñas burbujas, la solubilidad del gas no depende del radio de la burbuja más que por el efecto del radio sobre la presión (es decir, la solubilidad del gas en el líquido en contacto con las pequeñas burbujas aumenta debido a aumento de la presión en Δ p = 2γ/ r; véase la ecuación de Young-Laplace).
La ley de Henry es válida para gases que no sufren cambios de especiación química al disolverse. La ley de Sieverts muestra un caso en el que esta suposición no se cumple.
La solubilidad del dióxido de carbono en el agua de mar también se ve afectada por la temperatura, el pH de la solución y el tampón de carbonato. La disminución de la solubilidad del dióxido de carbono en el agua de mar cuando aumenta la temperatura también es un factor de retroacción importante (retroalimentación positiva) que exacerba los cambios climáticos pasados y futuros, como se observa en los núcleos de hielo del sitio Vostok en la Antártida. En la escala de tiempo geológico, debido a los ciclos de Milankovich, cuando los parámetros astronómicos de la órbita terrestre y su eje de rotación cambian progresivamente y modifican la radiación solar en la superficie terrestre, la temperatura comienza a aumentar. Cuando se inicia un período de desglaciación, el calentamiento progresivo de los océanos libera CO 2 a la atmósfera debido a su menor solubilidad en aguas de mar más cálidas. A su vez, los niveles más altos de CO2 en la atmósfera aumentan el efecto invernadero y el dióxido de carbono actúa como amplificador del calentamiento general.
Polaridad
Un aforismo popular utilizado para predecir la solubilidad es " como se disuelve como " también expresado en latín como " similia similibus solventur ". Esta afirmación indica que un soluto se disolverá mejor en un solvente que tenga una estructura química similar a la suya, según la entropía favorable de la mezcla. Esta vista es simplista, pero es una regla general útil. La capacidad total de solvatación de un solvente depende principalmente de su polaridad.Por ejemplo, un soluto muy polar (hidrofílico) como la urea es muy soluble en agua altamente polar, menos soluble en metanol bastante polar y prácticamente insoluble en solventes no polares como el benceno. Por el contrario, un soluto no polar o lipofílico como el naftaleno es insoluble en agua, bastante soluble en metanol y muy soluble en benceno no polar.
En términos aún más simples, un compuesto iónico simple (con iones positivos y negativos) como el cloruro de sodio (sal común) es fácilmente soluble en un solvente altamente polar (con alguna separación de cargas positivas (δ+) y negativas (δ-) en la molécula covalente) como el agua, por lo que el mar es salado ya que acumula sales disueltas desde edades geológicas tempranas.
La solubilidad se ve favorecida por la entropía de mezcla (Δ S) y depende de la entalpía de disolución (Δ H) y del efecto hidrofóbico. La energía libre de disolución (energía de Gibbs) depende de la temperatura y viene dada por la relación: Δ G = Δ H – TΔ S. Menor Δ G significa mayor solubilidad.
Los químicos suelen aprovechar las diferencias de solubilidad para separar y purificar los compuestos de las mezclas de reacción, utilizando la técnica de extracción líquido-líquido. Esto se aplica en vastas áreas de la química, desde la síntesis de fármacos hasta el reprocesamiento de combustible nuclear gastado.
Tasa de disolución
La disolución no es un proceso instantáneo. La tasa de solubilización (en kg/s) está relacionada con el producto de solubilidad y el área superficial del material. La velocidad a la que se disuelve un sólido puede depender de su cristalinidad o falta de ella en el caso de sólidos amorfos y del área superficial (tamaño de cristalita) y la presencia de polimorfismo. Muchos sistemas prácticos ilustran este efecto, por ejemplo, en el diseño de métodos para la administración controlada de fármacos. En algunos casos, los equilibrios de solubilidad pueden tardar mucho tiempo en establecerse (horas, días, meses o muchos años, según la naturaleza del soluto y otros factores).
La velocidad de disolución a menudo se puede expresar mediante la ecuación de Noyes-Whitney o la ecuación de Nernst y Brunner de la forma:
donde:
-
= masa de material disuelto
-
= tiempo
-
= área de superficie de la interfase entre la sustancia disuelta y el solvente
-
= coeficiente de difusión
-
= espesor de la capa límite del solvente en la superficie de la sustancia que se disuelve
-
= concentración de masa de la sustancia en la superficie
-
= concentración de masa de la sustancia en la mayor parte del disolvente
Para disolución limitada por difusión (o transferencia de masa si hay mezcla), 
Las tasas de disolución varían en órdenes de magnitud entre diferentes sistemas. Por lo general, las velocidades de disolución muy bajas son paralelas a las solubilidades bajas, y las sustancias con solubilidades altas exhiben velocidades de disolución altas, como lo sugiere la ecuación de Noyes-Whitney.
Teorías de la solubilidad
Producto de solubilidad
Las constantes de solubilidad se utilizan para describir soluciones saturadas de compuestos iónicos de solubilidad relativamente baja (ver equilibrio de solubilidad). La constante de solubilidad es un caso especial de una constante de equilibrio. Dado que es un producto de concentraciones de iones en equilibrio, también se conoce como producto de solubilidad. Describe el equilibrio entre los iones disueltos de la sal y la sal no disuelta. La constante de solubilidad también es "aplicable" (es decir, útil) a la precipitación, la inversa de la reacción de disolución. Al igual que con otras constantes de equilibrio, la temperatura puede afectar el valor numérico de la constante de solubilidad. Si bien la constante de solubilidad no es tan simple como la solubilidad, el valor de esta constante generalmente es independiente de la presencia de otras especies en el solvente.
Otras teorías
La teoría de la solución de Flory-Huggins es un modelo teórico que describe la solubilidad de los polímeros. Los parámetros de solubilidad de Hansen y los parámetros de solubilidad de Hildebrand son métodos empíricos para la predicción de la solubilidad. También es posible predecir la solubilidad a partir de otras constantes físicas como la entalpía de fusión.
El coeficiente de partición octanol-agua, generalmente expresado como su logaritmo (Log P), es una medida de la solubilidad diferencial de un compuesto en un solvente hidrofóbico (1-octanol) y un solvente hidrofílico (agua). El logaritmo de estos dos valores permite clasificar los compuestos en términos de hidrofilicidad (o hidrofobicidad).
El cambio de energía asociado con la disolución generalmente se da por mol de soluto como la entalpía de la solución.
Aplicaciones
La solubilidad tiene una importancia fundamental en un gran número de disciplinas científicas y aplicaciones prácticas, que van desde el procesamiento de minerales y el reprocesamiento nuclear hasta el uso de medicamentos y el transporte de contaminantes.
A menudo se dice que la solubilidad es una de las "propiedades características de una sustancia", lo que significa que la solubilidad se usa comúnmente para describir la sustancia, para indicar la polaridad de una sustancia, para ayudar a distinguirla de otras sustancias y como guía para las aplicaciones. de la sustancia Por ejemplo, el índigo se describe como "insoluble en agua, alcohol o éter pero soluble en cloroformo, nitrobenceno o ácido sulfúrico concentrado".
La solubilidad de una sustancia es útil cuando se separan mezclas. Por ejemplo, una mezcla de sal (cloruro de sodio) y sílice se puede separar disolviendo la sal en agua y filtrando la sílice no disuelta. La síntesis de compuestos químicos, por miligramo en un laboratorio o por tonelada en la industria, hace uso de las solubilidades relativas del producto deseado, así como de materiales de partida, subproductos y productos secundarios sin reaccionar para lograr la separación.
Otro ejemplo de esto es la síntesis de ácido benzoico a partir de bromuro de fenilmagnesio y hielo seco. El ácido benzoico es más soluble en un disolvente orgánico como el diclorometano o el éter dietílico y, cuando se agita con este disolvente orgánico en un embudo de decantación, se disuelve preferentemente en la capa orgánica. Los otros productos de reacción, incluido el bromuro de magnesio, permanecerán en la capa acuosa, lo que muestra claramente que se logra la separación basada en la solubilidad. Este proceso, conocido como extracción líquido-líquido, es una técnica importante en la química sintética. El reciclaje se utiliza para garantizar la máxima extracción.
Solubilidad diferencial
En los sistemas que fluyen, las diferencias en la solubilidad a menudo determinan el transporte de especies impulsado por la disolución-precipitación. Esto sucede cuando diferentes partes del sistema experimentan diferentes condiciones. Incluso condiciones ligeramente diferentes pueden tener efectos significativos, si se les da el tiempo suficiente.
Por ejemplo, se encuentra que los compuestos de solubilidad relativamente baja son solubles en ambientes más extremos, lo que resulta en efectos geoquímicos y geológicos de la actividad de los fluidos hidrotermales en la corteza terrestre. Estos son a menudo la fuente de depósitos minerales económicos de alta calidad y gemas preciosas o semipreciosas. De la misma manera, los compuestos con baja solubilidad se disolverán durante un tiempo prolongado (tiempo geológico), lo que resultará en efectos significativos, como sistemas de cuevas extensos o superficies terrestres kársticas.
Solubilidad de compuestos iónicos en agua
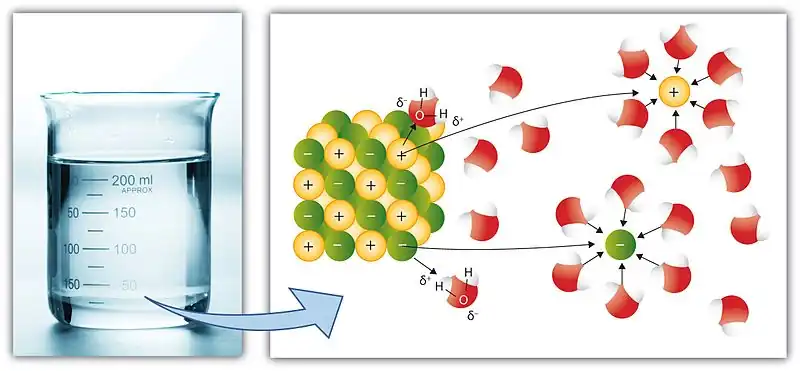
Algunos compuestos iónicos (sales) se disuelven en agua, que surge debido a la atracción entre cargas positivas y negativas (ver: solvatación). Por ejemplo, los iones positivos de la sal (por ejemplo, Ag) atraen el átomo de oxígeno parcialmente negativo en H 2 O. Asimismo, los iones negativos de la sal (p. ej., Cl) atraen los hidrógenos parcialmente positivos del H 2 O. Nota: el átomo de oxígeno es parcialmente negativo porque es más electronegativo que el hidrógeno y viceversa (ver: polaridad química).AgCl (s) ⇌ Ag (ac) + Cl (ac)
Sin embargo, existe un límite en la cantidad de sal que se puede disolver en un volumen dado de agua. Esta concentración es la solubilidad y está relacionada con el producto de solubilidad , Ksp. Esta constante de equilibrio depende del tipo de sal (AgCl vs. NaCl, por ejemplo), la temperatura y el efecto del ion común.
Se puede calcular la cantidad de AgCl que se disolverá en 1 litro de agua pura de la siguiente manera:K sp = [Ag ] × [Cl ] / M (definición de producto de solubilidad; M = mol/L)K sp = 1,8 × 10 (de una tabla de productos de solubilidad)
[Ag ] = [Cl ], en ausencia de otras sales de plata o cloruro, por lo que[Ag ] = 1,8 × 10 M[Ag ] = 1,34 × 10 mol/L
El resultado: 1 litro de agua puede disolver 1,34 × 10 moles de AgCl a temperatura ambiente. En comparación con otras sales, AgCl es poco soluble en agua. Por ejemplo, la sal de mesa (NaCl) tiene un K sp = 36 mucho más alto y, por lo tanto, es más soluble. La siguiente tabla ofrece una descripción general de las reglas de solubilidad para varios compuestos iónicos.
| Soluble | Insoluble |
|---|---|
| Compuestos del grupo I y NH 4 (excepto fosfato de litio) | Carbonatos (excepto Grupo I, NH 4 y compuestos de uranilo) |
| nitratos | Sulfitos (excepto compuestos del Grupo I y NH 4) |
| Acetatos (etanoatos) (excepto compuestos de Ag) | Fosfatos (excepto compuestos del Grupo I y NH 4 (excluyendo Li)) |
| Cloruros (cloratos y percloratos), bromuros y yoduros (excepto Ag, Pb, Cu y Hg 2) | Hidróxidos y óxidos (excepto Grupo I, NH 4, Ba, Sr y Tl) |
| Sulfatos (excepto Ag, Pb, Ba, Sr y Ca) | Sulfuros (excepto compuestos del Grupo I, Grupo II y NH 4) |
Solubilidad de compuestos orgánicos
El principio descrito anteriormente bajo la polaridad, que lo similar se disuelve, es la guía habitual para la solubilidad con sistemas orgánicos. Por ejemplo, la vaselina se disolverá en gasolina porque tanto la vaselina como la gasolina son hidrocarburos no polares. Por otro lado, no se disolverá en alcohol etílico o agua, ya que la polaridad de estos disolventes es demasiado alta. El azúcar no se disuelve en gasolina, ya que el azúcar es demasiado polar en comparación con la gasolina. Por lo tanto, una mezcla de gasolina y azúcar se puede separar por filtración o extracción con agua.
Solución sólida
Este término se usa a menudo en el campo de la metalurgia para referirse a la medida en que un elemento de aleación se disolverá en el metal base sin formar una fase separada. La línea (o curva) de solvus o solubilidad es la línea (o líneas) en un diagrama de fase que dan los límites de adición de soluto. Es decir, las líneas muestran la cantidad máxima de un componente que se puede agregar a otro componente y aún estar en solución sólida. En la estructura cristalina del sólido, el elemento 'soluto' puede tomar el lugar de la matriz dentro de la red (una posición de sustitución; por ejemplo, cromo en hierro) o tomar un lugar en un espacio entre los puntos de la red (una posición intersticial); por ejemplo, carbono en hierro).
En la fabricación microelectrónica, la solubilidad sólida se refiere a la concentración máxima de impurezas que se pueden colocar en el sustrato.
En compuestos sólidos (a diferencia de los elementos), la solubilidad de un elemento soluto también puede depender de las fases que se separan en equilibrio. Por ejemplo, la cantidad de Sn soluble en la fase ZnSb puede depender significativamente de si las fases que se separan en equilibrio son (Zn 4 Sb 3 +Sn(L)) o (ZnSnSb 2 +Sn(L)). Además de estos, el compuesto ZnSb con Sn como soluto puede separarse en otras combinaciones de fases después de alcanzar el límite de solubilidad dependiendo de la composición química inicial durante la síntesis. Cada combinación produce una solubilidad diferente de Sn en ZnSb. Por lo tanto, los estudios de solubilidad en compuestos, concluidos en la primera instancia de observación de fases secundarias que se separan, podrían subestimar la solubilidad.Si bien el número máximo de fases que se separan a la vez en equilibrio puede determinarse mediante la regla de fase de Gibb, para los compuestos químicos no hay límite en el número de tales combinaciones de separación de fases. Por lo tanto, establecer experimentalmente la "solubilidad máxima" en compuestos sólidos puede ser difícil y requiere el equilibrio de muchas muestras. Si el defecto cristalográfico dominante (principalmente defectos puntuales intersticiales o de sustitución) implicados en la solución sólida se puede intuir químicamente de antemano, el uso de algunas pautas termodinámicas simples puede reducir considerablemente el número de muestras necesarias para establecer la máxima solubilidad.
Disolución incongruente
Muchas sustancias se disuelven de manera congruente (es decir, la composición del sólido y el soluto disuelto coinciden estequiométricamente). Sin embargo, algunas sustancias pueden disolverse de manera incongruente, por lo que la composición del soluto en solución no coincide con la del sólido. Esta solubilización va acompañada de la alteración del "sólido primario" y posiblemente de la formación de una fase sólida secundaria. Sin embargo, en general, también queda algo de sólido primario y se establece un equilibrio de solubilidad complejo. Por ejemplo, la disolución de albita puede resultar en la formación de gibbsita.NaAlSi 3 O 8 (s) + H + 7H 2 O ⇌ Na + Al(OH) 3 (s) + 3H 4 SiO 4.
En este caso, se espera que la solubilidad de la albita dependa de la relación sólido-disolvente. Este tipo de solubilidad es de gran importancia en geología, donde da como resultado la formación de rocas metamórficas.
En principio, tanto la disolución congruente como la incongruente pueden conducir a la formación de fases sólidas secundarias en equilibrio. Entonces, en el campo de la Ciencia de los Materiales, la solubilidad para ambos casos se describe de manera más general en los diagramas de fase de composición química.
Predicción de solubilidad
La solubilidad es una propiedad de interés en muchos aspectos de la ciencia, incluidos, entre otros: predicciones ambientales, bioquímica, farmacia, diseño de fármacos, diseño agroquímico y unión de ligandos de proteínas. La solubilidad acuosa es de fundamental interés debido a las funciones vitales biológicas y de transporte que desempeña el agua. Además de este claro interés científico por la solubilidad en agua y los efectos de los disolventes; Las predicciones precisas de solubilidad son importantes industrialmente. La capacidad de predecir con precisión la solubilidad de una molécula representa un gran ahorro económico potencial en muchos procesos de desarrollo de productos químicos, como los productos farmacéuticos.En la industria farmacéutica, las predicciones de solubilidad forman parte del proceso de optimización de plomo en etapa temprana de los candidatos a fármacos. La solubilidad sigue siendo una preocupación hasta la formulación. Se han aplicado varios métodos a dichas predicciones, incluidas las relaciones cuantitativas estructura-actividad (QSAR), las relaciones cuantitativas estructura-propiedad (QSPR) y la extracción de datos. Estos modelos proporcionan predicciones eficientes de solubilidad y representan el estándar actual. El inconveniente de estos modelos es que pueden carecer de conocimiento físico. Un método basado en la teoría física, capaz de lograr niveles similares de precisión a un costo razonable, sería una poderosa herramienta científica e industrial.
Los métodos basados en la teoría física tienden a utilizar ciclos termodinámicos, un concepto de la termodinámica clásica. Los dos ciclos termodinámicos comunes utilizados involucran el cálculo de la energía libre de sublimación (sólido a gas sin pasar por un estado líquido) y la energía libre de solvatar una molécula gaseosa (gas a solución), o la energía libre de fusión (sólido a gas). a una fase fundida) y la energía libre de mezcla (fundido a solución). Estos dos procesos se representan en los siguientes diagramas.
Estos ciclos se han utilizado para intentos de predicciones de primeros principios (resolver utilizando las ecuaciones físicas fundamentales) utilizando modelos solventes motivados físicamente, para crear ecuaciones paramétricas y modelos QSPR y combinaciones de los dos. El uso de estos ciclos permite el cálculo de la energía libre de solvatación indirectamente mediante gas (en el ciclo de sublimación) o fusión (ciclo de fusión). Esto es útil ya que calcular directamente la energía libre de solvatación es extremadamente difícil. La energía libre de solvatación se puede convertir en un valor de solubilidad usando varias fórmulas, el caso más general se muestra a continuación, donde el numerador es la energía libre de solvatación, R es la constante de los gases y T es la temperatura en grados Kelvin.
Las ecuaciones ajustadas bien conocidas para la predicción de la solubilidad son las ecuaciones generales de solubilidad. Estas ecuaciones se derivan del trabajo de Yalkowsky et al. Primero se da la fórmula original, seguida de una fórmula revisada que asume una suposición diferente de miscibilidad completa en octanol. 
Estas ecuaciones se basan en los principios del ciclo de fusión.
Contenido relacionado
Hermann Kolbe
Johannes Nicolaus Bronsted
Ciclo de Calvin




