Síntesis de Madelung
En química orgánica, la síntesis de Madelung es una reacción química que produce indoles (sustituidos o no sustituidos) mediante la ciclación intramolecular de N-fenilamidas utilizando una base fuerte a alta temperatura. La síntesis de Madelung fue reportada en 1912 por Walter Madelung, cuando observó que el 2-fenilindol se sintetizaba usando N-benzoil-o-toluidina y dos equivalentes de etóxido de sodio en una reacción calentada y sin aire. Las condiciones de reacción comunes incluyen el uso de alcóxido de sodio o potasio como base en disolventes de hexano o tetrahidrofurano, a temperaturas que oscilan entre 200 y 400 °C. También se requiere un paso de hidrólisis en la síntesis. La síntesis de Madelung es importante porque es una de las pocas reacciones conocidas que producen indoles a partir de una ciclación térmica catalizada por bases de N-acil-o-toluidinas.
Reacción general

Son posibles variantes con otras bases o sustituyentes adicionales, pero el método se limita esencialmente a la preparación de 2-alquinilindoles (no fácilmente accesibles mediante sustitución aromática electrófila) debido a las intensas condiciones de reacción. A continuación se presenta un mecanismo de reacción detallado para la síntesis de Madelung.
Mecanismo de reacción
La reacción comienza con la extracción de un hidrógeno del nitrógeno del sustituyente amida y la extracción de un hidrógeno bencílico del sustituyente orto al sustituyente amida mediante una base fuerte. A continuación, el carbanión resultante de la extracción con hidrógeno bencílico realiza un ataque nucleofílico sobre el carbono carbonilo electrófilo del grupo amida. Cuando esto ocurre, el enlace pi de la amida se convierte en un par solitario, creando oxígeno cargado negativamente. Después de estos pasos iniciales, ya no se requiere una base fuerte y debe ocurrir la hidrólisis. El nitrógeno cargado negativamente se protona para recuperar su carga neutra y el oxígeno se protona dos veces para albergar una carga positiva y convertirse en un buen grupo saliente. Un par solitario del nitrógeno forma un enlace pi para expulsar el grupo saliente cargado positivamente y también hace que el nitrógeno albergue una carga positiva. El paso final de la reacción es una reacción de eliminación (específicamente una reacción E2), que implica la extracción del otro hidrógeno que alguna vez fue bencílico, antes de que se formara el compuesto bicíclico, cuyos electrones se convierten en un nuevo enlace pi en el anillo. sistema. Esto permite que el enlace pi formado por el nitrógeno en el paso anterior se convierta nuevamente en un par solitario en el nitrógeno para restaurar la carga neutra del nitrógeno.
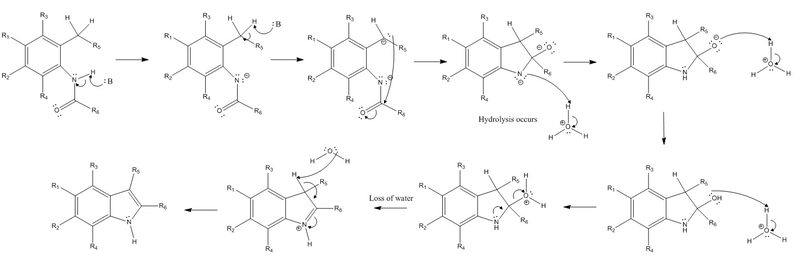
Avances en la mejora de las condiciones de reacción
Se han aplicado varias técnicas para aumentar el rendimiento del producto indol deseado. Cuando el anillo aromático tiene sustituyentes donadores de electrones se obtienen mayores rendimientos, y ocurre lo contrario cuando el anillo aromático tiene sustituyentes aceptores de electrones. Sin embargo, cuando el sustituyente R5 es un sustituyente aceptor de electrones, el rendimiento aumenta en lugar de disminuir. Además, la eficacia de la reacción también depende en gran medida del volumen del sustituyente R6. Cuanto más voluminoso es este grupo, menos eficiente es la reacción. Las condiciones requeridas para la síntesis de Madelung son bastante severas. Afortunadamente, desde entonces se han aplicado las modificaciones antes mencionadas para mejorar su practicidad, trabajando para disminuir la temperatura requerida a la que se realiza la reacción y aumentar el rendimiento del producto deseado. Por ejemplo, cuando se colocan donadores de electrones en el anillo aromático de la N-fenilamida y se sustituye un sustituyente aceptor de electrones en R5, la temperatura requerida para la reacción disminuye a aproximadamente 25 °C. Aún más impresionante, los investigadores han descubierto que la temperatura requerida para la síntesis de Madelung disminuye a un rango de temperatura de -20 – 25 °C cuando se utilizan bases de butil litio (BuLi) y diisopropilamida de litio (LDA), y cuando se utiliza tetrahidrofurano como base. solvente. Esta modificación particular, el uso de cualquiera de estas bases mediadas por metales, se denomina variación Madelung-Houlihan.
Aplicaciones sintéticas
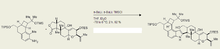
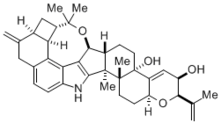
La síntesis de Madelung tiene muchas aplicaciones importantes en química, bioquímica y química industrial. Esta reacción sirvió para sintetizar, con un rendimiento del 81%, el alcaloide indol tremorgénico (-)-penitrem D, de arquitectura compleja, una molécula producida naturalmente por el hongo cornezuelo de centeno que causa diversas enfermedades musculares y neurológicas en el ganado. Debido a que esta toxina causa en última instancia importantes problemas económicos en la industria ganadera, es de gran importancia comprender cómo sintetizar y descomponer fácilmente el alcaloide (-)-penitrem D. Sin embargo, la síntesis de una molécula tan compleja fue, en sí misma, una hazaña increíble.
Otra faceta en la que la síntesis de Madelung ha resultado útil es en la síntesis de 2,6-difenil-1,5-diaza-1,5-dihidro-s-indaceno, a partir de 2,5-dimetil-1,4-fenilendiamina.
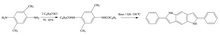
Esta síntesis se realizó sin modificaciones a la síntesis de Madelung, utilizando una base de etóxido de sodio a una temperatura de 320 – 330 °C. Se ha demostrado que este indaceno es un diodo emisor de luz orgánico que puede tener aplicaciones importantes para pantallas de luz de bajo costo en la industria comercial.
La síntesis de Madelung modificada por Smith
La síntesis de Madelung modificada por Smith, también llamada síntesis de indol de Smith, fue descubierta en 1986 por Amos Smith y su equipo de investigación. Esta síntesis emplea una reacción de condensación de reactivos de organolitio derivados de 2-alquil-N-trimetilsilil anilinas por ésteres o ácidos carboxílicos para producir indoles sustituidos. Esta síntesis ha demostrado ser aplicable a una amplia variedad de anilinas sustituidas, incluidas aquellas con grupos alquilo, metoxi y haluro, y puede reaccionar con ésteres o lactonas no enolizables para producir intermedios de N-litiocetamina. Estos intermedios luego se someten a una olefinación intramolecular de Peterson con heteroátomos para producir indolininas, que luego se tautomerizan a indoles 2-sustituidos. La síntesis de indol de Smith es una de las modificaciones más importantes de la síntesis de Madelung.
Mecanismo de reacción de la síntesis del indol de Smith
La síntesis de indol de Smith comienza mediante el uso de dos equivalentes de un reactivo de organolitio (ya que los reactivos de organolitio son bases muy fuertes) para extraer hidrógeno tanto del sustituyente alquilo como del nitrógeno, lo que da como resultado una carga negativa en ambos. La síntesis procede con un ataque nucleofílico del carbanión sobre el carbono carbonilo electrófilo del éster o ácido carboxílico. Cuando esto ocurre, el enlace pi del electrófilo se convierte en un par solitario en el oxígeno. Estos pares solitarios luego se reconvierten nuevamente en un enlace pi, lo que resulta en la expulsión del grupo -OR. A continuación, el nitrógeno cargado negativamente realiza un ataque nucleofílico sobre el carbono carbonilo electrófilo adyacente, provocando nuevamente que el enlace pi del electrófilo se convierta en un par solitario en el oxígeno. Este oxígeno cargado negativamente realiza un ataque nucleofílico sobre el átomo de silicio del grupo trimetilsililo (TMS), lo que da como resultado un compuesto tricíclico, un átomo de silicio cargado positivamente y un átomo de oxígeno neutro. La síntesis se realiza a través de una olefinación intramolecular de Peterson del heteroátomo, lo que finalmente resulta en una reacción de eliminación que expulsa un grupo TMSO y forma un enlace pi en el anillo de cinco miembros en el átomo de nitrógeno. Luego, se produce la tautomerización ceto-enol, lo que da como resultado el producto deseado.

Contenido relacionado
Ley de Fick
Miscibilidad
Masa molar