Peso del cuerpo humano
El peso del cuerpo humano es la masa o el peso de una... (leer más)
El síndrome de ovario poliquístico o SOP es el trastorno endocrino más común en mujeres en edad reproductiva. El síndrome lleva el nombre de los quistes característicos que pueden formarse en los ovarios, aunque es importante señalar que este es un signo y no la causa subyacente del trastorno.
Las mujeres con SOP pueden experimentar períodos menstruales irregulares, períodos abundantes, exceso de vello, acné, dolor pélvico, dificultad para quedar embarazada y parches de piel gruesa, más oscura y aterciopelada. Las características principales de este síndrome incluyen: hiperandrogenismo, anovulación, resistencia a la insulina y alteración neuroendocrina.
Una revisión de la evidencia internacional encontró que la prevalencia del síndrome de ovario poliquístico podría llegar al 26 % entre algunas poblaciones, aunque se informan rangos entre el 4 % y el 18 % para la población general. A pesar de su alta prevalencia, la causa exacta del SOP sigue siendo incierta y no existe una cura conocida.
Se utilizan comúnmente dos definiciones:
En 1990, un taller de consenso patrocinado por NIH/NICHD sugirió que una persona tiene PCOS si tiene todo lo siguiente:
En 2003, un taller de consenso patrocinado por ESHRE/ASRM en Rotterdam indicó que el SOP está presente si se cumplen 2 de 3 criterios, en ausencia de otras entidades que puedan causar estos hallazgos:
La definición de Rotterdam es más amplia e incluye a muchas más mujeres, siendo las más notables las mujeres sin exceso de andrógenos. Los críticos dicen que los hallazgos obtenidos del estudio de mujeres con exceso de andrógenos no necesariamente pueden extrapolarse a mujeres sin exceso de andrógenos.
En 2006, la Androgen Excess PCOS Society sugirió un ajuste de los criterios de diagnóstico a todos los siguientes:
Los signos y síntomas del síndrome de ovario poliquístico incluyen períodos menstruales irregulares o nulos, períodos abundantes, exceso de vello corporal y facial, acné, dolor pélvico, dificultad para quedar embarazada y parches de piel gruesa, más oscura y aterciopelada. Este trastorno metabólico, endocrino y reproductivo no está universalmente definido, pero los síntomas más comunes son períodos irregulares o ausentes, quistes ováricos, ovarios agrandados, exceso de andrógenos, aumento de peso e hirsutismo. Las condiciones asociadas incluyen diabetes tipo 2, obesidad, apnea obstructiva del sueño, enfermedades cardíacas, trastornos del estado de ánimo y cáncer de endometrio.Esta enfermedad está relacionada con el número de folículos por ovario cada mes que crece del rango promedio de 6 a 8 al doble, triple o más. es importante distinguir entre PCOS (el síndrome) y una mujer con PCO (ovarios poliquísticos): para tener PCOS, una mujer debe tener al menos dos de estos tres síntomas (PCO, anovulación/oligoovulación e hiperandrogenismo). Esto significa que una mujer puede tener PCOS (que muestra anovulación e hiperandrogenismo) sin tener PCO. Por el contrario, tener PCO no indica que una persona necesariamente tenga PCOS.
Los signos y síntomas comunes del SOP incluyen los siguientes:
Las mujeres con SOP tienden a tener obesidad central, pero los estudios son contradictorios en cuanto a si la grasa abdominal visceral y subcutánea aumenta, no cambia o disminuye en mujeres con SOP en relación con mujeres reproductivamente normales con el mismo índice de masa corporal. En cualquier caso, se ha descubierto que los andrógenos, como la testosterona, la androstanolona (dihidrotestosterona) y el decanoato de nandrolona aumentan la deposición de grasa visceral tanto en hembras como en mujeres.
Aunque el 80 % del SOP se presenta en mujeres con obesidad, el 20 % de las mujeres diagnosticadas con la enfermedad son mujeres no obesas o "delgadas". Sin embargo, las mujeres obesas que tienen SOP tienen un mayor riesgo de resultados adversos, como hipertensión, resistencia a la insulina, síndrome metabólico e hiperplasia endometrial.
Aunque la mayoría de las mujeres con SOP tienen sobrepeso o son obesas, es importante reconocer que a las mujeres sin sobrepeso también se les puede diagnosticar SOP. Hasta el 30 % de las mujeres diagnosticadas con SOP mantienen un peso normal antes y después del diagnóstico. Las mujeres "delgadas" todavía enfrentan los diversos síntomas del SOP con los desafíos adicionales de que sus síntomas se aborden y reconozcan adecuadamente. Las mujeres delgadas a menudo no son diagnosticadas durante años y, por lo general, se diagnostican después de luchar para concebir.Es probable que las mujeres delgadas tengan un diagnóstico erróneo de diabetes y enfermedades cardiovasculares. Estas mujeres también tienen un mayor riesgo de desarrollar resistencia a la insulina, a pesar de no tener sobrepeso. Las mujeres delgadas a menudo se toman menos en serio con su diagnóstico de SOP y también enfrentan desafíos para encontrar opciones de tratamiento adecuadas. Esto se debe a que la mayoría de las opciones de tratamiento se limitan a enfoques de pérdida de peso y una dieta saludable.
Muchas personas no tienen la impresión de que la primera señal de advertencia suele ser un cambio en la apariencia. Pero también hay manifestaciones de problemas de salud mental, como ansiedad, depresión y trastornos alimentarios.
Un diagnóstico de SOP sugiere un mayor riesgo de lo siguiente:
El riesgo de cáncer de ovario y cáncer de mama no aumenta significativamente en general.
El SOP es causado por una combinación de factores genéticos y ambientales. Los factores de riesgo incluyen la obesidad, la falta de ejercicio físico y antecedentes familiares de alguien con la afección. Los hombres transgénero también pueden experimentar una tasa de SOP más alta de lo esperado. El diagnóstico se basa en dos de los siguientes tres hallazgos: anovulación, niveles elevados de andrógenos y quistes ováricos. Los quistes pueden ser detectables por ultrasonido. Otras condiciones que producen síntomas similares incluyen hiperplasia suprarrenal, hipotiroidismo y niveles altos de prolactina en la sangre.
El SOP es un trastorno heterogéneo de causa incierta. Hay alguna evidencia de que es una enfermedad genética. Dicha evidencia incluye el agrupamiento familiar de casos, una mayor concordancia en gemelos monocigóticos en comparación con dicigóticos y la heredabilidad de las características endocrinas y metabólicas del SOP. Existe alguna evidencia de que la exposición a niveles de andrógenos y la hormona antimülleriana (AMH) más altos de lo normal en el útero aumenta el riesgo de desarrollar síndrome de ovario poliquístico más adelante en la vida.
El componente genético parece heredarse de forma autosómica dominante con alta penetrancia genética pero expresividad variable en las mujeres; esto significa que cada niño tiene un 50 % de posibilidades de heredar las variantes genéticas predisponentes de un padre y, si una hija recibe las variantes, la hija tendrá la enfermedad hasta cierto punto. La(s) variante(s) genética(s) se puede(n) heredar del padre o de la madre, y se pueden transmitir tanto a los hijos (que pueden ser portadores asintomáticos o pueden tener síntomas como calvicie temprana y/o vello excesivo) como a las hijas, que mostrar signos de SOP. El fenotipo parece manifestarse, al menos parcialmente, a través de niveles elevados de andrógenos secretados por las células de la teca del folículo ovárico de mujeres con el alelo.El gen exacto afectado aún no ha sido identificado. En raras ocasiones, las mutaciones de un solo gen pueden dar lugar al fenotipo del síndrome. La comprensión actual de la patogenia del síndrome sugiere, sin embargo, que se trata de un trastorno multigénico complejo.
Debido a la escasez de estudios de detección a gran escala, la prevalencia de anomalías endometriales en el síndrome de ovario poliquístico sigue sin conocerse, aunque las mujeres con esta afección pueden tener un mayor riesgo de hiperplasia y carcinoma endometriales, así como de disfunción menstrual e infertilidad.
La gravedad de los síntomas del SOP parece estar determinada en gran medida por factores como la obesidad. PCOS tiene algunos aspectos de un trastorno metabólico, ya que sus síntomas son parcialmente reversibles. Aunque se considera un problema ginecológico, el SOP consta de 28 síntomas clínicos.
Aunque el nombre sugiere que los ovarios son fundamentales para la patología de la enfermedad, los quistes son un síntoma en lugar de la causa de la enfermedad. Algunos síntomas del SOP persistirán incluso si se extirpan ambos ovarios; la enfermedad puede aparecer incluso si los quistes están ausentes. Desde su primera descripción por Stein y Leventhal en 1935, los criterios de diagnóstico, síntomas y factores causales están sujetos a debate. Los ginecólogos a menudo lo ven como un problema ginecológico, siendo los ovarios el principal órgano afectado. Sin embargo, conocimientos recientes muestran un trastorno multisistémico, cuyo principal problema radica en la regulación hormonal en el hipotálamo, con la participación de muchos órganos. El término PCOS se usa debido al hecho de que existe un amplio espectro de síntomas posibles. Es común tener ovarios poliquísticos sin tener SOP;
El SOP puede estar relacionado o empeorado por exposiciones durante el período prenatal, factores epigenéticos, impactos ambientales (especialmente disruptores endocrinos industriales, como el bisfenol A y ciertos medicamentos) y las tasas crecientes de obesidad.
Los disruptores endocrinos se definen como sustancias químicas que pueden interferir con el sistema endocrino imitando hormonas como el estrógeno. Sin embargo, se necesita investigación adicional para evaluar el papel que pueden desempeñar los disruptores endocrinos en la alteración de la salud reproductiva en las mujeres y posiblemente desencadenar o exacerbar el síndrome de ovario poliquístico y sus síntomas relacionados.
Los ovarios poliquísticos se desarrollan cuando los ovarios son estimulados para producir cantidades excesivas de hormonas androgénicas, en particular testosterona, ya sea por uno o una combinación de los siguientes (casi con seguridad combinados con susceptibilidad genética):
El síndrome adquirió su nombre más utilizado debido al signo común en el examen de ultrasonido de múltiples (poli) quistes ováricos. Estos "quistes" son de hecho folículos ováricos inmaduros. Los folículos se han desarrollado a partir de folículos primordiales, pero este desarrollo se ha detenido ("detenido") en una etapa temprana, debido a la alteración de la función ovárica. Los folículos pueden estar orientados a lo largo de la periferia del ovario, apareciendo como un "collar de perlas" en el examen de ultrasonido.
Las mujeres con SOP experimentan una mayor frecuencia de pulsos de GnRH hipotalámicos, lo que a su vez da como resultado un aumento en la relación LH/FSH.
La mayoría de las mujeres con SOP tienen resistencia a la insulina y/o son obesas. Sus niveles elevados de insulina contribuyen o causan las anomalías que se observan en el eje hipotálamo-pituitario-ovárico que conducen al síndrome de ovario poliquístico. La hiperinsulinemia aumenta la frecuencia del pulso de GnRH; dominancia de LH sobre FSH; aumento de la producción de andrógenos ováricos; disminución de la maduración folicular; y disminución de la unión de SHBG. Además, el exceso de insulina, que actúa a través de su receptor afín en presencia de la señalización del componente cAMP, regula al alza la actividad de la 17α-hidroxilasa a través de PI3K, siendo la actividad de la 17α-hidroxilasa responsable de sintetizar precursores de andrógenos. Los efectos combinados de la hiperinsulinemia contribuyen a un mayor riesgo de SOP. La resistencia a la insulina es un hallazgo común entre las mujeres con un peso normal, así como entre las mujeres con sobrepeso.
El tejido adiposo posee aromatasa, una enzima que convierte la androstenediona en estrona y la testosterona en estradiol. El exceso de tejido adiposo en mujeres obesas crea la paradoja de tener tanto un exceso de andrógenos (que son responsables del hirsutismo y la virilización) como un exceso de estrógenos (que inhiben la FSH por retroalimentación negativa).
El SOP puede estar asociado con la inflamación crónica, y varios investigadores correlacionan los mediadores inflamatorios con la anovulación y otros síntomas del SOP. De manera similar, parece haber una relación entre el SOP y un mayor nivel de estrés oxidativo.
No todas las personas con SOP tienen ovarios poliquísticos (PCO), ni todas las personas con quistes ováricos tienen SOP; aunque una ecografía pélvica es una importante herramienta de diagnóstico, no es la única. El diagnóstico es bastante sencillo utilizando los criterios de Rotterdam, incluso cuando el síndrome se asocia con una amplia gama de síntomas.
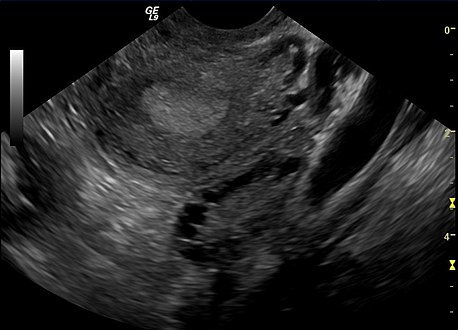 Ecografía transvaginal de ovario poliquístico
Ecografía transvaginal de ovario poliquístico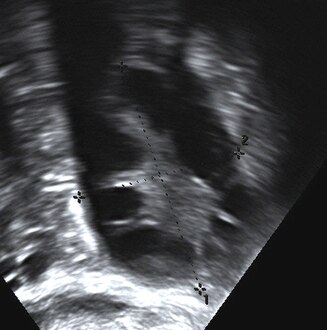 Ovario poliquístico como se ve en la ecografía
Ovario poliquístico como se ve en la ecografíaDeben investigarse otras causas de menstruación irregular o ausente e hirsutismo, como hipotiroidismo, hiperplasia suprarrenal congénita (deficiencia de 21-hidroxilasa), síndrome de Cushing, hiperprolactinemia, neoplasias secretoras de andrógenos y otros trastornos hipofisarios o suprarrenales.
Algunos otros análisis de sangre son sugestivos pero no diagnósticos. La proporción de LH (hormona luteinizante) a FSH (hormona estimulante del folículo), cuando se mide en unidades internacionales, es elevada en mujeres con SOP. Los puntos de corte comunes para designar índices LH/FSH anormalmente altos son 2:1 o 3:1, según se analice el Día 3 del ciclo menstrual. El patrón no es muy sensible; una proporción de 2:1 o superior estuvo presente en menos del 50 % de las mujeres con SOPQ en un estudio. A menudo hay niveles bajos de globulina transportadora de hormonas sexuales, en particular entre las mujeres obesas o con sobrepeso. La hormona antimülleriana (AMH) aumenta en el síndrome de ovario poliquístico y puede convertirse en parte de sus criterios de diagnóstico.
Los tratamientos primarios para PCOS incluyen cambios en el estilo de vida y uso de medicamentos.
Los objetivos del tratamiento se pueden considerar en cuatro categorías:
En cada una de estas áreas, existe un debate considerable sobre el tratamiento óptimo. Uno de los principales factores que subyacen al debate es la falta de ensayos clínicos a gran escala que comparen diferentes tratamientos. Los ensayos más pequeños tienden a ser menos confiables y, por lo tanto, pueden producir resultados contradictorios. Las intervenciones generales que ayudan a reducir el peso o la resistencia a la insulina pueden ser beneficiosas para todos estos objetivos, porque abordan lo que se cree que es la causa subyacente. Dado que el síndrome de ovario poliquístico parece causar una angustia emocional significativa, puede resultar útil un apoyo adecuado.
Cuando el SOP está asociado con sobrepeso u obesidad, la pérdida de peso exitosa es el método más efectivo para restaurar la ovulación/menstruación normal. Las pautas de la Asociación Estadounidense de Endocrinólogos Clínicos recomiendan el objetivo de lograr una pérdida de peso del 5 al 15 % o más, lo que mejora la resistencia a la insulina y todos los trastornos hormonales. Aún así, a muchas mujeres les resulta muy difícil lograr y mantener una pérdida de peso significativa. La resistencia a la insulina en sí misma puede causar un aumento de los antojos de alimentos y niveles más bajos de energía, lo que puede dificultar la pérdida de peso con una dieta regular para bajar de peso.Una revisión científica en 2013 encontró mejoras similares en el peso, la composición corporal y la tasa de embarazo, la regularidad menstrual, la ovulación, el hiperandrogenismo, la resistencia a la insulina, los lípidos y la calidad de vida con la pérdida de peso, independientemente de la composición de la dieta. Aún así, una dieta con IG bajo, en la que una porción significativa de los carbohidratos totales se obtiene de frutas, verduras y fuentes de granos integrales, ha resultado en una mayor regularidad menstrual que una dieta saludable combinada con macronutrientes.
La deficiencia de vitamina D puede desempeñar algún papel en el desarrollo del síndrome metabólico, y está indicado el tratamiento de cualquier deficiencia de este tipo. Sin embargo, una revisión sistemática de 2015 no encontró evidencia de que la suplementación con vitamina D redujera o mitigara las desregulaciones metabólicas y hormonales en el síndrome de ovario poliquístico. A partir de 2012, las intervenciones que utilizan suplementos dietéticos para corregir las deficiencias metabólicas en personas con SOP se probaron en ensayos clínicos pequeños, no controlados y no aleatorios; los datos resultantes son insuficientes para recomendar su uso.
Los medicamentos para el síndrome de ovario poliquístico incluyen anticonceptivos orales y metformina. Los anticonceptivos orales aumentan la producción de globulina transportadora de hormonas sexuales, lo que aumenta la unión de testosterona libre. Esto reduce los síntomas del hirsutismo causado por la testosterona alta y regula el retorno a los períodos menstruales normales. La metformina es un medicamento que se usa comúnmente en la diabetes mellitus tipo 2 para reducir la resistencia a la insulina, y se usa de forma extraoficial (en el Reino Unido, EE. UU., Australia y la Unión Europea) para tratar la resistencia a la insulina que se observa en el SOP. En muchos casos, la metformina también apoya la función ovárica y vuelve a la ovulación normal.La espironolactona se puede usar por sus efectos antiandrogénicos y la crema tópica eflornitina se puede usar para reducir el vello facial. Una nueva clase de medicamentos para la resistencia a la insulina, las tiazolidinedionas (glitazonas), han demostrado una eficacia equivalente a la metformina, pero la metformina tiene un perfil de efectos secundarios más favorable. El Instituto Nacional para la Salud y la Excelencia Clínica del Reino Unido recomendó en 2004 que las mujeres con síndrome de ovario poliquístico y un índice de masa corporal superior a 25 reciban metformina cuando otras terapias no hayan producido resultados. Es posible que la metformina no sea eficaz en todos los tipos de SOP y, por lo tanto, existe cierto desacuerdo sobre si debe usarse como terapia general de primera línea.Además de esto, la metformina se asocia con varios efectos secundarios desagradables, que incluyen dolor abdominal, sabor metálico en la boca, diarrea y vómitos. El uso de estatinas en el tratamiento del síndrome metabólico subyacente sigue sin estar claro.
Puede ser difícil quedar embarazada con SOP porque provoca una ovulación irregular. Los medicamentos para inducir la fertilidad al intentar concebir incluyen el inductor de la ovulación clomifeno o la leuprorelina pulsátil. La evidencia de ensayos controlados aleatorios sugiere que, en términos de nacidos vivos, la metformina puede ser mejor que el placebo, y la metformina más clomifeno puede ser mejor que el clomifeno solo, pero que en ambos casos es más probable que las mujeres experimenten efectos secundarios gastrointestinales con la metformina.
Se cree que la metformina es segura de usar durante el embarazo (categoría B de embarazo en los EE. UU.). Una revisión en 2014 concluyó que el uso de metformina no aumenta el riesgo de defectos congénitos importantes en mujeres tratadas con metformina durante el primer trimestre. La liraglutida puede reducir el peso y la circunferencia de la cintura en personas con SOP más que otros medicamentos.
No todas las mujeres con SOP tienen dificultad para quedar embarazadas. Pero algunas mujeres con SOP pueden tener dificultades para quedar embarazadas ya que su cuerpo no produce las hormonas necesarias para la ovulación regular. El SOP también podría aumentar el riesgo de aborto espontáneo o parto prematuro. Sin embargo, es posible tener un embarazo normal. Incluyendo atención médica y un estilo de vida saludable a seguir.
Para aquellas que lo hacen, la anovulación o la ovulación poco frecuente es una causa común y el SOP es la causa principal de la infertilidad anovulatoria. Otros factores incluyen cambios en los niveles de gonadotropinas, hiperandrogenemia e hiperinsulinemia. Al igual que las mujeres sin SOP, las mujeres con SOP que están ovulando pueden ser infértiles debido a otras causas, como obstrucciones de las trompas debido a antecedentes de enfermedades de transmisión sexual.
Para las mujeres anovulatorias con sobrepeso y con SOP, la pérdida de peso y los ajustes en la dieta, especialmente para reducir la ingesta de carbohidratos simples, se asocian con la reanudación de la ovulación natural. Se ha demostrado que las intervenciones de salud digital son particularmente efectivas para proporcionar una terapia combinada para controlar el SOP mediante cambios en el estilo de vida y medicamentos.
Para aquellas mujeres que después de la pérdida de peso todavía están anovulatorias o para las mujeres delgadas anovulatorias, los medicamentos letrozol y citrato de clomifeno son los principales tratamientos utilizados para promover la ovulación. Anteriormente, el medicamento antidiabético metformina se recomendaba como tratamiento para la anovulación, pero parece menos eficaz que el letrozol o el clomifeno.
Para las mujeres que no responden al letrozol o al clomifeno y a la modificación de la dieta y el estilo de vida, hay opciones disponibles que incluyen procedimientos de tecnología de reproducción asistida, como la hiperestimulación ovárica controlada con inyecciones de hormona estimulante del folículo (FSH) seguida de fertilización in vitro (FIV).
Aunque la cirugía no se realiza comúnmente, los ovarios poliquísticos se pueden tratar con un procedimiento laparoscópico llamado "perforación ovárica" (punción de 4 a 10 folículos pequeños con electrocauterio, láser o agujas de biopsia), que a menudo resulta en la reanudación de las ovulaciones espontáneas o ovulaciones después del tratamiento adyuvante con clomifeno o FSH. (La resección ovárica en cuña ya no se usa tanto debido a complicaciones como adherencias y la presencia de medicamentos frecuentemente efectivos). Sin embargo, existen preocupaciones sobre los efectos a largo plazo de la perforación ovárica en la función ovárica.
Aunque las mujeres con SOP son mucho más propensas a tener depresión que las mujeres sin SOP, la evidencia sobre el uso de antidepresivos en mujeres con SOP sigue sin ser concluyente. Sin embargo, la fisiopatología de la depresión y el estrés mental durante el síndrome de ovario poliquístico está relacionada con varios cambios, incluidos los cambios psicológicos, como la alta actividad de los marcadores proinflamatorios y el sistema inmunitario durante el estrés.
El SOP está asociado con otras afecciones relacionadas con la salud mental además de la depresión, como la ansiedad, el trastorno bipolar y el trastorno obsesivo-compulsivo.
Cuando sea apropiado (p. ej., en mujeres en edad fértil que requieren anticoncepción), una píldora anticonceptiva estándar suele ser eficaz para reducir el hirsutismo. Los progestágenos como el norgestrel y el levonorgestrel deben evitarse debido a sus efectos androgénicos. La metformina combinada con un anticonceptivo oral puede ser más eficaz que la metformina o el anticonceptivo oral por sí solo.
Otros medicamentos con efectos antiandrógenos incluyen la flutamida y la espironolactona, que pueden mejorar un poco el hirsutismo. La metformina puede reducir el hirsutismo, tal vez al reducir la resistencia a la insulina, y se usa a menudo si existen otras características, como resistencia a la insulina, diabetes u obesidad, que también deberían beneficiarse de la metformina. La eflornitina (Vaniqa) es un medicamento que se aplica sobre la piel en forma de crema y actúa directamente sobre los folículos pilosos para inhibir el crecimiento del cabello. Generalmente se aplica en la cara. También se pueden usar inhibidores de la 5-alfa reductasa (como finasterida y dutasterida); funcionan bloqueando la conversión de testosterona en dihidrotestosterona (esta última responsable de la mayoría de las alteraciones del crecimiento del cabello y el acné androgénico).
Aunque estos agentes han demostrado una eficacia significativa en ensayos clínicos (para anticonceptivos orales, en 60 a 100% de las personas), la reducción del crecimiento del vello puede no ser suficiente para eliminar la vergüenza social del hirsutismo o la inconveniencia de depilarse o afeitarse. Los individuos varían en su respuesta a diferentes terapias. Por lo general, vale la pena probar otros medicamentos si uno no funciona, pero los medicamentos no funcionan bien para todas las personas.
Si la fertilidad no es el objetivo principal, la menstruación generalmente se puede regular con una píldora anticonceptiva. El propósito de regular la menstruación, en esencia, es para la conveniencia de la mujer, y quizás para su sentido de bienestar; no existe un requisito médico para los períodos regulares, siempre que ocurran con la suficiente frecuencia.
Si no se desea un ciclo menstrual regular, entonces no se requiere necesariamente terapia para un ciclo irregular. La mayoría de los expertos dicen que, si se produce un sangrado menstrual al menos cada tres meses, entonces el endometrio (revestimiento del útero) se está eliminando con la frecuencia suficiente para prevenir un mayor riesgo de anomalías endometriales o cáncer. Si la menstruación ocurre con menos frecuencia o no ocurre en absoluto, se recomienda alguna forma de reemplazo de progestágeno.
Una revisión de 2017 concluyó que, si bien tanto el mioinositol como los D-quiroinositoles pueden regular los ciclos menstruales y mejorar la ovulación, falta evidencia sobre los efectos en la probabilidad de embarazo. Una revisión de 2012 y 2017 encontró que la suplementación con mioinositol parece ser efectiva para mejorar varios de los trastornos hormonales del síndrome de ovario poliquístico. El mioinositol reduce la cantidad de gonadotropinas y la duración de la hiperestimulación ovárica controlada en mujeres sometidas a fertilización in vitro. Una revisión de 2011 no encontró pruebas suficientes para concluir ningún efecto beneficioso del D-chiro-inositol. No hay pruebas suficientes para apoyar el uso de la acupuntura, los estudios actuales no son concluyentes y se necesitan ensayos controlados aleatorios adicionales.
PCOS no tiene cura, a partir de 2020. El tratamiento puede implicar cambios en el estilo de vida, como pérdida de peso y ejercicio. Las píldoras anticonceptivas pueden ayudar a mejorar la regularidad de los períodos, el crecimiento excesivo de vello y el acné. La metformina y los antiandrógenos también pueden ayudar. Se pueden usar otros tratamientos típicos para el acné y técnicas de depilación. Los esfuerzos para mejorar la fertilidad incluyen pérdida de peso, clomifeno o metformina. La fertilización in vitro es utilizada por algunos en quienes otras medidas no son efectivas.
El SOP es el trastorno endocrino más común entre las mujeres de 18 a 44 años. Afecta aproximadamente del 2 % al 20 % de este grupo de edad, según cómo se defina. Cuando alguien es infértil debido a la falta de ovulación, el SOP es la causa más común y podría orientar el diagnóstico de las pacientes. La descripción más antigua conocida de lo que ahora se reconoce como PCOS data de 1721 en Italia.
La prevalencia del SOP depende de la elección de los criterios de diagnóstico. La Organización Mundial de la Salud estima que afecta a 116 millones de mujeres en todo el mundo a partir de 2010 (3,4% de las mujeres). Otra estimación indica que el 7% de las mujeres en edad reproductiva se ven afectadas. Otro estudio que utilizó los criterios de Rotterdam encontró que alrededor del 18 % de las mujeres tenían SOP y que el 70 % de ellas no habían sido diagnosticadas previamente. La prevalencia también varía entre países debido a la falta de estudios científicos a gran escala; India, por ejemplo, tiene una supuesta tasa de 1 de cada 5 mujeres con SOP.
Hay pocos estudios que hayan investigado las diferencias raciales en los factores cardiometabólicos en mujeres con SOP. También hay datos limitados sobre las diferencias raciales en el riesgo de síndrome metabólico y enfermedad cardiovascular en adolescentes y adultos jóvenes con SOP. El primer estudio que examinó exhaustivamente las diferencias raciales descubrió diferencias raciales notables en los factores de riesgo de enfermedades cardiovasculares. Se encontró que las mujeres afroamericanas eran significativamente más obesas, con una prevalencia significativamente mayor de síndrome metabólico en comparación con las mujeres adultas blancas con SOP. Es importante para la investigación adicional de las diferencias raciales entre las mujeres con SOP, garantizar que todas las mujeres afectadas por SOP tengan los recursos disponibles para el manejo.
Los hallazgos ultrasonográficos de ovarios poliquísticos se encuentran en 8 a 25% de las mujeres no afectadas por el síndrome. Se descubre que el 14% de las mujeres que toman anticonceptivos orales tienen ovarios poliquísticos. Los quistes ováricos también son un efecto secundario común de los dispositivos intrauterinos (DIU) que liberan levonorgestrel.
Hay pocos estudios que hayan investigado las diferencias raciales en los factores cardiometabólicos en mujeres con SOP.
La condición fue descrita por primera vez en 1935 por los ginecólogos estadounidenses Irving F. Stein, Sr. y Michael L. Leventhal, de quienes se toma su nombre original de síndrome de Stein-Leventhal. Stein y Leventhal describieron por primera vez el síndrome de ovario poliquístico como un trastorno endocrino en los Estados Unidos y, desde entonces, se ha reconocido como una de las causas más comunes de infertilidad ovulatoria oligo entre las mujeres.
La primera descripción publicada de una persona con lo que ahora se reconoce como PCOS fue en 1721 en Italia. Los cambios en los ovarios relacionados con los quistes se describieron en 1844.
Otros nombres para este síndrome incluyen síndrome de ovario poliquístico, enfermedad de ovario poliquístico, hiperandrogenismo ovárico funcional, hipertecosis ovárica, síndrome de ovario escleroquístico y síndrome de Stein-Leventhal. La última opción homónima es el nombre original; ahora se usa, si es que se usa, solo para el subconjunto de mujeres con todos los síntomas de amenorrea con infertilidad, hirsutismo y ovarios poliquísticos agrandados.
La mayoría de los nombres comunes de esta enfermedad se derivan de un hallazgo típico en las imágenes médicas, llamado ovario poliquístico. Un ovario poliquístico tiene una cantidad anormalmente grande de óvulos en desarrollo visibles cerca de su superficie, que parecen muchos quistes pequeños.
En 2005, se informaron 4 millones de casos de PCOS en los EE. UU., con un costo de $ 4,36 mil millones en costos de atención médica. En 2016, del presupuesto de investigación del Instituto Nacional de Salud de $32,300 millones para ese año, el 0,1 % se gastó en la investigación del síndrome de ovario poliquístico. Entre las personas de entre 14 y 44 años, se estima de forma conservadora que el SOP cuesta 4370 millones de dólares al año.
A diferencia de las mujeres de la población general, las mujeres con SOP experimentan tasas más altas de depresión y ansiedad. Las pautas internacionales y las pautas indias sugieren que se deben considerar los factores psicosociales en mujeres con SOP, así como exámenes de detección de depresión y ansiedad. A nivel mundial, este aspecto se ha centrado cada vez más porque refleja el verdadero impacto del SOP en la vida de los pacientes. Las investigaciones muestran que el síndrome de ovario poliquístico afecta negativamente la calidad de vida del paciente.
Varias celebridades y figuras públicas han hablado sobre sus experiencias con PCOS, que incluyen:
El peso del cuerpo humano es la masa o el peso de una... (leer más)
Los alimentos reconfortantes o comida reconfortante son alimentos que brindan un valor nostálgico o sentimental a alguien, y pueden caracterizarse por su... (leer más)
El atractivo físico es el grado en que las características físicas de una persona se consideran estéticamente agradables o hermosas. El término a menudo... (leer más)