Síndrome de Marfan
síndrome de Marfan (SMF) es un trastorno genético multisistémico que afecta al tejido conectivo. Las personas con la afección tienden a ser altas y delgadas, con brazos, piernas, dedos de manos y pies largos. También suelen tener articulaciones excepcionalmente flexibles y espinas dorsales anormalmente curvadas. Las complicaciones más graves involucran el corazón y la aorta, con un mayor riesgo de prolapso de la válvula mitral y aneurisma aórtico. Los pulmones, los ojos, los huesos y la cubierta de la médula espinal también se ven comúnmente afectados. La severidad de los síntomas es variable.
MFS es causado por una mutación en FBN1, uno de los genes que produce fibrilina, lo que resulta en tejido conectivo anormal. Es un trastorno autosómico dominante. En aproximadamente el 75 % de los casos, se hereda de un padre con la afección, mientras que en aproximadamente el 25 % es una nueva mutación. El diagnóstico a menudo se basa en los criterios de Gante.
No existe una cura conocida para MFS. Muchas de las personas con el trastorno tienen una expectativa de vida normal con el tratamiento adecuado. El manejo a menudo incluye el uso de bloqueadores beta como propranolol o atenolol o, si no se toleran, bloqueadores de los canales de calcio o inhibidores de la ECA. Es posible que se requiera cirugía para reparar la aorta o reemplazar una válvula cardíaca. Se recomienda evitar el ejercicio extenuante para las personas con la afección.
Alrededor de 1 de cada 5000 a 1 de cada 10 000 personas tienen MFS. Las tasas de la condición son similares en diferentes regiones del mundo. Lleva el nombre del pediatra francés Antoine Marfan, quien lo describió por primera vez en 1896.
Signos y síntomas
Más de 30 signos y síntomas se asocian de forma variable con el síndrome de Marfan. Los más prominentes afectan los sistemas esquelético, cardiovascular y ocular, pero todo el tejido conjuntivo fibroso de todo el cuerpo puede verse afectado.
Sistema esquelético
La mayoría de los signos fácilmente visibles están asociados con el sistema esquelético. Muchas personas con síndrome de Marfan alcanzan una estatura superior a la media y algunas tienen extremidades desproporcionadamente largas y delgadas con muñecas delgadas y débiles y dedos de manos y pies largos.
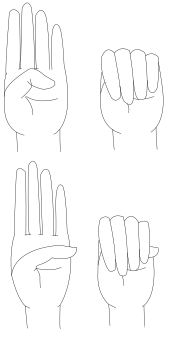
El signo de Steinberg, también conocido como el signo del pulgar, es una de las pruebas de examen clínico para la enfermedad de Marfan en las manos. Es una prueba clínica en la que la punta del pulgar se extiende más allá de la palma cuando el pulgar se junta en la mano cerrada.
Además de afectar la altura y las proporciones de las extremidades, las personas con síndrome de Marfan pueden tener curvatura lateral anormal de la columna vertebral, escoliosis, lordosis torácica, indentación anormal (pectus excavatum) o protrusión (pectus carinatum) del esternón, flexibilidad articular anormal, paladar ojival con dientes apiñados y sobremordida, pies planos, dedos en martillo, hombros encorvados y estrías inexplicables en la piel. También puede causar dolor en las articulaciones, huesos y músculos. Algunas personas con Marfan tienen trastornos del habla como resultado de paladar alto sintomático y mandíbulas pequeñas. Puede ocurrir osteoartritis temprana. Otros signos incluyen rango de movimiento limitado en las caderas debido a que la cabeza femoral sobresale en cavidades de cadera anormalmente profundas.
Ojos
En el síndrome de Marfan, la salud del ojo puede verse afectada de muchas maneras, pero el cambio principal es la dislocación parcial del cristalino, donde el cristalino se desplaza fuera de su posición normal. Esto ocurre debido a la debilidad de las zónulas ciliares, las hebras de tejido conectivo que suspenden el cristalino dentro del ojo. Las mutaciones responsables del síndrome de Marfan debilitan las zónulas y hacen que se estiren. Las zónulas inferiores se estiran con mayor frecuencia, lo que hace que el cristalino se desplace hacia arriba y hacia afuera, pero también puede moverse en otras direcciones. La miopía (miopía) y la visión borrosa son comunes debido a defectos del tejido conectivo en el ojo. La hipermetropía también puede resultar particularmente si la lente está muy subluxada. La subluxación (dislocación parcial) del cristalino puede detectarse clínicamente en aproximadamente el 60 % de las personas con síndrome de Marfan mediante el uso de un biomicroscopio con lámpara de hendidura. Si la subluxación del cristalino es sutil, se pueden usar imágenes con biomicroscopía de ultrasonido de alta resolución.
Otros signos y síntomas que afectan al ojo incluyen aumento de la longitud a lo largo del eje del globo ocular, miopía, aplanamiento de la córnea, estrabismo, exotropía y esotropía. Las personas con MFS también tienen un alto riesgo de glaucoma temprano y cataratas tempranas.
Sistema cardiovascular
Los signos y síntomas más graves asociados con el síndrome de Marfan involucran el sistema cardiovascular: fatiga indebida, dificultad para respirar, palpitaciones cardíacas, latidos cardíacos acelerados o dolor en el pecho que se irradia a la espalda, el hombro o el brazo. Los brazos, las manos y los pies fríos también pueden estar relacionados con MFS debido a una circulación inadecuada. Un soplo cardíaco, una lectura anormal en un ECG o síntomas de angina pueden indicar una mayor investigación. Los signos de regurgitación por prolapso de las válvulas mitral o aórtica (que controlan el flujo de sangre a través del corazón) resultan de la degeneración quística de la medial de las válvulas, que comúnmente se asocia con MFS (ver prolapso de la válvula mitral, regurgitación aórtica). Sin embargo, el signo principal que llevaría a un médico a considerar una afección subyacente es una aorta dilatada o un aneurisma aórtico. A veces, los problemas cardíacos no son aparentes hasta que el debilitamiento del tejido conectivo (degeneración quística medial) en la aorta ascendente provoca un aneurisma aórtico o una disección aórtica, una emergencia quirúrgica. Una disección aórtica suele ser fatal y se presenta con un dolor que se irradia hacia la espalda y produce una sensación de desgarro.
Debido a que las anomalías subyacentes del tejido conjuntivo causan MFS, aumenta la incidencia de dehiscencia de la válvula mitral protésica. Se debe tener cuidado de intentar reparar las válvulas cardíacas dañadas en lugar de reemplazarlas.
Pulmones
Las personas con síndrome de Marfan pueden verse afectadas por varios problemas relacionados con los pulmones. Un estudio encontró que solo el 37 % de la muestra de pacientes estudiada (edad media 32 ± 14 años; M 45 %) tenía una función pulmonar normal. El neumotórax espontáneo es común. En el neumotórax unilateral espontáneo, el aire escapa de un pulmón y ocupa el espacio pleural entre la pared torácica y el pulmón. El pulmón se comprime o colapsa parcialmente. Esto puede causar dolor, dificultad para respirar, cianosis y, si no se trata, la muerte. Otras posibles manifestaciones pulmonares de MFS incluyen apnea del sueño y enfermedad pulmonar obstructiva idiopática. Se han descrito cambios patológicos en los pulmones como cambios quísticos, enfisema, neumonía, bronquiectasias, ampollas, fibrosis apical y malformaciones congénitas como hipoplasia del lóbulo medio.
Sistema nervioso
La ectasia dural, el debilitamiento del tejido conectivo del saco dural que recubre la médula espinal, puede resultar en una pérdida de la calidad de vida. Puede estar presente durante mucho tiempo sin producir ningún síntoma perceptible. Los síntomas que pueden presentarse son dolor en la parte baja de la espalda, dolor en las piernas, dolor abdominal, otros síntomas neurológicos en las extremidades inferiores o dolores de cabeza, síntomas que generalmente disminuyen cuando se está acostado. En la radiografía, sin embargo, la ectasia dural no suele ser visible en las primeras etapas. Un empeoramiento de los síntomas podría justificar una resonancia magnética de la parte inferior de la columna. La ectasia dural que ha progresado a esta etapa aparecería en una resonancia magnética como una bolsa dilatada que se desgasta en las vértebras lumbares. Otros problemas espinales asociados con MFS incluyen enfermedad degenerativa del disco, quistes espinales y disfunción del sistema nervioso autónomo.
Genética
Cada padre con la afección tiene un 50 % de riesgo de transmitir el defecto genético a cualquier hijo debido a su naturaleza autosómica dominante. La mayoría de las personas con MFS tienen otro familiar afectado. Alrededor del 75% de los casos son hereditarios. Por otro lado, alrededor del 15-30% de todos los casos se deben a mutaciones genéticas de novo; tales mutaciones espontáneas ocurren en aproximadamente uno de cada 20.000 nacimientos. El síndrome de Marfan también es un ejemplo de mutación negativa dominante y haploinsuficiencia. Se asocia a expresividad variable; la penetrancia completa ha sido definitivamente documentada.
Patogénesis
El síndrome de Marfan está causado por mutaciones en el gen FBN1 en el cromosoma 15, que codifica la fibrilina 1, un componente glicoproteico de la matriz extracelular. La fibrilina-1 es esencial para la correcta formación de la matriz extracelular, incluida la biogénesis y el mantenimiento de las fibras elásticas. La matriz extracelular es fundamental tanto para la integridad estructural del tejido conjuntivo como para la reserva de factores de crecimiento. Las fibras elásticas se encuentran en todo el cuerpo, pero son particularmente abundantes en la aorta, los ligamentos y las zónulas ciliares del ojo; en consecuencia, estas áreas se encuentran entre las más afectadas. También puede ser causado por una variedad de tratamientos con cristales intravenosos en personas susceptibles al trastorno.
Se ha creado un ratón transgénico que porta una sola copia de una fibrilina-1 mutante, una mutación similar a la que se encuentra en el gen humano que causa el MFS. Esta cepa de ratón recapitula muchas de las características de la enfermedad humana y promete proporcionar información sobre la patogenia de la enfermedad. La reducción del nivel de fibrilina 1 normal provoca una enfermedad relacionada con Marfan en ratones.
El factor de crecimiento transformante beta (TGF-β) juega un papel importante en MFS. La fibrilina-1 se une directamente a una forma latente de TGF-β, manteniéndola secuestrada e incapaz de ejercer su actividad biológica. El modelo más simple sugiere que los niveles reducidos de fibrilina-1 permiten que los niveles de TGF-β aumenten debido a un secuestro inadecuado. Aunque no está probado cómo los niveles elevados de TGF-β son responsables de la patología específica que se observa con la enfermedad, se sabe que ocurre una reacción inflamatoria que libera proteasas que degradan lentamente las fibras elásticas y otros componentes de la matriz extracelular. La importancia de la vía del TGF-β se confirmó con el descubrimiento de un síndrome de Loeys-Dietz similar que afecta al gen TGFβR2 en el cromosoma 3, una proteína receptora del TGF-β. El síndrome de Marfan a menudo se ha confundido con el síndrome de Loeys-Dietz, debido a la considerable superposición clínica entre las dos patologías.
Síndrome marfanoide-progeroide-lipodistrofia
El síndrome marfanoide-progeroide-lipodistrofia (MPL), también conocido como síndrome de lipodistrofia de Marfan (MFLS), es una variante de MFS en la que los síntomas de Marfan se acompañan de características generalmente asociadas con el síndrome progeroide neonatal (también conocido como síndrome de Wiedemann- síndrome de Rautenstrauch) en el que se reducen los niveles de tejido adiposo blanco. Desde 2010, se ha ido acumulando evidencia de que la MPL es causada por mutaciones cerca del extremo 3'-terminal del gen FBN1. Se ha demostrado que estas personas también tienen deficiencia de asprosina, una hormona proteica reguladora de la glucosa que es el producto de escisión C-terminal de la profibrilina. Los niveles de asprosina observados en estas personas fueron más bajos de lo esperado para un genotipo heterocigoto, lo que concuerda con un efecto negativo dominante.
Diagnóstico
Los criterios de diagnóstico de MFS se acordaron internacionalmente en 1996. Sin embargo, el síndrome de Marfan suele ser difícil de diagnosticar en niños, ya que normalmente no muestran síntomas hasta que alcanzan la pubertad. Un diagnóstico se basa en los antecedentes familiares y en una combinación de indicadores mayores y menores del trastorno, raros en la población general, que ocurren en un individuo, por ejemplo: cuatro signos esqueléticos con uno o más signos en otro sistema del cuerpo, como ojos y cardiovascular en un individuo. Las siguientes condiciones pueden resultar de MFS, pero también pueden ocurrir en personas sin ningún trastorno subyacente conocido.
- aneurisma aórtico o dilatación
- Arachnodactyly
- GERD
- Válvula aórtica Bicuspid
- Cistos
- Necrosis medial quística
- Enfermedad de disco degenerativa
- Septum desviado
- Ectasia Dural
- Cataratas tempranas
- Temprano glaucoma
- Artritis temprana
- Ectopia lentis
- Emphysema
- Iris coloboma
- Altura superior al promedio
- Papitaciones cardíacas
- Hernias
- paladar de alta calidad
- Hipermovilidad de las articulaciones
- Kyphosis (respaldado)
- Válvula cardíaca de plomo
- Malocclusión
- Micrognathia (pequeña mandíbula inferior)
- Prolapso de válvula mitral
- Miopia (peligro)
- Enfermedad pulmonar obstructiva
- Osteopenia (densidad ósea baja)
- Pectus carinatum o excavatum
- Pes planus (pies hinchados)
- Neumotórax (pulmón colapsado)
- Destacamento retiniano
- Escoliosis
- Apnea del sueño
- Marcas de estiramiento no por embarazo o obesidad
- Los dientes abarrotados
- "Cara estrecha y delgada"
- Disfunción articular temporomandibular (TMD)
Nosología de Gante revisada
En 2010, se revisó la nosología de Gante y los nuevos criterios de diagnóstico reemplazaron el acuerdo anterior realizado en 1996. Los siete nuevos criterios pueden conducir a un diagnóstico:
En ausencia de antecedentes familiares de MFS:
- Aortic root Z-score ≥ 2 AND ectopia lentis
- Aortic root Z-score ≥ 2 Y una mutación FBN1
- raíz aórtica Z-score ≥ 2 Y una partitura sistémica* ≤ 7 puntos
- Ectopia lentis Y una mutación FBN1 con patología aórtica conocida
En presencia de antecedentes familiares de MFS (como se definió anteriormente):
- Ectopia lentis
- Clasificación sistémica* ≥ 7
- raíz aórtica Z-score ≥ 2
- Puntos para puntaje sistémico:
- Wrist AND thumb sign = 3 (wrist OR thumb sign = 1)
- Pectus carinatum deformity = 2 (pectus excavatum or chest asymmetry = 1)
- Deformidad de pie = 2 (plano de púas = 1)
- Ectasia Dural = 2
- Protrusio acetabuli = 2
- neumotórax = 2
- Reducción del segmento superior/proporción del segmento inferior y aumento del brazo/altura y no escoliosis grave = 1
- Escoliosis o kyfosis toracolumbar = 1
- Extensión reducida del codo = 1
- Características faciales (3/5) = 1 (dolichocefalia, enophthalmos, fisuras palpebrales subyacentes, hipoplasia malar, retrognatia)
- Estria de piel (marcas de estiramiento) = 1
- Miopía 3 diopteros = 1
- Prolapso de válvula mitral = 1
El signo del pulgar (signo de Steinberg) se obtiene pidiéndole a la persona que flexione el pulgar tanto como sea posible y luego cierre los dedos sobre él. Un signo positivo del pulgar es cuando toda la falange distal es visible más allá del borde cubital de la mano, causado por una combinación de hipermovilidad del pulgar y un pulgar que es más largo de lo normal.
El signo de la muñeca (signo de Walker-Murdoch) se obtiene pidiéndole a la persona que enrolle el pulgar y los dedos de una mano alrededor de la otra muñeca. Un signo de muñeca positivo es donde el dedo meñique y el pulgar se superponen, causado por una combinación de muñecas delgadas y dedos largos.
Diagnóstico diferencial
Muchos otros trastornos pueden producir el mismo tipo de características corporales que el síndrome de Marfan. Las pruebas genéticas y la evaluación de otros signos y síntomas pueden ayudar a diferenciarlos. Los siguientes son algunos de los trastornos que pueden manifestarse como "marfanoide":
- Congenital contractural arachnodactyly, también conocido como síndrome de Beals-Hecht
- Síndrome de Ehlers-Danlos
- Homocystinuria
- Síndrome de Loeys-Dietz
- Fenotipo de MASS
- neoplasia endocrina múltiple, tipo 2B
- Síndrome de Shprintzen-Goldberg
- Síndrome de pegatina
Administración
No existe una cura para el síndrome de Marfan, pero la esperanza de vida ha aumentado significativamente en las últimas décadas y ahora es similar a la de la persona promedio.
Se recomiendan chequeos regulares para monitorear la salud de las válvulas cardíacas y la aorta. El síndrome de Marfan se trata abordando cada problema a medida que surge y, en particular, con medicación preventiva, incluso para niños pequeños, para retrasar la progresión de la dilatación aórtica. El objetivo de esta estrategia de tratamiento es retardar la progresión de la dilatación aórtica y prevenir cualquier daño a las válvulas cardíacas eliminando las arritmias cardíacas, minimizando la frecuencia cardíaca y reduciendo la presión arterial de la persona.
Actividad física
La American Heart Association hizo las siguientes recomendaciones para las personas con síndrome de Marfan sin dilatación aórtica o con dilatación leve:
- Probablemente actividades permisibles: bolos, golf, patinaje (pero no hockey sobre hielo), snorkeling, paseo en riesgo, cinta de correr, bicicleta estacionaria, caminata modesta y tenis (dobles y singles).
- Riesgo intermedio: baloncesto (tanto completo como medio patio), racquetball, squash, running (impresión y jogging), esquí (bajo y cross-country), fútbol, tacto (flag) fútbol, béisbol, softball, bicicleta, natación de vuelta, motociclismo y equitación.
- Alto riesgo: culturismo, levantamiento de pesas (no gratis y pesos gratis), hockey sobre hielo, escalada de rocas, windsurf, surf y buceo.
Medicación
El tratamiento suele incluir el uso de bloqueadores beta como el propranolol o, si no se toleran, bloqueadores de los canales de calcio o inhibidores de la ECA. Los bloqueadores beta se usan para reducir el estrés ejercido sobre la aorta y para disminuir la dilatación aórtica.
Cirugía
Si la dilatación de la aorta progresa hasta convertirse en un aneurisma de diámetro significativo, causa una disección o una ruptura, o conduce a una falla de la válvula aórtica u otra válvula, entonces la cirugía (posiblemente un injerto de válvula aórtica compuesta o una válvula de raíz aórtica preservadora reemplazo) se hace necesario. Aunque la cirugía de injerto aórtico (o cualquier cirugía vascular) es una tarea seria, generalmente tiene éxito si se realiza de forma electiva. La cirugía en el contexto de disección o ruptura aórtica aguda es considerablemente más problemática. La cirugía electiva de válvula/injerto aórtico generalmente se considera cuando el diámetro de la raíz aórtica alcanza los 50 milímetros (2,0 pulgadas), pero cada caso debe ser evaluado específicamente por un cardiólogo calificado. Las nuevas técnicas quirúrgicas de conservación de válvulas son cada vez más comunes. A medida que las personas con síndrome de Marfan viven más tiempo, otras reparaciones vasculares se vuelven más comunes, por ejemplo, reparaciones de aneurismas de la aorta torácica descendente y aneurismas de vasos distintos de la aorta.
Las manifestaciones esqueléticas y oculares del síndrome de Marfan también pueden ser graves, aunque no potencialmente mortales. Estos síntomas generalmente se tratan de manera adecuada para la afección, como medicamentos para el dolor o relajantes musculares. Debido a que el síndrome de Marfan puede causar anomalías espinales asintomáticas, cualquier cirugía espinal contemplada en una persona con Marfan solo debe seguir imágenes detalladas y una planificación quirúrgica cuidadosa, independientemente de la indicación de la cirugía. Las complicaciones oculares de MFS a menudo se pueden tratar con cirugía. La ectopia lentis se puede tratar, ya que se pueden implantar quirúrgicamente lentes artificiales. Además, la cirugía puede tratar el glaucoma y las cataratas.
El tratamiento de un neumotórax espontáneo depende del volumen de aire en el espacio pleural y la progresión natural de la condición del individuo. Un neumotórax pequeño puede resolverse sin tratamiento activo en una o dos semanas. Los neumotórax recurrentes pueden requerir cirugía de tórax. Los neumotórax de tamaño moderado pueden necesitar drenaje torácico durante varios días en un hospital. Es probable que los neumotórax grandes sean emergencias médicas que requieran descompresión de emergencia.
Como enfoque alternativo, también se están utilizando soportes personalizados para la raíz aórtica. A partir de 2020, este procedimiento se ha utilizado en más de 300 personas y el primer caso ocurrió en 2004.
Embarazo
Durante el embarazo, incluso en ausencia de anomalías cardiovasculares previas a la concepción, las mujeres con síndrome de Marfan corren un riesgo significativo de disección aórtica, que suele ser mortal incluso cuando se trata rápidamente. Las mujeres con síndrome de Marfan, entonces, deben recibir una evaluación exhaustiva antes de la concepción y se debe realizar una ecocardiografía cada seis a 10 semanas durante el embarazo para evaluar el diámetro de la raíz aórtica. Para la mayoría de las mujeres, el parto vaginal seguro es posible.
Se pueden realizar pruebas prenatales en mujeres con síndrome de Marfan para determinar si la afección se ha heredado en su hijo. A las 10 a 12 semanas de embarazo, se puede realizar un examen de un trozo de tejido placentario a través de una prueba llamada muestreo de vellosidades coriónicas para hacer un diagnóstico. Se puede realizar otra prueba prenatal llamada amniocentesis a las 16 a 18 semanas de embarazo.
El síndrome de Marfan se expresa de forma dominante. Esto significa que un niño con uno de los padres portador del gen tiene un 50% de probabilidad de contraer el síndrome. En 1996, se realizó la primera terapia de prueba genética preimplantacional (PGT) para Marfan; en esencia, PGT significa realizar una prueba genética en células embrionarias de FIV en etapa temprana y descartar los embriones afectados por la mutación de Marfan.
Pronóstico
Antes de las modernas técnicas quirúrgicas cardiovasculares y medicamentos como losartán y metoprolol, el pronóstico de las personas con síndrome de Marfan no era bueno: era común una variedad de problemas cardiovasculares intratables. La esperanza de vida se redujo en al menos un tercio, y muchos murieron en la adolescencia o en la veintena debido a problemas cardiovasculares. Hoy en día, los síntomas cardiovasculares del síndrome de Marfan siguen siendo los problemas más importantes en el diagnóstico y el tratamiento de la enfermedad, pero el control y la terapia profilácticos adecuados ofrecen algo que se aproxima a una esperanza de vida normal, y se están descubriendo más manifestaciones de la enfermedad a medida que más pacientes viven más tiempo. Las mujeres con síndrome de Marfan viven más que los hombres.
Epidemiología
El síndrome de Marfan afecta a hombres y mujeres por igual, y la mutación no muestra sesgos étnicos o geográficos. Las estimaciones indican que alrededor de 1 de cada 5000 a 10 000 personas tienen el síndrome de Marfan.
Historia
El síndrome de Marfan lleva el nombre de Antoine Marfan, el pediatra francés que describió por primera vez la afección en 1896 después de notar características llamativas en una niña de cinco años. El gen relacionado con la enfermedad fue identificado por primera vez por Francesco Ramírez en el Centro Médico Mount Sinai en la ciudad de Nueva York en 1991.
Pacientes famosos
Las personas famosas que han tenido el síndrome de Marfan incluyen:
- Isaías Austin
- Javier Botet
- Austin Carlile
- Bradford Cox
- Euell Gibbons
- Flo Hyman
- Jonathan Jeanne
- Vincent Schiavelli
- Troye Sivan
- John Tavener
Además, las siguientes figuras históricas y celebridades a menudo aparecen en las listas de personas con síndrome de Marfan, pero de un caso a otro la evidencia es especulativa, cuestionable o incluso refutada.
- Akhenaton (Las representaciones artísticas muestran muchas características físicas de las personas con Marfan, como el cráneo alargado y pelvis más grande con muslos agrandados y terneros espinosos. La mayoría de los egipcios a partir de 2021 argumentan que las representaciones de Akhenaton no son los resultados de una condición genética o médica, sino que deben interpretarse como representaciones estilizadas influenciadas por el atenismo.)
- Osama bin Laden (los rumores de Marfan se consideran "sólo falsos" por los periodistas)
- Julio César (especietario)
- Robert Johnson (especulado)
- Jonathan Larson (especulado)
- Abraham Lincoln (diagnóstico especulativo discutido) El ADN de Lincoln no ha sido probado)
- Niccolò Paganini (especulado)
- Michael Phelps (disputado por Phelps)
- Sergei Rachmaninoff (disputado: "Rachmaninov no mostró claramente ninguna de las otras características clínicas típicas de Marfan... Tampoco expresó ninguno de los efectos clínicos de un síndrome relacionado con Marfan")
- Tutankhamen (no tenía síndrome de Marfan)
Contenido relacionado
Flunitrazepam
Clamidia
Alfonso María Jakob