Sinapsis química

Las sinapsis químicas son uniones biológicas a través de las cuales las neuronas' las señales pueden enviarse entre sí y a células no neuronales, como las de los músculos o las glándulas. Las sinapsis químicas permiten que las neuronas formen circuitos dentro del sistema nervioso central. Son cruciales para los cálculos biológicos que subyacen a la percepción y el pensamiento. Permiten que el sistema nervioso se conecte y controle otros sistemas del cuerpo.
En una sinapsis química, una neurona libera moléculas de neurotransmisores en un pequeño espacio (la hendidura sináptica) adyacente a otra neurona. Los neurotransmisores están contenidos dentro de pequeños sacos llamados vesículas sinápticas y se liberan en la hendidura sináptica por exocitosis. Estas moléculas luego se unen a los receptores de neurotransmisores en la célula postsináptica. Finalmente, los neurotransmisores se eliminan de la sinapsis a través de uno de varios mecanismos potenciales que incluyen la degradación enzimática o la recaptación por transportadores específicos en la célula presináptica o en alguna otra neuroglia para terminar la acción del neurotransmisor.
Se estima que el cerebro humano adulto contiene de 1014 a 5 × 1014 (100–500 billones) de sinapsis. Cada milímetro cúbico de la corteza cerebral contiene aproximadamente mil millones (escala corta, es decir, 109) de ellos. El número de sinapsis en la corteza cerebral humana se ha estimado por separado en 0,15 cuatrillones (150 billones)
La palabra "sinapsis" fue introducido por Sir Charles Scott Sherrington en 1897. Las sinapsis químicas no son el único tipo de sinapsis biológica: también existen sinapsis eléctricas e inmunológicas. Sin embargo, sin un calificador, "synapse" comúnmente se refiere a la sinapsis química.
Estructura
Las sinapsis son conexiones funcionales entre neuronas, o entre neuronas y otros tipos de células. Una neurona típica genera varios miles de sinapsis, aunque hay algunos tipos que generan muchas menos. La mayoría de las sinapsis conectan los axones con las dendritas, pero también existen otros tipos de conexiones, incluidas las de axón a cuerpo celular, de axón a axón y de dendrita a dendrita. Las sinapsis son generalmente demasiado pequeñas para ser reconocibles usando un microscopio óptico, excepto como puntos donde las membranas de dos células parecen tocarse, pero sus elementos celulares pueden visualizarse claramente usando un microscopio electrónico.
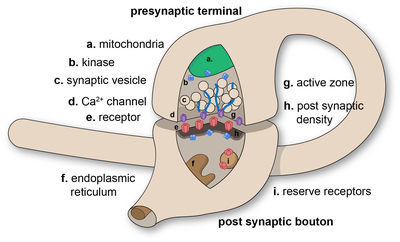
Las sinapsis químicas transmiten información direccionalmente desde una célula presináptica a una célula postsináptica y, por lo tanto, son asimétricas en estructura y función. La terminal del axón presináptico, o bouton sináptico, es un área especializada dentro del axón de la célula presináptica que contiene neurotransmisores encerrados en pequeñas esferas unidas a la membrana llamadas vesículas sinápticas. (así como una serie de otras estructuras de soporte y orgánulos, como las mitocondrias y el retículo endoplásmico). Las vesículas sinápticas se acoplan a la membrana plasmática presináptica en regiones denominadas zonas activas.
Inmediatamente enfrente hay una región de la célula postsináptica que contiene receptores de neurotransmisores; para las sinapsis entre dos neuronas, la región postsináptica se puede encontrar en las dendritas o en el cuerpo celular. Inmediatamente detrás de la membrana postsináptica hay un elaborado complejo de proteínas interconectadas llamado densidad postsináptica (PSD).
Las proteínas en el PSD participan en el anclaje y el tráfico de los receptores de neurotransmisores y en la modulación de la actividad de estos receptores. Los receptores y PSD a menudo se encuentran en protuberancias especializadas del eje dendrítico principal llamadas espinas dendríticas.
Las sinapsis se pueden describir como simétricas o asimétricas. Cuando se examinan bajo un microscopio electrónico, las sinapsis asimétricas se caracterizan por vesículas redondeadas en la célula presináptica y una densidad postsináptica prominente. Las sinapsis asimétricas suelen ser excitatorias. Las sinapsis simétricas, por el contrario, tienen vesículas aplanadas o alargadas y no contienen una densidad postsináptica prominente. Las sinapsis simétricas suelen ser inhibitorias.
La hendidura sináptica —también llamada brecha sináptica— es una brecha entre las células presinápticas y postsinápticas de unos 20 nm (0,02 μ) de ancho. El pequeño volumen de la hendidura permite que la concentración de neurotransmisores aumente y disminuya rápidamente.
Una autapsis es una sinapsis química (o eléctrica) que se forma cuando el axón de una neurona hace sinapsis con sus propias dendritas.
Señalización en sinapsis químicas
Resumen
Este es un resumen de la secuencia de eventos que tienen lugar en la transmisión sináptica desde una neurona presináptica a una célula postsináptica. Cada paso se explica con más detalle a continuación. Tenga en cuenta que, con la excepción del paso final, todo el proceso puede ejecutarse solo unos pocos cientos de microsegundos, en las sinapsis más rápidas.
- El proceso comienza con una ola de excitación electroquímica llamada potencial de acción que viaja a lo largo de la membrana de la célula presintáptica, hasta que alcanza la sinapsis.
- La despolarización eléctrica de la membrana en la sinapsis hace que los canales se abran que son permeables a los iones de calcio.
- Los iones de calcio fluyen a través de la membrana presintáptica, aumentando rápidamente la concentración de calcio en el interior.
- La alta concentración de calcio activa un conjunto de proteínas sensibles al calcio adheridas a las vesículas que contienen un neurotransmisor químico.
- Estas proteínas cambian de forma, provocando que las membranas de algunas vesículas "heredadas" se fusionen con la membrana de la célula presintáptica, abriendo así las vesículas y volcando su contenido de neurotransmisor en la hendidura sináptica, el espacio estrecho entre las membranas de las células pre- y postnápticas.
- El neurotransmisor se difunde dentro de la hendidura. Algunas de ellas escapan, pero algunas de ellas se unen a moléculas de receptores químicos ubicadas en la membrana de la célula postináptica.
- La unión del neurotransmisor hace que la molécula del receptor sea activado de alguna manera. Varios tipos de activación son posibles, como se describe en más detalle a continuación. En cualquier caso, este es el paso clave por el cual el proceso sináptico afecta el comportamiento de la célula postináptica.
- Debido a la vibración térmica, el movimiento de los átomos, vibrando sobre sus posiciones de equilibrio en un sólido cristalino, las moléculas de neurotransmisor eventualmente se desflojan de los receptores y se alejan de la deriva.
- El neurotransmisor es reabsorbido por la célula presinoptica, y luego reempaquetado para la futura liberación, o de lo contrario se descompone metabólicamente.
Liberación de neurotransmisores
La liberación de un neurotransmisor se desencadena por la llegada de un impulso nervioso (o potencial de acción) y ocurre a través de un proceso inusualmente rápido de secreción celular (exocitosis). Dentro de la terminal nerviosa presináptica, las vesículas que contienen neurotransmisores se localizan cerca de la membrana sináptica. El potencial de acción que llega produce una afluencia de iones de calcio a través de canales iónicos selectivos de calcio dependientes de voltaje en la carrera descendente del potencial de acción (corriente de cola). Luego, los iones de calcio se unen a las proteínas sinaptotagmina que se encuentran dentro de las membranas de las vesículas sinápticas, lo que permite que las vesículas se fusionen con la membrana presináptica. La fusión de una vesícula es un proceso estocástico que conduce a fallas frecuentes en la transmisión sináptica en las sinapsis muy pequeñas que son típicas del sistema nervioso central. Las sinapsis químicas grandes (por ejemplo, la unión neuromuscular), por otro lado, tienen una probabilidad de liberación sináptica, en efecto, de 1. La fusión de vesículas está impulsada por la acción de un conjunto de proteínas en el terminal presináptico conocido como SNARE. En su conjunto, el complejo proteico o estructura que interviene en el acoplamiento y la fusión de las vesículas presinápticas se denomina zona activa. La membrana agregada por el proceso de fusión se recupera más tarde por endocitosis y se recicla para la formación de vesículas frescas llenas de neurotransmisores.
Una excepción a la tendencia general de liberación de neurotransmisores por fusión vesicular se encuentra en las células receptoras de tipo II de las papilas gustativas de los mamíferos. Aquí, el neurotransmisor ATP se libera directamente desde el citoplasma hacia la hendidura sináptica a través de canales dependientes de voltaje.
Unión de receptores
Los receptores en el lado opuesto de la brecha sináptica unen moléculas de neurotransmisores. Los receptores pueden responder de dos formas generales. En primer lugar, los receptores pueden abrir directamente canales iónicos controlados por ligandos en la membrana celular postsináptica, lo que hace que los iones entren o salgan de la célula y cambien el potencial transmembrana local. El cambio de voltaje resultante se denomina potencial postsináptico. En general, el resultado es excitador en el caso de corrientes despolarizantes, e inhibidor en el caso de corrientes hiperpolarizantes. Que una sinapsis sea excitadora o inhibidora depende de qué tipo(s) de canal iónico conduce(n) la(s) corriente(s) postsináptica(s), que a su vez es una función del tipo de receptores y neurotransmisores empleados en la sinapsis. La segunda forma en que un receptor puede afectar el potencial de membrana es modulando la producción de mensajeros químicos dentro de la neurona postsináptica. Estos segundos mensajeros pueden amplificar la respuesta inhibitoria o excitatoria a los neurotransmisores.
Terminación
Después de que una molécula de neurotransmisor se une a una molécula receptora, debe eliminarse para permitir que la membrana postsináptica continúe retransmitiendo los EPSP o IPSP posteriores. Esta eliminación puede ocurrir a través de uno o más procesos:
- El neurotransmisor puede difusarse debido a las oscilaciones inducidas térmicamente tanto de él como del receptor, haciendo que esté disponible para ser descompuesto metabólicamente fuera de la neurona o para ser reabsorbido.
- Las enzimas dentro de la membrana subsinoptica pueden inactivar/metabolizar el neurotransmisor.
- Las bombas de recaptación pueden bombear activamente el neurotransmisor de nuevo en la terminal de axón presicáptico para reprocesamiento y liberación después de un potencial de acción posterior.
Fuerza sináptica
La fuerza de una sinapsis ha sido definida por Sir Bernard Katz como el producto de la probabilidad de liberación (presináptica) pr, el tamaño cuántico q (la respuesta postsináptica a la liberación de una sola vesícula de neurotransmisor, un 'cuántico'), y n, el número de sitios de liberación. "Conexión unitaria" por lo general se refiere a un número desconocido de sinapsis individuales que conectan una neurona presináptica con una neurona postsináptica. La amplitud de los potenciales postsinápticos (PSP) puede ser tan baja como 0,4 mV hasta 20 mV. La amplitud de un PSP puede ser modulada por neuromoduladores o puede cambiar como resultado de una actividad previa. Los cambios en la fuerza sináptica pueden ser a corto plazo, con una duración de segundos a minutos, o a largo plazo (potenciación a largo plazo o LTP), con una duración de horas. Se cree que el aprendizaje y la memoria resultan de cambios a largo plazo en la fuerza sináptica, a través de un mecanismo conocido como plasticidad sináptica.
Desensibilización de receptores
La desensibilización de los receptores postsinápticos es una disminución en la respuesta al mismo estímulo del neurotransmisor. Significa que, en efecto, la fuerza de una sinapsis puede disminuir a medida que un tren de potenciales de acción llega en rápida sucesión, un fenómeno que da lugar a la denominada dependencia de frecuencia de las sinapsis. El sistema nervioso explota esta propiedad con fines computacionales y puede sintonizar sus sinapsis a través de medios tales como la fosforilación de las proteínas involucradas.
Plasticidad sináptica
La transmisión sináptica puede cambiar por actividad previa. Estos cambios se denominan plasticidad sináptica y pueden provocar una disminución de la eficacia de la sinapsis, denominada depresión, o un aumento de la eficacia, denominado potenciación. Estos cambios pueden ser a largo o corto plazo. Las formas de plasticidad a corto plazo incluyen fatiga o depresión sináptica y aumento sináptico. Las formas de plasticidad a largo plazo incluyen la depresión a largo plazo y la potenciación a largo plazo. La plasticidad sináptica puede ser homosináptica (que ocurre en una sola sinapsis) o heterosináptica (que ocurre en múltiples sinapsis).
Plasticidad homosináptica
La plasticidad homosináptica (o también modulación homotrópica) es un cambio en la fuerza sináptica que resulta de la historia de actividad en una sinapsis particular. Esto puede deberse a cambios en el calcio presináptico, así como a la retroalimentación sobre los receptores presinápticos, es decir, una forma de señalización autocrina. La plasticidad homosináptica puede afectar el número y la tasa de reposición de vesículas o puede afectar la relación entre el calcio y la liberación de vesículas. La plasticidad homosináptica también puede ser de naturaleza postsináptica. Puede resultar en un aumento o disminución de la fuerza sináptica.
Un ejemplo son las neuronas del sistema nervioso simpático (SNS), que liberan noradrenalina que, además de afectar a los receptores postsinápticos, también afecta a los receptores adrenérgicos α2 presinápticos, lo que inhibe la liberación de noradrenalina. Este efecto se utiliza con la clonidina para realizar efectos inhibidores en el SNS.
Plasticidad heterosináptica
La plasticidad heterosináptica (o también modulación heterotrópica) es un cambio en la fuerza sináptica que resulta de la actividad de otras neuronas. Nuevamente, la plasticidad puede alterar el número de vesículas o su tasa de reposición o la relación entre el calcio y la liberación de vesículas. Además, podría afectar directamente la entrada de calcio. La plasticidad heterosináptica también puede ser de naturaleza postsináptica, lo que afecta la sensibilidad del receptor.
Un ejemplo son nuevamente las neuronas del sistema nervioso simpático, que liberan noradrenalina, la cual, además, genera un efecto inhibitorio sobre las terminales presinápticas de las neuronas del sistema nervioso parasimpático.
Integración de entradas sinápticas
En general, si una sinapsis excitatoria es lo suficientemente fuerte, un potencial de acción en la neurona presináptica desencadenará un potencial de acción en la célula postsináptica. En muchos casos, el potencial postsináptico excitatorio (EPSP) no alcanzará el umbral para provocar un potencial de acción. Cuando los potenciales de acción de múltiples neuronas presinápticas se disparan simultáneamente, o si una sola neurona presináptica se dispara a una frecuencia lo suficientemente alta, los EPSP pueden superponerse y sumarse. Si se superponen suficientes EPSP, el EPSP sumado puede alcanzar el umbral para iniciar un potencial de acción. Este proceso se conoce como suma y puede servir como un filtro de paso alto para las neuronas.
Por otro lado, una neurona presináptica que libera un neurotransmisor inhibidor, como GABA, puede causar un potencial postsináptico inhibidor (IPSP) en la neurona postsináptica, alejando el potencial de membrana del umbral, disminuyendo su excitabilidad y haciéndolo más difícil para la neurona iniciar un potencial de acción. Si un IPSP se superpone con un EPSP, el IPSP puede en muchos casos evitar que la neurona dispare un potencial de acción. De esta manera, la salida de una neurona puede depender de la entrada de muchas neuronas diferentes, cada una de las cuales puede tener un grado diferente de influencia, según la fuerza y el tipo de sinapsis con esa neurona. John Carew Eccles realizó algunos de los primeros experimentos importantes sobre integración sináptica, por los que recibió el Premio Nobel de Fisiología o Medicina en 1963.
Transmisión de volumen
Cuando se libera un neurotransmisor en una sinapsis, alcanza su concentración más alta dentro del estrecho espacio de la hendidura sináptica, pero es seguro que parte de él se difundirá antes de ser reabsorbido o descompuesto. Si se difunde, tiene el potencial de activar receptores que están ubicados en otras sinapsis o en la membrana lejos de cualquier sinapsis. La actividad extrasináptica de un neurotransmisor se conoce como transmisión de volumen. Está bien establecido que tales efectos ocurren hasta cierto punto, pero su importancia funcional ha sido motivo de controversia durante mucho tiempo.
Un trabajo reciente indica que la transmisión de volumen puede ser el modo predominante de interacción para algunos tipos especiales de neuronas. En la corteza cerebral de los mamíferos, una clase de neuronas llamadas células neurogliaformes pueden inhibir otras neuronas corticales cercanas al liberar el neurotransmisor GABA en el espacio extracelular. Del mismo modo, el GABA liberado de las células neurogliaformes en el espacio extracelular también actúa sobre los astrocitos circundantes, asignando un papel a la transmisión de volumen en el control de la homeostasis iónica y de los neurotransmisores. Aproximadamente el 78% de los botones de células neurogliaformes no forman sinapsis clásicas. Este puede ser el primer ejemplo definitivo de neuronas que se comunican químicamente donde las sinapsis clásicas no están presentes.
Relación con las sinapsis eléctricas
Una sinapsis eléctrica es un enlace conductor de electricidad entre dos neuronas contiguas que se forma en un estrecho espacio entre las células presinápticas y postsinápticas, lo que se conoce como unión comunicante. En las uniones comunicantes, las células se acercan a unos 3,5 nm entre sí, en lugar de la distancia de 20 a 40 nm que separa las células en las sinapsis químicas. A diferencia de las sinapsis químicas, el potencial postsináptico en las sinapsis eléctricas no está causado por la apertura de canales iónicos por transmisores químicos, sino por el acoplamiento eléctrico directo entre ambas neuronas. Las sinapsis eléctricas son más rápidas que las sinapsis químicas. Las sinapsis eléctricas se encuentran en todo el sistema nervioso, incluso en la retina, el núcleo reticular del tálamo, la neocorteza y el hipocampo. Mientras que las sinapsis químicas se encuentran entre las neuronas excitatorias e inhibidoras, las sinapsis eléctricas se encuentran más comúnmente entre las neuronas inhibidoras locales más pequeñas. Las sinapsis eléctricas pueden existir entre dos axones, dos dendritas o entre un axón y una dendrita. En algunos peces y anfibios, las sinapsis eléctricas se pueden encontrar dentro de la misma terminal de una sinapsis química, como en las células de Mauthner.
Efectos de las drogas
Una de las características más importantes de las sinapsis químicas es que son el sitio de acción de la mayoría de las drogas psicoactivas. Las sinapsis se ven afectadas por drogas como el curare, la estricnina, la cocaína, la morfina, el alcohol, el LSD y muchas otras. Estos fármacos tienen diferentes efectos sobre la función sináptica y, a menudo, se limitan a las sinapsis que utilizan un neurotransmisor específico. Por ejemplo, el curare es un veneno que impide que la acetilcolina despolarice la membrana postsináptica, causando parálisis. La estricnina bloquea los efectos inhibitorios del neurotransmisor glicina, lo que hace que el cuerpo capte y reaccione a estímulos más débiles y previamente ignorados, lo que resulta en espasmos musculares incontrolables. La morfina actúa sobre las sinapsis que utilizan neurotransmisores de endorfina, y el alcohol aumenta los efectos inhibidores del neurotransmisor GABA. El LSD interfiere con las sinapsis que utilizan el neurotransmisor serotonina. La cocaína bloquea la recaptación de dopamina y por lo tanto aumenta sus efectos.
Historia y etimología
Durante la década de 1950, Bernard Katz y Paul Fatt observaron corrientes sinápticas espontáneas en miniatura en la unión neuromuscular de la rana. Con base en estas observaciones, desarrollaron la 'hipótesis cuántica' esa es la base de nuestra comprensión actual de la liberación de neurotransmisores como exocitosis y por la cual Katz recibió el Premio Nobel de Fisiología o Medicina en 1970. A fines de la década de 1960, Ricardo Miledi y Katz propusieron la hipótesis de que la entrada de iones de calcio inducida por la despolarización desencadena la exocitosis..
Sir Charles Scott Sherringtonin acuñó la palabra 'sinapsis' y la historia de la palabra fue dada por Sherrington en una carta que le escribió a John Fulton:
' Sentí la necesidad de un nombre para llamar la unión entre la célula nerviosa y la célula nerviosa... Sugerí usar "sindesmos"... Él [ Sir Michael Foster ] consultó a su amigo de la Trinidad Verrall, el erudito de Euripidean, sobre él, y Verrall sugirió "synapse" (del griego "clasp"). Charles Scott Sherrington
Contenido relacionado
Fenética
Láudano
Naturaleza versus crianza