Serina
Serine (símbolo Ser o S) es un α-aminoácido que se utiliza en la biosíntesis de proteínas. Contiene un grupo α-amino (que está en el protonado −NH+
3 bajo condiciones biológicas), un grupo carboxilo (que está en el desprotonado −COO−
bajo condiciones biológicas), y una cadena lateral que consiste en un grupo hidroximetilo, clasificándolo como un aminoácido polar. Se puede sintetizar en el cuerpo humano en circunstancias fisiológicas normales, lo que lo convierte en un aminoácido no esencial. Está codificado por los codones UCU, UCC, UCA, UCG, AGU y AGC.
Ocurrencia
Este compuesto es uno de los aminoácidos proteinogénicos naturales. Solo el estereoisómero L aparece de forma natural en las proteínas. No es esencial para la dieta humana, ya que se sintetiza en el cuerpo a partir de otros metabolitos, incluida la glicina. La serina se obtuvo por primera vez de la proteína de la seda, una fuente particularmente rica, en 1865 por Emil Cramer. Su nombre se deriva del latín para seda, sericum. La estructura de Serine se estableció en 1902. Las fuentes de alimentos con alto contenido de L-Serine entre sus proteínas incluyen huevos, edamame, cordero, hígado, cerdo, salmón, sardinas, algas, tofu.
Biosíntesis
La biosíntesis de la serina comienza con la oxidación del 3-fosfoglicerato (un intermediario de la glucólisis) a 3-fosfohidroxipiruvato y NADH por la fosfoglicerato deshidrogenasa (EC 1.1.1.95). La aminación reductora (transaminación) de esta cetona por la fosfoserina transaminasa (EC 2.6.1.52) produce 3-fosfoserina (O-fosfoserina) que es hidrolizada a serina por la fosfoserina fosfatasa (EC 3.1.3.3).
En bacterias como E. coli, estas enzimas están codificadas por los genes serA (EC 1.1.1.95), serC (EC 2.6.1.52) y serB (EC 3.1.3.3).
Biosíntesis de glicina: la serina hidroximetiltransferasa (SHMT = serina transhidroximetilasa) también cataliza las conversiones reversibles de L-serina en glicina (escisión retro-aldol) y 5,6, 7,8-tetrahidrofolato a 5,10-metilentetrahidrofolato (mTHF) (hidrólisis). SHMT es una enzima dependiente de piridoxal fosfato (PLP). La glicina también se puede formar a partir de CO2, NH+
4, y mTHF en una reacción catalizada por la glicina sintasa.
Síntesis y producción industrial
Industrialmente, la L-serina se produce a partir de glicina y metanol catalizada por hidroximetiltransferasa.
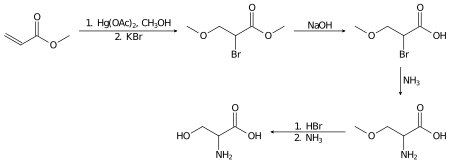
La serina racémica se puede preparar en el laboratorio a partir de acrilato de metilo en varios pasos:
Función biológica
Metabólica
La serina es importante en el metabolismo ya que participa en la biosíntesis de purinas y pirimidinas. Es el precursor de varios aminoácidos, incluidos la glicina y la cisteína, así como el triptófano en las bacterias. También es el precursor de muchos otros metabolitos, incluidos los esfingolípidos y el folato, que es el principal donante de fragmentos de un carbono en la biosíntesis.
Señalización
LaD-serina, sintetizada en las neuronas por la serina racemasa a partir de la L-serina (su enantiómero), sirve como neuromodulador al coactivar los receptores NMDA, haciéndolos capaces de abrir si luego también se unen al glutamato. La D-serina es un potente agonista en el sitio de la glicina (NR1) del receptor de glutamato de tipo NMDA (NMDAR). Para que el receptor se abra, el glutamato y la glicina o la D-serina deben unirse a él; además, no se debe unir un bloqueador de poros (p. ej., Mg2+ o Zn2+). De hecho, la D-serina es un agonista más potente en el sitio de la glicina en el NMDAR que la propia glicina.
Se pensaba que laD-serina existía solo en bacterias hasta hace relativamente poco tiempo; fue el segundo aminoácido D que se descubrió que existe naturalmente en los humanos, presente como una molécula de señalización en el cerebro, poco después del descubrimiento del D-aspartato. Si los aminoácidos D se hubieran descubierto antes en humanos, el sitio de glicina en el receptor NMDA podría llamarse sitio D-serina. Además del sistema nervioso central, la D-serina desempeña un papel de señalización en los tejidos y órganos periféricos, como el cartílago, el riñón y el cuerpo cavernoso.
Sensación gustativa
La D-serina pura es un polvo cristalino blanquecino con un ligero aroma a humedad. D-Serine es dulce con un ligero sabor agrio adicional en concentraciones medias y altas.
Importancia clínica
Los trastornos por deficiencia de serina son defectos raros en la biosíntesis del aminoácido L-serina. En la actualidad se han reportado tres trastornos:
- 3-fosfoglycerate dehydrogenase deficiencia
- 3-fosfoserina deficiencia de fosfatasa
- Deficiencia de fosfoserina aminotransferasa
Estos defectos enzimáticos provocan síntomas neurológicos graves, como microcefalia congénita y retraso psicomotor grave y, además, en pacientes con deficiencia de 3-fosfoglicerato deshidrogenasa, convulsiones intratables. Estos síntomas responden en grado variable al tratamiento con L-serina, a veces combinada con glicina. La respuesta al tratamiento es variable y se desconoce el resultado funcional y a largo plazo. Para proporcionar una base para mejorar la comprensión de la epidemiología, la correlación genotipo/fenotipo y el resultado de estas enfermedades, su impacto en la calidad de vida de los pacientes, así como para evaluar las estrategias diagnósticas y terapéuticas, se estableció un registro de pacientes por parte de la organización no comercial International Working Grupo de Trastornos Relacionados con Neurotransmisores (iNTD).
Además de la interrupción de la biosíntesis de serina, su transporte también puede verse afectado. Un ejemplo es la tetraplejía espástica, el cuerpo calloso delgado y la microcefalia progresiva, una enfermedad causada por mutaciones que afectan la función del transportador de aminoácidos neutros A.
Investigación para uso terapéutico
La clasificación de la L-serina como un aminoácido no esencial se considera condicional, ya que los vertebrados, como los humanos, no siempre pueden sintetizar cantidades óptimas durante toda la vida. La seguridad de L-serine se ha demostrado en un ensayo clínico de fase I en humanos aprobado por la FDA con pacientes con esclerosis lateral amiotrófica, ALS (ClinicalTrials.gov identificador: NCT01835782), pero el tratamiento de los síntomas de ALS aún no se ha realizado. ser mostrado. Un metanálisis de 2011 encontró que la sarcosina adyuvante tiene un tamaño de efecto medio para los síntomas negativos y totales de la esquizofrenia. También hay pruebas de que la L‐serina podría adquirir una función terapéutica en la diabetes.
D-Serine se está estudiando en roedores como posible tratamiento para la esquizofrenia. La D-serina también se ha descrito como un biomarcador potencial para el diagnóstico temprano de la enfermedad de Alzheimer (EA), debido a una concentración relativamente alta de la misma en el líquido cefalorraquídeo de pacientes con probable EA.
D-Serine se ha teorizado como un tratamiento potencial para los trastornos auditivos neurosensoriales, como la pérdida auditiva y el tinnitus.
Contenido relacionado
Olfato (pescado)
Silvicultura
Cartilla (biología molecular)