Salinidad
Salinidad() es la salinidad o cantidad de sal disuelta en una masa de agua, denominada agua salina (ver también salinidad del suelo). Suele medirse en g/L o g/kg (gramos de sal por litro/kilogramo de agua; este último es adimensional e igual a ‰).
La salinidad es un factor importante para determinar muchos aspectos de la química de las aguas naturales y de los procesos biológicos dentro de ellas, y es una variable de estado termodinámico que, junto con la temperatura y la presión, gobierna características físicas como la densidad y la capacidad calorífica del agua. agua.
Una línea de contorno de salinidad constante se llama isohalina, oa veces isohale.
Definiciones
La salinidad en ríos, lagos y océanos es conceptualmente simple, pero técnicamente difícil de definir y medir con precisión. Conceptualmente la salinidad es la cantidad de sales disueltas contenidas en el agua. Las sales son compuestos como el cloruro de sodio, el sulfato de magnesio, el nitrato de potasio y el bicarbonato de sodio que se disuelven en iones. La concentración de iones de cloruro disueltos a veces se denomina clorinidad. Operacionalmente, la materia disuelta se define como aquella que puede pasar a través de un filtro muy fino (históricamente un filtro con un tamaño de poro de 0,45 μm, pero hoy en día suele ser de 0,2 μm). La salinidad se puede expresar en forma de fracción de masa, es decir, la masa del material disuelto en una unidad de masa de solución.
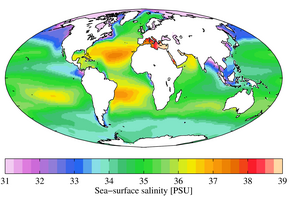
El agua de mar normalmente tiene una salinidad total de alrededor de 35 g/kg, aunque los valores más bajos son típicos cerca de las costas donde los ríos desembocan en el océano. Los ríos y lagos pueden tener una amplia gama de salinidades, desde menos de 0,01 g/kg hasta unos pocos g/kg, aunque hay muchos lugares donde se encuentran salinidades más altas. El Mar Muerto tiene una salinidad de más de 200 g/kg. La precipitación normalmente tiene un TDS de 20 mg/kg o menos.
Cualquiera que sea el tamaño de poro que se utilice en la definición, el valor de salinidad resultante de una muestra dada de agua natural no variará en más de un pequeño porcentaje (%). Los oceanógrafos físicos que trabajan en el océano abisal, sin embargo, a menudo se preocupan por la precisión y la intercomparabilidad de las mediciones realizadas por diferentes investigadores, en diferentes momentos, hasta casi cinco dígitos significativos. Los oceanógrafos utilizan un producto de agua de mar embotellada conocido como IAPSO Standard Seawater para estandarizar sus mediciones con suficiente precisión para cumplir con este requisito.
Composición
Las dificultades de medición y definición surgen porque las aguas naturales contienen una mezcla compleja de muchos elementos diferentes de diferentes fuentes (no todos de sales disueltas) en diferentes formas moleculares. Las propiedades químicas de algunas de estas formas dependen de la temperatura y la presión. Muchas de estas formas son difíciles de medir con alta precisión y, en cualquier caso, el análisis químico completo no es práctico cuando se analizan múltiples muestras. Diferentes definiciones prácticas de salinidad resultan de diferentes intentos de dar cuenta de estos problemas, con diferentes niveles de precisión, sin dejar de ser razonablemente fáciles de usar.
Por razones prácticas, la salinidad generalmente se relaciona con la suma de masas de un subconjunto de estos constituyentes químicos disueltos (la llamada salinidad de la solución), en lugar de la masa desconocida de sales que dio lugar a esta composición (una excepción es cuando se crea agua de mar artificial). Para muchos propósitos, esta suma puede limitarse a un conjunto de ocho iones principales en aguas naturales, aunque para el agua de mar con la mayor precisión también se incluyen siete iones secundarios adicionales. Los iones principales dominan la composición inorgánica de la mayoría (pero no de todas) las aguas naturales. Las excepciones incluyen algunos lagos de pozo y aguas de algunos manantiales hidrotermales.
Las concentraciones de gases disueltos como el oxígeno y el nitrógeno no suelen incluirse en las descripciones de la salinidad. Sin embargo, a menudo se incluye el gas dióxido de carbono, que cuando se disuelve se convierte parcialmente en carbonatos y bicarbonatos. El silicio en forma de ácido silícico, que suele aparecer como una molécula neutra en el rango de pH de la mayoría de las aguas naturales, también se puede incluir para algunos fines (p. ej., cuando se investigan las relaciones entre salinidad y densidad).
Agua de mar
El término 'salinidad' es, para los oceanógrafos, generalmente asociado con un conjunto de técnicas de medición específicas. A medida que evolucionan las técnicas dominantes, también lo hacen las diferentes descripciones de la salinidad. Las salinidades se midieron en gran medida utilizando técnicas basadas en titulación antes de la década de 1980. La titulación con nitrato de plata podría usarse para determinar la concentración de iones de haluro (principalmente cloro y bromo) para dar una clorinidad. Luego, la clorinidad se multiplicó por un factor para tener en cuenta todos los demás constituyentes. Las 'salinidades de Knudsen' se expresan en unidades de partes por mil (ppt o ‰).
El uso de medidas de conductividad eléctrica para estimar el contenido iónico del agua de mar condujo al desarrollo de la escala denominada escala práctica de salinidad de 1978 (PSS-78). Las salinidades medidas con PSS-78 no tienen unidades. El sufijo psu o PSU (que indica unidad práctica de salinidad) es a veces se agrega a los valores de medición de PSS-78. La adición de PSU como una unidad después del valor es "formalmente incorrecta y totalmente desaconsejada".
En 2010, se introdujo un nuevo estándar para las propiedades del agua de mar llamado ecuación termodinámica del agua de mar 2010 (TEOS-10), que aboga por la salinidad absoluta como reemplazo de la salinidad práctica y la temperatura conservadora como sustitución de la temperatura potencial. Este estándar incluye una nueva escala llamada escala de salinidad de composición de referencia. Las salinidades absolutas en esta escala se expresan como una fracción de masa, en gramos por kilogramo de solución. Las salinidades en esta escala se determinan mediante la combinación de mediciones de conductividad eléctrica con otra información que puede explicar los cambios regionales en la composición del agua de mar. También se pueden determinar haciendo mediciones directas de densidad.
Una muestra de agua de mar de la mayoría de los lugares con una clorinidad de 19,37 ppt tendrá una salinidad Knudsen de 35,00 ppt, una salinidad práctica de PSS-78 de aproximadamente 35,0 y una salinidad absoluta de TEOS-10 de aproximadamente 35,2 g/kg. La conductividad eléctrica de esta agua a una temperatura de 15 °C es de 42,9 mS/cm.
A escala global, es muy probable que el cambio climático causado por el hombre haya contribuido a los cambios observados en la salinidad de la superficie y el subsuelo desde la década de 1950, y las proyecciones de los cambios en la salinidad de la superficie a lo largo del siglo XXI indican que las regiones de océanos frescos seguirán recibiendo las regiones más frescas y saladas seguirán haciéndose más saladas.
Lagos y ríos
Los limnólogos y químicos a menudo definen la salinidad en términos de masa de sal por unidad de volumen, expresada en unidades de mg/L o g/L. Se da a entender, aunque a menudo no se indica, que este valor se aplica con precisión solo a alguna temperatura de referencia porque el volumen de la solución varía con la temperatura. Los valores presentados de esta manera suelen tener una precisión del orden del 1%. Los limnólogos también utilizan la conductividad eléctrica, o "conductividad de referencia", como indicador de la salinidad. Esta medida puede corregirse por los efectos de la temperatura y, por lo general, se expresa en unidades de μS/cm.
El agua de un río o lago con una salinidad de alrededor de 70 mg/L normalmente tendrá una conductividad específica a 25 °C de entre 80 y 130 μS/cm. La proporción real depende de los iones presentes. La conductividad real suele cambiar aproximadamente un 2 % por grado Celsius, por lo que la conductividad medida a 5 °C podría estar solo en el rango de 50 a 80 μS/cm.
Las mediciones directas de densidad también se utilizan para estimar la salinidad, particularmente en lagos altamente salinos. A veces, la densidad a una temperatura específica se utiliza como indicador de la salinidad. En otras ocasiones, se utiliza una relación salinidad/densidad empírica desarrollada para un cuerpo de agua en particular para estimar la salinidad de las muestras a partir de una densidad medida.
| Salinidad del agua | |||
|---|---|---|---|
| Agua fresca | Agua potable | Agua salina | Brine |
| ▪ 0,05% | 0,05 – 3% | 3 – 5% | ■ 5% |
| 0,5 μ | 0,5 – 30 μ | 30 – 50 μ | , 50, |
Clasificación de las masas de agua en función de la salinidad
| Serie Thalassic |
| Ø 300 ¢ |
| hiperhalina |
| 60–80, |
| metahaline |
| 40 μ |
| mixoeuhaline |
| 30 999 |
| polihalina |
| 18 999 |
| mesohaline |
| 5 999 |
| oligohaline |
| 0,5 999 |
Las aguas marinas son las del océano, otro término para el cual es mares euhalinos. La salinidad de los mares euhalinos es de 30 a 35 ‰. Mares salobres o aguas que tengan una salinidad en el rango de 0,5 a 29 ‰ y mares metahalinos de 36 a 40 ‰. Todas estas aguas se consideran talásicas porque su salinidad se deriva del océano y se define como homoiohalina si la salinidad no varía mucho con el tiempo (esencialmente constante). La tabla de la derecha, modificada de Por (1972), sigue el "sistema de Venecia" (1959).
En contraste con los ambientes homoiohalinos, hay ciertos ambientes poiquilohalinos (que también pueden ser talásicos) en los que la variación de la salinidad es biológicamente significativa. La salinidad del agua poiquilohalina puede oscilar entre 0,5 y más de 300 ‰. La característica importante es que la salinidad de estas aguas tiende a variar en algún rango estacional biológicamente significativo o en alguna otra escala de tiempo más o menos comparable. En pocas palabras, estos son cuerpos de agua con salinidad bastante variable.
El agua altamente salina, de la que las sales cristalizan (o están a punto de cristalizar), se conoce como salmuera.
Consideraciones ambientales
La salinidad es un factor ecológico de considerable importancia, que influye en los tipos de organismos que viven en un cuerpo de agua. Además, la salinidad influye en los tipos de plantas que crecerán en un cuerpo de agua o en una tierra alimentada por agua (o por agua subterránea). Una planta adaptada a las condiciones salinas se llama halófita. Una halófita que es tolerante a la salinidad del carbonato de sodio residual se llama glasswort o saltwort o plantas de barilla. Los organismos (en su mayoría bacterias) que pueden vivir en condiciones muy saladas se clasifican como extremófilos o halófilos específicamente. Un organismo que puede soportar una amplia gama de salinidades es el eurihalino.
Las sales son costosas de eliminar del agua, y el contenido de sal es un factor importante en el uso del agua, teniendo en cuenta la potabilidad y la idoneidad para el riego. Se han observado aumentos en la salinidad en lagos y ríos en los Estados Unidos, debido a la sal común para carreteras y otros descongelantes de sal en la escorrentía.
El grado de salinidad de los océanos es un factor determinante de la circulación oceánica mundial, donde los cambios de densidad debidos tanto a los cambios de salinidad como a los cambios de temperatura en la superficie del océano producen cambios en la flotabilidad, lo que provoca el hundimiento y el ascenso. de masas de agua. Se cree que los cambios en la salinidad de los océanos contribuyen a los cambios globales en el dióxido de carbono, ya que las aguas más salinas son menos solubles en dióxido de carbono. Además, durante los períodos glaciales, la hidrografía es tal que una posible causa de la circulación reducida es la producción de océanos estratificados. En tales casos, es más difícil subducir agua a través de la circulación termohalina.
La salinidad no solo es un impulsor de la circulación oceánica, sino que los cambios en la circulación oceánica también afectan la salinidad, particularmente en el Atlántico norte subpolar, donde desde 1990 hasta 2010, el aumento de las contribuciones del agua de deshielo de Groenlandia se vio contrarrestado por un mayor transporte hacia el norte de las aguas saladas del Atlántico. Sin embargo, las aguas del Atlántico norte se han vuelto más frescas desde mediados de la década de 2010 debido al aumento del flujo de agua de deshielo de Groenlandia.
Contenido relacionado
Metal noble
BoPET
Gas pobre