Retina
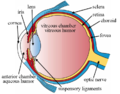
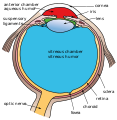
La retina (del latín: rete "net") es la capa más interna de tejido sensible a la luz del ojo de la mayoría de los vertebrados y algunos moluscos. La óptica del ojo crea una imagen bidimensional enfocada del mundo visual en la retina, que luego procesa esa imagen dentro de la retina y envía impulsos nerviosos a lo largo del nervio óptico a la corteza visual para crear la percepción visual. La retina cumple una función que es en muchos aspectos análoga a la de la película o el sensor de imagen de una cámara.
La retina neural consta de varias capas de neuronas interconectadas por sinapsis y está sostenida por una capa externa de células epiteliales pigmentadas. Las principales células sensibles a la luz en la retina son las células fotorreceptoras, que son de dos tipos: bastones y conos. Los bastones funcionan principalmente con poca luz y proporcionan una visión monocromática. Los conos funcionan en condiciones de buena iluminación y son responsables de la percepción del color mediante el uso de una gama de opsinas, así como de la visión de alta agudeza que se utiliza para tareas como la lectura. Un tercer tipo de célula sensible a la luz, la célula ganglionar fotosensible, es importante para la sincronización de los ritmos circadianos y las respuestas reflejas, como el reflejo pupilar a la luz.
La luz que incide en la retina inicia una cascada de eventos químicos y eléctricos que finalmente desencadenan impulsos nerviosos que se envían a varios centros visuales del cerebro a través de las fibras del nervio óptico. Las señales neuronales de los conos y bastones son procesadas por otras neuronas, cuya salida toma la forma de potenciales de acción en las células ganglionares de la retina cuyos axones forman el nervio óptico. Varias características importantes de la percepción visual se pueden rastrear hasta la codificación y el procesamiento de la luz en la retina.
En el desarrollo embrionario de vertebrados, la retina y el nervio óptico se originan como excrecencias del cerebro en desarrollo, específicamente el diencéfalo embrionario; por lo tanto, la retina se considera parte del sistema nervioso central (SNC) y en realidad es tejido cerebral. Es la única parte del SNC que se puede visualizar de forma no invasiva. Al igual que el resto del cerebro está aislado del sistema vascular a través de la barrera hematoencefálica, la retina está protegida de manera similar por la barrera hematorretiniana.
Estructura
Retina invertida versus no invertida
TarsisAunque el tejido neural suprayacente es parcialmente transparente y se ha demostrado que las células gliales que lo acompañan actúan como canales de fibra óptica para transportar fotones directamente a los fotorreceptores, se produce dispersión de luz. Algunos vertebrados, incluidos los humanos, tienen un área de la retina central adaptada para una visión de alta agudeza. Esta área, denominada fóvea central, es avascular (no tiene vasos sanguíneos) y tiene un tejido neural mínimo frente a los fotorreceptores, lo que minimiza la dispersión de la luz.
Los cefalópodos tienen una retina no invertida, cuyo poder de resolución es comparable al de los ojos de muchos vertebrados. Los ojos de calamar no tienen un análogo del epitelio pigmentario de la retina de vertebrados (EPR). Aunque sus fotorreceptores contienen una proteína, el retinocromo, que recicla la retina y replica una de las funciones del RPE de los vertebrados, es probable que los fotorreceptores de los cefalópodos no se mantengan tan bien como en los vertebrados y, como resultado, la vida útil de los fotorreceptores en los invertebrados es mucho mayor. más corta que en los vertebrados. Haber reemplazado fácilmente ojos de tallo (algunas langostas) o retinas (algunas arañas, como Deinopis ) rara vez ocurre.
La retina de los cefalópodos no se origina como una excrecencia del cerebro, como lo hace la retina de los vertebrados. Esta diferencia sugiere que los ojos de los vertebrados y los cefalópodos no son homólogos, sino que han evolucionado por separado. Desde una perspectiva evolutiva, una estructura más compleja, como la retina invertida, generalmente puede surgir como consecuencia de dos procesos alternativos: un "bien" compromiso entre limitaciones funcionales en competencia, o como una reliquia histórica desadaptativa del enrevesado camino de la evolución y transformación de órganos. La visión es una adaptación importante en los vertebrados superiores.
Una tercera vista de la "invertida" ojo de los vertebrados es que combina dos beneficios: el mantenimiento de los fotorreceptores mencionados anteriormente y la reducción de la intensidad de la luz necesaria para evitar el cegamiento de los fotorreceptores, que se basan en los ojos extremadamente sensibles de los ancestros de los mixinos modernos (peces que viven en ambientes muy aguas profundas y oscuras).
Capas de la retina

La retina de los vertebrados tiene 10 capas distintas. De más cercano a más lejano del cuerpo vítreo:
- Membrana límite interna – membrana basal elaborada por células Müller
- Capa de fibra Nerve – axones de los cuerpos de células ganglios (nota que existe una capa fina de las placas de pie de células Müller entre esta capa y la membrana de limitación interna)
- La capa celular de Ganglion contiene núcleos de células ganglios, cuyos ejes se convierten en fibras nerviosas ópticas, y algunas células amacrinas desplazadas
- La capa plexiforme interna - contiene la sinapsis entre los ejes de células bipolares y los dendritos del ganglio y las células amacrinas
- capa nuclear interna: contiene los núcleos y los cuerpos de células circundantes (perikarya) de las células amacrinas, las células bipolares y las células horizontales
- Capa plexiforme externa – proyecciones de varillas y conos que terminan en la esférica de varillas y pedilo de cono, respectivamente, hacen sinapsis con dendritos de células bipolares y células horizontales. En la región macular, esto es conocido como Capa de fibra de Henle.
- capa nuclear exterior – cuerpos celulares de varillas y conos
- Límite externo de la membrana – capa que separa las partes del segmento interior de los fotoreceptores de sus núcleos celulares
- Estrato interior / capa de segmento exterior – segmentos interiores y segmentos exteriores de varillas y conos, los segmentos exteriores contienen un aparato de sensor de luz altamente especializado.
- Epitelio de pigmento retiniano – una sola capa de células epiteliales cuboidales (con extrusiones no mostradas en el diagrama). Esta capa es más cercana al choroide, y proporciona funciones nutritivas y de apoyo a la retina neural, La melanina pigmentaria negra en la capa pigmentaria evita la reflexión ligera en todo el globo ocular; esto es extremadamente importante para una visión clara.
Estas capas se pueden agrupar en cuatro etapas principales de procesamiento: fotorrecepción; transmisión a células bipolares; transmisión a las células ganglionares, que también contienen fotorreceptores, las células ganglionares fotosensibles; y transmisión a lo largo del nervio óptico. En cada etapa sináptica, las células horizontales y amacrinas también están conectadas lateralmente.
El nervio óptico es un tracto central de muchos axones de células ganglionares que se conectan principalmente al cuerpo geniculado lateral, una estación de retransmisión visual en el diencéfalo (la parte posterior del cerebro anterior). También se proyecta hacia el colículo superior, el núcleo supraquiasmático y el núcleo del tracto óptico. Pasa a través de las otras capas, creando el disco óptico en los primates.
Estructuras adicionales, no asociadas directamente con la visión, se encuentran como excrecencias de la retina en algunos grupos de vertebrados. En las aves, el pecten es una estructura vascular de forma compleja que se proyecta desde la retina hacia el humor vítreo; suministra oxígeno y nutrientes al ojo y también puede ayudar en la visión. Los reptiles tienen una estructura similar, pero mucho más simple.
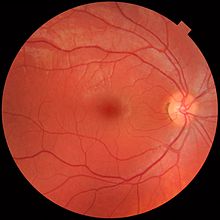
En los humanos adultos, la retina completa es aproximadamente el 72 % de una esfera de unos 22 mm de diámetro. Toda la retina contiene alrededor de 7 millones de conos y de 75 a 150 millones de bastones. El disco óptico, una parte de la retina a veces llamada "el punto ciego" debido a que carece de fotorreceptores, se ubica en la papila óptica, donde las fibras del nervio óptico salen del ojo. Aparece como un área blanca ovalada de 3 mm2. Temporalmente (en la dirección de las sienes) a este disco se encuentra la mácula, en cuyo centro se encuentra la fóvea, un hoyo que es responsable de la visión central aguda, pero que en realidad es menos sensible a la luz debido a que carece de bastones. Los primates humanos y no humanos poseen una fóvea, a diferencia de ciertas especies de aves, como los halcones, que son bifoviados, y los perros y gatos, que no poseen fóvea, sino una banda central conocida como racha visual. Alrededor de la fóvea se extiende la retina central unos 6 mm y luego la retina periférica. El borde más lejano de la retina está definido por la ora serrata. La distancia de una ora a otra (o mácula), la zona más sensible a lo largo del meridiano horizontal, es de unos 32 mm.
En sección, la retina no tiene más de 0,5 mm de grosor. Tiene tres capas de células nerviosas y dos de sinapsis, incluida la sinapsis de cinta única. El nervio óptico lleva los axones de las células ganglionares al cerebro y los vasos sanguíneos que irrigan la retina. Las células ganglionares se encuentran más internas en el ojo, mientras que las células fotorreceptoras se encuentran más allá. Debido a esta disposición contraria a la intuición, la luz primero debe pasar a través y alrededor de las células ganglionares ya través del grosor de la retina (incluidos sus vasos capilares, que no se muestran) antes de llegar a los bastones y conos. La luz es absorbida por el epitelio pigmentario de la retina o la coroides (ambos opacos).
Los glóbulos blancos en los capilares frente a los fotorreceptores se pueden percibir como pequeños puntos brillantes en movimiento cuando se observa la luz azul. Esto se conoce como el fenómeno entóptico del campo azul (o fenómeno de Scheerer).
Entre la capa de células ganglionares y los conos y bastones hay dos capas de neuropilos, donde se realizan los contactos sinápticos. Las capas de neuropilo son la capa plexiforme externa y la capa plexiforme interna. En la capa externa del neuropilo, los bastones y los conos se conectan a las células bipolares que corren verticalmente, y las células horizontales orientadas horizontalmente se conectan a las células ganglionares.
La retina central contiene predominantemente conos, mientras que la retina periférica contiene predominantemente bastones. En total, la retina tiene unos siete millones de conos y cien millones de bastones. En el centro de la mácula se encuentra la fosa foveal, donde los conos son estrechos y largos, y están dispuestos en un mosaico hexagonal, los más densos, a diferencia de los conos mucho más gruesos que se encuentran en la periferia de la retina. En la fosa foveal, las otras capas de la retina se desplazan, antes de acumularse a lo largo de la pendiente foveal hasta alcanzar el borde de la fóvea o parafovea, que es la porción más gruesa de la retina. La mácula tiene una pigmentación amarilla, debido a los pigmentos de detección, y se conoce como mácula lútea. El área que rodea directamente a la fóvea tiene la mayor densidad de bastones que convergen en células bipolares individuales. Dado que sus conos tienen una convergencia de señales mucho menor, la fóvea permite la visión más nítida que el ojo puede alcanzar.
Aunque los bastones y los conos son una especie de mosaico, la transmisión de los receptores, a los bipolares, a las células ganglionares no es directa. Dado que existen alrededor de 150 millones de receptores y sólo 1 millón de fibras nerviosas ópticas, debe producirse la convergencia y, por lo tanto, la mezcla de señales. Además, la acción horizontal de las células horizontales y amacrinas puede permitir que un área de la retina controle a otra (por ejemplo, un estímulo que inhibe a otro). Esta inhibición es clave para disminuir la suma de mensajes enviados a las regiones superiores del cerebro. En algunos vertebrados inferiores (por ejemplo, la paloma), el control de los mensajes es "centrífugo" – es decir, una capa puede controlar a otra, o las regiones superiores del cerebro pueden impulsar las células nerviosas de la retina, pero en los primates esto no ocurre.
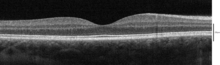
Capas imaginables con tomografía de coherencia óptica
Usando tomografía de coherencia óptica (OCT), se pueden identificar 18 capas en la retina. Las capas y la correlación anatómica son:
De la más interna a la más externa, las capas identificables por OCT son las siguientes:
| # | OCT Layer / Conventional Label | Correlato anatómico | Reflexividad
on OCT | Específico específico
anatómico límites? | Adicional
referencias |
|---|---|---|---|---|---|
| 1 | Posterior cortical vitreous | Posterior cortical vitreous | Hyper-reflective | Sí. | |
| 2 | Espacio anterior | En los ojos en los que el vitreo se ha separado total o parcialmente de la retina, este es el espacio creado entre la cara vitreosa cortical posterior y la membrana de limitación interna de la retina. | Hypo-reflective | ||
| 3 | Membrana de limitación interna (ILM) | Formado por Müller cell endfeet
(inclarable si se puede observar en OCT) | Hyper-reflective | No | |
| capa de fibra Nerve (NFL) | Axones de células Ganglion viajando hacia el nervio óptico | ||||
| 4 | Capa de células de Ganglion (GCL) | Cuerpos celulares de Ganglion (y algunas células amacrinas desplazadas) | Hypo-reflective | ||
| 5 | capa plexiforme interna (IPL) | Sinapsis entre células bipolares, amacrinas y ganglios | Hyper-reflective | ||
| 6 | capa nuclear interna (INL) | a) Cuerpos celulares horizontales, bipolares y amacrinas
b) núcleos de células Müller | Hypo-reflective | ||
| 7 | Capa plexiforme externa (OPL) | Sinapsis entre fotorreceptor, células bipolares y horizontales | Hyper-reflective | ||
| 8 | (La mitad interna) La capa de fibra nerviosa de Henle (HL) | Axones de fotoreceptor
(fibras orientadas oblicuamente; no presentes en la retina mediaperiférica o periférica) | Hypo-reflective | No | |
| (La mitad exterior) capa nuclear externa (ONL) | Los cuerpos de la célula fotorreceptora | ||||
| 9 | Límite externo (ELM) | Hecho de zonulae se adhiere entre células Müller y segmentos interiores de fotoreceptor | Hyper-reflective | ||
| 10 | Zona Myoid (MZ) | La parte más interna del segmento interior del fotoreceptor (IS) que contiene:
| Hypo-reflective | No | |
| 11 | Zona Ellipsoide (EZ) | La porción más externa del segmento interior del fotoreceptor (IS) empaquetado con mitocondria | Muy hiperreflexivo | No | |
| IS/OS junction or Photoreceptor integrity line (PIL) | El fotoreceptor que conecta cilia que puentea los segmentos interiores y externos de las células fotoreceptoras. | ||||
| 12 | Serie de sesiones externas de fotoreceptor (OS) | Los segmentos exteriores del fotorreceptor (OS) que contienen discos llenos de opsin, la molécula que absorbe fotones. | Hypo-reflective | ||
| 13 | Zona de interdigitación (IZ) | Apices of the RPE cells which encase part of the cone OSs.
Pobremente distinguible de RPE. Anteriormente: "cono línea de puntas de segmento exterior" (COST) | Hyper-reflective | No | |
| 14 | complejo de RPE/Bruch | Zona de fagolia RPE | Muy hiperreflexivo | No | |
| RPE zona melanosome | Hypo-reflective | ||||
| Zona de mitocondria RPE + unión entre la membrana de RPE & Bruch | Muy hiperreflexivo | ||||
| 15 | Choriocapillaris | La capa fina de la reflectividad moderada en el choroide interno | No | ||
| 16 | La capa de Sattler | Capa gruesa de perfiles hiperreflexivos redondos o en forma ovalada, con núcleos hiporeflexivos en la mitad de la ecografía | |||
| 17 | La capa de Haller | Capa gruesa de perfiles hiperreflexivos en forma de oval, con núcleos hiporeflejos en el corroide exterior | |||
| 18 | Coroidal-scleral juncture | Zona en el choroide exterior con un marcado cambio de textura, en la que grandes perfiles circulares o ovoides abut a
región homogénea de reflectividad variable | |||
Desarrollo
El desarrollo de la retina comienza con el establecimiento de los campos oculares mediados por las proteínas SHH y SIX3, con el desarrollo posterior de las vesículas ópticas reguladas por las proteínas PAX6 y LHX2. El papel de Pax6 en el desarrollo de los ojos fue demostrado con elegancia por Walter Gehring y sus colegas, quienes demostraron que la expresión ectópica de Pax6 puede conducir a la formación de ojos en las antenas, alas y patas de Drosophila. La vesícula óptica da lugar a tres estructuras: la retina neural, el epitelio pigmentado de la retina y el tallo óptico. La retina neural contiene las células progenitoras de la retina (RPC) que dan lugar a los siete tipos de células de la retina. La diferenciación comienza con las células ganglionares de la retina y concluye con la producción de la glía de Muller. Aunque cada tipo de célula se diferencia de las RPC en un orden secuencial, existe una superposición considerable en el momento en que se diferencian los tipos de células individuales. Las señales que determinan el destino de una célula hija RPC están codificadas por múltiples familias de factores de transcripción, incluidos los factores bHLH y homeodominio.
Además de guiar la determinación del destino celular, existen señales en la retina para determinar los ejes dorsal-ventral (D-V) y nasal-temporal (N-T). El eje D-V está establecido por un gradiente ventral a dorsal de VAX2, mientras que el eje N-T está coordinado por la expresión de los factores de transcripción de cabeza de horquilla FOXD1 y FOXG1. Se forman gradientes adicionales dentro de la retina. Esta distribución espacial puede ayudar en la orientación adecuada de los axones de RGC que funcionan para establecer el mapa retinotópico.
Suministro de sangre
La retina está estratificada en distintas capas, cada una de las cuales contiene tipos de células específicas o compartimentos celulares que tienen metabolismos con diferentes requisitos nutricionales. Para satisfacer estos requisitos, la arteria oftálmica se bifurca e irriga la retina a través de dos redes vasculares distintas: la red coroidea, que irriga la coroides y la retina externa, y la red retinal, que irriga la capa interna de la retina.
Mecanismos circulatorios
A primera vista, uno puede pensar que la retina de los vertebrados está "mal conectada" o "mal diseñado"; pero, de hecho, la retina no podría funcionar si no estuviera invertida. La capa de fotorreceptores debe estar incrustada en el epitelio pigmentario de la retina (RPE), que realiza al menos siete funciones vitales, una de las más obvias es suministrar oxígeno y otros nutrientes necesarios para que funcionen los fotorreceptores. Estos nutrientes incluyen glucosa, ácidos grasos y retinal. El proceso de amplificación de los fotorreceptores de los mamíferos utiliza grandes cantidades de energía para la visión en condiciones fotópicas (requiriendo menos en condiciones escotópicas) y, por lo tanto, requiere el gran suministro de nutrientes proporcionado por los vasos sanguíneos de la coroides, que se encuentra más allá del RPE. La coroides suministra alrededor del 75% de estos nutrientes a la retina y la vasculatura retiniana solo el 25%.
Cuando la luz incide en el 11-cis-retinal (en los discos de los bastones y los conos), el 11-cis-retinal cambia a todo-trans-retinal, lo que desencadena cambios en las opsinas. Ahora bien, los segmentos externos no regeneran el retinal de nuevo en la forma cis una vez que ha sido cambiado por la luz. En cambio, el retinal se bombea hacia el RPE circundante, donde se regenera y se transporta de regreso a los segmentos externos de los fotorreceptores. Esta función de reciclaje del RPE protege a los fotorreceptores contra el daño fotooxidativo y permite que las células fotorreceptoras tengan una vida útil de décadas.
En pájaros
La retina de las aves está desprovista de vasos sanguíneos, tal vez para permitir el paso de la luz sin obstrucciones para formar imágenes, lo que brinda una mejor resolución. Por lo tanto, es una opinión considerada que la retina de las aves depende para la nutrición y el suministro de oxígeno de un órgano especializado, llamado "pecten" o pecten oculi, ubicado en el punto ciego o disco óptico. Este órgano es extremadamente rico en vasos sanguíneos y se cree que suministra nutrición y oxígeno a la retina de las aves por difusión a través del cuerpo vítreo. El pecten es muy rico en actividad de fosfatasa alcalina y células polarizadas en su porción de puente, ambas acordes con su función secretora. Las células de pecten están repletas de gránulos de melanina oscura, que se ha teorizado para mantener este órgano caliente con la absorción de la luz dispersa que cae sobre el pecten. Se considera que esto mejora la tasa metabólica del pecten, exportando así más moléculas nutritivas para cumplir con los estrictos requisitos de energía de la retina durante largos períodos de exposición a la luz.
Identificación biométrica y diagnóstico de enfermedades
Se sabe que las bifurcaciones y otras características físicas de la red vascular de la retina interna varían entre los individuos, y estas variaciones individuales se han utilizado para la identificación biométrica y para la detección temprana de la aparición de enfermedades. El mapeo de bifurcaciones vasculares es uno de los pasos básicos en la identificación biométrica. Los resultados de tales análisis de la estructura de los vasos sanguíneos de la retina se pueden evaluar frente a los datos reales de las bifurcaciones vasculares de las imágenes del fondo de la retina que se obtienen del conjunto de datos DRIVE. Además, también se identificaron las clases de embarcaciones del conjunto de datos DRIVE y también está disponible un método automatizado para la extracción precisa de estas bifurcaciones. Los cambios en la circulación sanguínea de la retina se observan con el envejecimiento y la exposición a la contaminación del aire, y pueden indicar enfermedades cardiovasculares como la hipertensión y la aterosclerosis. La determinación del ancho equivalente de arteriolas y vénulas cerca del disco óptico también es una técnica muy utilizada para identificar riesgos cardiovasculares.
Función
La retina traduce una imagen óptica en impulsos neurales a partir de la excitación modelada de los pigmentos sensibles al color de sus conos y bastones, las células fotorreceptoras de la retina. La excitación es procesada por el sistema neural y varias partes del cerebro trabajando en paralelo para formar una representación del ambiente externo en el cerebro.
Los conos responden a la luz brillante y median la visión del color de alta resolución durante la iluminación diurna (también llamada visión fotópica). Las respuestas de los bastones están saturadas en los niveles de luz diurna y no contribuyen a la visión del patrón. Sin embargo, los bastones responden a la luz tenue y median una visión monocromática de baja resolución bajo niveles muy bajos de iluminación (llamada visión escotópica). La iluminación en la mayoría de los entornos de oficina se encuentra entre estos dos niveles y se denomina visión mesópica. En niveles de luz mesópicos, tanto los bastones como los conos contribuyen activamente con la información del patrón. No está claro qué contribución hace la información de la barra a la visión del patrón en estas circunstancias.
La respuesta de los conos a varias longitudes de onda de luz se denomina sensibilidad espectral. En la visión humana normal, la sensibilidad espectral de un cono cae en uno de los tres subtipos, a menudo llamados azul, verde y rojo, pero más exactamente conocidos como subtipos de cono sensibles a longitudes de onda corta, media y larga. Es la falta de uno o más de los subtipos de conos lo que hace que las personas tengan deficiencias en la visión del color o varios tipos de daltonismo. Estos individuos no son ciegos a los objetos de un color particular, pero son incapaces de distinguir entre los colores que pueden distinguir las personas con visión normal. Los humanos tienen esta visión tricromática, mientras que la mayoría de los otros mamíferos carecen de conos con pigmento sensible al rojo y, por lo tanto, tienen una visión de color dicromática más pobre. Sin embargo, algunos animales tienen cuatro subtipos espectrales, p. la trucha agrega un subgrupo ultravioleta a los subtipos cortos, medianos y largos que son similares a los humanos. Algunos peces también son sensibles a la polarización de la luz.
En los fotorreceptores, la exposición a la luz hiperpolariza la membrana en una serie de cambios graduales. El segmento celular externo contiene un fotopigmento. Dentro de la célula, los niveles normales de monofosfato de guanosina cíclico (cGMP) mantienen abierto el canal de Na+ y, por lo tanto, en el estado de reposo, la célula se despolariza. El fotón hace que el retinal unido a la proteína receptora se isomerice a trans-retinal. Esto hace que el receptor active múltiples proteínas G. Esto, a su vez, hace que la subunidad Ga de la proteína active una fosfodiesterasa (PDE6), que degrada el cGMP, lo que provoca el cierre de los canales iónicos activados por nucleótidos cíclicos (CNG) de Na+. Por lo tanto, la célula está hiperpolarizada. La cantidad de neurotransmisor liberado se reduce con luz brillante y aumenta a medida que bajan los niveles de luz. El fotopigmento real se decolora con la luz brillante y solo se reemplaza como un proceso químico, por lo que en una transición de la luz brillante a la oscuridad, el ojo puede tardar hasta treinta minutos en alcanzar la sensibilidad total.
Cuando así es excitado por la luz, el fotoceptor envía una respuesta proporcional sinápticamente a las células bipolares que a su vez envían señales a las células ganglionares de la retina. Los fotorreceptores también están entrecruzados por células horizontales y células amacrinas, que modifican la señal sináptica antes de que llegue a las células ganglionares, entremezclándose y combinándose las señales neurales. De las células nerviosas de la retina, solo las células ganglionares de la retina y unas pocas células amacrinas crean potenciales de acción.
En las células ganglionares de la retina existen dos tipos de respuesta, dependiendo del campo receptivo de la célula. Los campos receptivos de las células ganglionares de la retina comprenden un área central, aproximadamente circular, donde la luz tiene un efecto sobre la activación de la célula, y un entorno anular, donde la luz tiene el efecto opuesto. En las células ON, un incremento en la intensidad de la luz en el centro del campo receptivo hace que aumente la tasa de disparo. En celdas OFF hace que disminuya. En un modelo lineal, este perfil de respuesta está bien descrito por una diferencia de gaussianas y es la base de los algoritmos de detección de bordes. Más allá de esta simple diferencia, las células ganglionares también se diferencian por la sensibilidad cromática y el tipo de suma espacial. Las células que muestran una suma espacial lineal se denominan células X (también llamadas parvocelulares, P o células ganglionares enanas), y las que muestran una suma no lineal son células Y (también llamadas magnocelulares, M o células ganglionares de la retina en parasol), aunque la correspondencia entre Las células X e Y (en la retina del gato) y las células P y M (en la retina de los primates) no son tan simples como parecía.
En la transferencia de señales visuales al cerebro, la vía visual, la retina se divide verticalmente en dos, una mitad temporal (más cerca de la sien) y una mitad nasal (más cerca de la nariz). Los axones de la mitad nasal cruzan el cerebro en el quiasma óptico para unirse con los axones de la mitad temporal del otro ojo antes de pasar al cuerpo geniculado lateral.
Aunque hay más de 130 millones de receptores en la retina, solo hay aproximadamente 1,2 millones de fibras (axones) en el nervio óptico. Por lo tanto, se realiza una gran cantidad de preprocesamiento dentro de la retina. La fóvea produce la información más precisa. A pesar de ocupar alrededor del 0,01 % del campo visual (menos de 2° del ángulo visual), alrededor del 10 % de los axones del nervio óptico están dedicados a la fóvea. Se ha determinado que el límite de resolución de la fóvea es de unos 10.000 puntos. La capacidad de información se estima en 500.000 bits por segundo (para más información sobre bits ver teoría de la información) sin color o alrededor de 600.000 bits por segundo con color.
Codificación espacial
Cuando la retina envía impulsos neurales que representan una imagen al cerebro, codifica espacialmente (comprime) esos impulsos para adaptarse a la capacidad limitada del nervio óptico. La compresión es necesaria porque hay 100 veces más células fotorreceptoras que células ganglionares. Esto se hace mediante la "decorrelación", que es llevada a cabo por las "estructuras centro-circundantes", que son implementadas por las células bipolares y ganglionares.
Hay dos tipos de estructuras centro-entorno en la retina: en el centro y fuera del centro. Los centros on tienen un centro ponderado positivamente y un entorno ponderado negativamente. Los descentrados son todo lo contrario. La ponderación positiva se conoce más comúnmente como excitatoria y la negativa como inhibitoria.
Estas estructuras centrales y circundantes no son aparentes físicamente, en el sentido de que uno no puede verlas tiñendo muestras de tejido y examinando la anatomía de la retina. Las estructuras centro-entorno son lógicas (es decir, matemáticamente abstractas) en el sentido de que dependen de las fuerzas de conexión entre las células bipolares y ganglionares. Se cree que la fuerza de conexión entre las células es causada por la cantidad y los tipos de canales iónicos incrustados en las sinapsis entre las células bipolares y ganglionares.
Las estructuras centro-entorno son matemáticamente equivalentes a los algoritmos de detección de bordes que utilizan los programadores informáticos para extraer o mejorar los bordes de una fotografía digital. Por lo tanto, la retina realiza operaciones sobre los impulsos que representan la imagen para mejorar los bordes de los objetos dentro de su campo visual. Por ejemplo, en una imagen de un perro, un gato y un automóvil, son los bordes de estos objetos los que contienen la mayor cantidad de información. Para que las funciones superiores en el cerebro (o en una computadora para el caso) extraigan y clasifiquen objetos como un perro y un gato, la retina es el primer paso para separar los diversos objetos dentro de la escena.
Como ejemplo, la siguiente matriz es el núcleo de un algoritmo informático que implementa la detección de bordes. Esta matriz es el equivalente informático a la estructura centro-circunferencia. En este ejemplo, cada caja (elemento) dentro de esta matriz estaría conectada a un fotorreceptor. El fotorreceptor en el centro es el receptor actual que se está procesando. El fotorreceptor central se multiplica por el factor de peso +1. Los fotorreceptores circundantes son los "vecinos más cercanos" al centro y se multiplican por el valor −1/8. Finalmente se calcula la suma de los nueve de estos elementos. Esta suma se repite para cada fotorreceptor de la imagen desplazándose hacia la izquierda hasta el final de una fila y luego hacia abajo hasta la siguiente línea.
| -1/8 | -1/8 | -1/8 |
| -1/8 | + 1 | -1/8 |
| -1/8 | -1/8 | -1/8 |
La suma total de esta matriz es cero, si todas las entradas de los nueve fotorreceptores tienen el mismo valor. El resultado cero indica que la imagen era uniforme (sin cambios) dentro de este pequeño parche. Las sumas negativas o positivas significan que la imagen estaba variando (cambiando) dentro de este pequeño parche de nueve fotorreceptores.
La matriz anterior es solo una aproximación a lo que realmente sucede dentro de la retina. Las diferencias son:
- El ejemplo anterior se llama "balanced". El término equilibrado significa que la suma de los pesos negativos es igual a la suma de los pesos positivos para que cancelen perfectamente. Las células de ganglio retina casi nunca están perfectamente equilibradas.
- La mesa es cuadrada, mientras que las estructuras centrales-redondeadas en la retina son circulares.
- Las neuronas operan en trenes de espiga que viajan por ejes de células nerviosas. Las computadoras operan en un solo número de punto flotante que es esencialmente constante de cada pixel de entrada. (El píxel de la computadora es básicamente el equivalente de un fotoreceptor biológico.)
- La retina realiza todos estos cálculos en paralelo mientras el ordenador opera en cada pixel uno a la vez. La retina no realiza repetidas sumas y cambios como un ordenador.
- Finalmente, las células horizontales y amacrinas juegan un papel significativo en este proceso, pero eso no está representado aquí.
Este es un ejemplo de una imagen de entrada y cómo la modificaría la detección de bordes.
Una vez que las estructuras centro-circundantes codifican espacialmente la imagen, la señal se envía a lo largo del nervio óptico (a través de los axones de las células ganglionares) a través del quiasma óptico hasta el LGN (núcleo geniculado lateral). La función exacta del LGN se desconoce en este momento. Luego, la salida del LGN se envía a la parte posterior del cerebro. Específicamente, la salida del LGN "irradia" hacia la corteza visual primaria V1.
Flujo de señal simplificado: Fotorreceptores → Bipolar → Ganglión → Quiasma → LGN → Corteza V1
Importancia clínica
Hay muchas enfermedades o trastornos hereditarios y adquiridos que pueden afectar la retina. Algunos de ellos incluyen:
- La retinitis pigmentosa es un grupo de enfermedades genéticas que afectan a la retina y causan la pérdida de visión nocturna y visión periférica.
- Degeneración macular describe un grupo de enfermedades caracterizadas por la pérdida de la visión central debido a la muerte o el deterioro de las células en la macula.
- La distrofia de Cone-rod (CORD) describe una serie de enfermedades donde la pérdida de la visión es causada por el deterioro de los conos y/o varas en la retina.
- En la separación retina, la retina se separa de la parte posterior del globo ocular. Ignipuncture es un método de tratamiento anticuado. El término desapego retina se utiliza para describir una separación de la retina neurosensory del epitelio pigmento retina. Hay varios métodos de tratamiento modernos para fijar un desprendimiento retinal: retinopexia neumática, hebilla escleral, crioterapia, fotocoagulación láser y pars plano vitrectomy.
- Tanto la hipertensión como la diabetes mellitus pueden causar daño a los pequeños vasos sanguíneos que suministran la retina, lo que conduce a la retinopatía hipertensiva y la retinopatía diabética.
- El retinoblastoma es un cáncer de la retina.
- Las enfermedades retinales en perros incluyen displasia retina, atrofia retina progresiva y degeneración retina repentina adquirida.
- Lipaemia retinalis es una apariencia blanca de la retina, y puede ocurrir por deposición lipídica en deficiencia de lipoproteína lipasa.
- Retinal Detachment. La retina neural se separa ocasionalmente del epitelio pigmentario. En algunos casos, la causa de tal desprendimiento es lesión al globo ocular que permite que el líquido o la sangre se recoja entre la retina neural y el epitelio pigmentario. El desapego es ocasionalmente causado por la contractura de finos fibriles colágenos en el humor vítreo, que tiran áreas de la retina hacia el interior del globo.
- Ceguera nocturna: La ceguera nocturna ocurre en cualquier persona con deficiencia severa de vitamina A. La razón de esto es que sin vitamina A, las cantidades de retina y rodopsia que se pueden formar son severamente deprimidas. Esta condición se llama ceguera nocturna porque la cantidad de luz disponible por la noche es demasiado pequeña para permitir una visión adecuada en personas con deficiencia de vitamina A.
Además, la retina se ha descrito como una "ventana" en el cerebro y el cuerpo, ya que las anomalías detectadas a través de un examen de la retina pueden descubrir enfermedades tanto neurológicas como sistémicas.
Diagnóstico
Se dispone de varios instrumentos diferentes para el diagnóstico de enfermedades y trastornos que afectan a la retina. La oftalmoscopia y la fotografía del fondo de ojo se han utilizado durante mucho tiempo para examinar la retina. Recientemente, la óptica adaptativa se ha utilizado para obtener imágenes de conos y bastones individuales en la retina humana viva, y una empresa con sede en Escocia ha diseñado una tecnología que permite a los médicos observar la retina completa sin molestias para los pacientes.
El electrorretinograma se utiliza para medir de forma no invasiva la actividad eléctrica de la retina, que se ve afectada por determinadas enfermedades. Una tecnología relativamente nueva, que ahora está ampliamente disponible, es la tomografía de coherencia óptica (OCT). Esta técnica no invasiva permite obtener un tomograma 3D volumétrico o transversal de alta resolución de las estructuras finas de la retina, con calidad histológica. El análisis de los vasos de la retina es un método no invasivo para examinar las pequeñas arterias y venas de la retina que permite sacar conclusiones sobre la morfología y la función de los pequeños vasos en otras partes del cuerpo humano. Se ha establecido como predictor de enfermedad cardiovascular y parece tener, según un estudio publicado en 2019, potencial en la detección precoz de la enfermedad de Alzheimer.
Tratamiento
El tratamiento depende de la naturaleza de la enfermedad o trastorno.
Modalidades de tratamiento comunes
Las siguientes son modalidades comunes de tratamiento para la enfermedad de la retina:
- Medicamento intravitreal, como anti-VEGF o agentes corticosteroides
- Cirugía vitreoretinal
- Uso de suplementos nutricionales
- Modificación de los factores de riesgo sistémico para la enfermedad retina
Modalidades de tratamiento poco comunes
Métodos raros o poco comunes de tratamiento para la enfermedad retina |
|---|
Terapia genética retina La terapia genética tiene la promesa como una posible vía para curar una amplia gama de enfermedades retinales. Esto implica utilizar un virus no infeccioso para transportar un gen a una parte de la retina. Los vectores del virus asociado adeno (rAAV) recombinantes poseen una serie de características que los hacen ideales para la terapia genética retina, incluyendo la falta de patogenicidad, inmunogenicidad mínima, y la capacidad de transducir células postmitoticas de manera estable y eficiente. Los vectores rAAV se utilizan cada vez más para su capacidad de mediar una transducción eficiente del epitelio de pigmento retina (RPE), células fotorreceptoras y células ganglionar retina. Cada tipo de célula se puede apuntar específicamente eligiendo la combinación adecuada de serotipo AAV, promotor y sitio de inyección intraocular. Varios ensayos clínicos ya han reportado resultados positivos utilizando RAAV para tratar la amaurosis congénita de Leber, mostrando que la terapia era segura y eficaz. No hubo eventos adversos graves, y los pacientes en los tres estudios mostraron mejoría en su función visual medida por varios métodos. Los métodos utilizados variaron entre los tres ensayos, pero incluían métodos funcionales como la agudeza visual y la movilidad funcional, así como medidas objetivas menos susceptibles a los prejuicios, como la capacidad del alumno para responder a la luz y mejoras en la resonancia funcional. Las mejoras se mantuvieron a largo plazo, y los pacientes siguen haciéndolo bien después de más de 1,5 años. La arquitectura única de la retina y su entorno relativamente privilegiado inmunitario ayudan a este proceso. Las uniones tensas que forman la barrera retina de la sangre separan el espacio subretinal del suministro de sangre, protegiéndolo de microbios y daños más inmunizados, y mejorando su potencial para responder a terapias mediadas por vectores. La anatomía altamente compartimentada del ojo facilita la entrega exacta de suspensiones vectoriales terapéuticas a tejidos específicos bajo visualización directa utilizando técnicas microquirúrgicas. En el entorno protegido de la retina, los vectores AAV pueden mantener altos niveles de expresión transgénica en el epitelio pigmentado retina (RPE), fotoreceptores o células ganglionas durante largos períodos de tiempo después de un tratamiento único. Además, el ojo y el sistema visual pueden ser monitoreados rutinariamente y fácilmente para cambios estructurales de función visual y retina después de inyecciones con tecnología avanzada no invasiva, como acuidades visuales, sensibilidad de contraste, fondo de autofluorescencia (FAF), umbrales visuales de color oscuro, diámetros vasculares, pupillometría, electroretinografía (ERG), ERG multifocal y tomografía de coherencia óptica. Esta estrategia es eficaz contra una serie de enfermedades retinales que se han estudiado, incluyendo enfermedades neovasculares que son características de degeneración macular relacionada con la edad, retinopatía diabética y retinopatía de prematuridad. Dado que la regulación de la vascularización en la retina madura implica un equilibrio entre factores de crecimiento positivo endógenos, como el factor de crecimiento endotelial vascular (VEGF) e inhibidores de la angiogénesis, como el factor epitelio pigmentado (PEDF), la expresión mediada por rAAV de PEDF, la angiostatina y los modelos solubles de receptores VEGFlt-1, que se muestran todas las proteínas Dado que las terapias genéticas específicas no pueden utilizarse fácilmente para tratar una fracción significativa de pacientes con distrofia retina, hay un interés importante en desarrollar una terapia de factor de supervivencia más generalmente aplicable. Los factores neurotróficos tienen la capacidad de modular el crecimiento neuronal durante el desarrollo para mantener las células existentes y permitir la recuperación de las poblaciones neuronales lesionadas en el ojo. Factores neurotróficos AAV como factor de crecimiento fibroblasto (FGF) familiares y GDNF o fotorreceptores protegidos de la apoptosis o desacelera la muerte celular. Trasplante de órganosSe ha intentado trasplantar retinas, pero sin mucho éxito. En MIT, la Universidad del Sur de California, RWTH Aachen University, y la Universidad de Nueva Gales del Sur, se está desarrollando una "retina artificial": un implante que pasará por alto los fotoreceptores de la retina y estimulará directamente las células nerviosas adjuntas, con señales de una cámara digital. |
Historia
Alrededor del año 300 a. C., Herófilo identificó la retina a partir de disecciones de ojos de cadáveres. La llamó capa aracnoidea, por su parecido con una telaraña, y retiforme, por su parecido con una red de pesca. El término aracnoides pasó a referirse a una capa alrededor del cerebro; el término retiforme pasó a referirse a la retina.
Entre 1011 y 1021 d. C., Ibn Al-Haytham publicó numerosos experimentos que demostraban que la vista se produce a partir de la luz que se refleja de los objetos en el ojo. Esto es consistente con la teoría de la intromisión y contra la teoría de la emisión, la teoría de que la vista se produce a partir de los rayos emitidos por los ojos. Sin embargo, Ibn Al-Haytham decidió que la retina no podía ser la responsable de los inicios de la visión porque la imagen que se formaba sobre ella estaba invertida. En cambio, decidió que debía comenzar en la superficie de la lente.
En 1604, Johannes Kepler desarrolló la óptica del ojo y decidió que la retina debe estar donde comienza la vista. Dejó que otros científicos reconciliaran la imagen retiniana invertida con nuestra percepción del mundo en posición vertical.
En 1894, Santiago Ramón y Cajal publicó la primera gran caracterización de las neuronas retinianas en Retina der Wirbelthiere (La retina de los vertebrados).
George Wald, Haldan Keffer Hartline y Ragnar Granit ganaron el Premio Nobel de Fisiología o Medicina en 1967 por su investigación científica sobre la retina.
Un estudio reciente de la Universidad de Pensilvania calculó que el ancho de banda aproximado de las retinas humanas es de 8,75 megabits por segundo, mientras que la tasa de transferencia retiniana de un conejillo de indias es de 875 kilobits por segundo.
MacLaren & Pearson y sus colegas del University College London y el Moorfields Eye Hospital de Londres, en 2006, demostraron que las células fotorreceptoras podían trasplantarse con éxito en la retina del ratón si las células del donante se encontraban en una etapa crítica de desarrollo. Recientemente, Ader y sus colegas en Dublín demostraron, utilizando el microscopio electrónico, que los fotorreceptores trasplantados formaban conexiones sinápticas.
En 2012, Sebastian Seung y su laboratorio en el MIT lanzaron EyeWire, un juego de ciencia ciudadana en línea en el que los jugadores trazan neuronas en la retina. Los objetivos del proyecto EyeWire son identificar tipos de células específicas dentro de las amplias clases conocidas de células de la retina y mapear las conexiones entre las neuronas en la retina, lo que ayudará a determinar cómo funciona la visión.
Imágenes adicionales
Contenido relacionado
Hipócrates
Drosófila
Antioxidante