Reordenamiento de hofmann
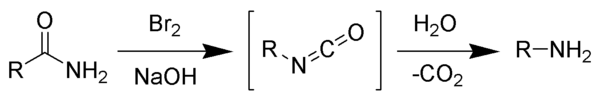
El reordenamiento de Hofmann (degradación de Hofmann) es la reacción orgánica de una amida primaria a una amina primaria con un átomo de carbono menos. La reacción implica la oxidación del nitrógeno seguida de la transposición del carbonilo y el nitrógeno para dar un intermedio de isocianato. La reacción puede formar una amplia gama de productos, incluidas alquil y aril aminas.
La reacción lleva el nombre de su descubridor, August Wilhelm von Hofmann, y no debe confundirse con la eliminación de Hofmann, otro nombre de reacción del que tiene el mismo nombre.
Mecanismo
La reacción del bromo con el hidróxido de sodio forma hipobromito de sodio in situ, que transforma la amida primaria en un isocianato intermedio. La formación de un nitreno intermedio no es posible porque implica también la formación de un ácido hidroxámico como subproducto, lo que nunca se ha observado. El isocianato intermedio se hidroliza a una amina primaria, desprendiendo dióxido de carbono.
- La base abstrae un protón ácido N-H, produciendo un anión.
- El anión reacciona con bromo en una reacción α-sustitución para dar un N-bromoamida.
- La abstracción de base del protón de amida restante da una anión de bromoamida.
- El anión bromoamida reorganiza como el grupo R unido a los migratos de carbono de carbono al nitrógeno al mismo tiempo que el ión bromuro deja, dando un isocianato.
- El isocianato añade agua en un paso de adición nucleófilo para producir un ácido carbamico (también uretano).
- El ácido carbamico pierde espontáneamente CO2, produciendo el producto de la amina.
Variaciones
Se pueden sustituir el bromo por varios reactivos. El hipoclorito de sodio, el tetraacetato de plomo, la N-bromosuccinimida y el (bis(trifluoroacetoxi)yodo)benceno pueden afectar el reordenamiento de Hofmann.
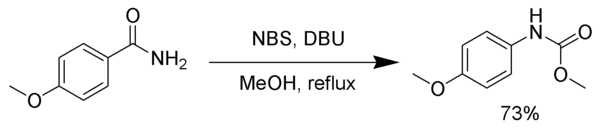
El isocianato intermedio puede quedar atrapado con varios nucleófilos para formar carbamatos estables u otros productos en lugar de sufrir descarboxilación. En el siguiente ejemplo, el isocianato intermedio queda atrapado en metanol.
De manera similar, el isocianato intermedio puede quedar atrapado por el alcohol terc-butílico, produciendo la amina protegida con terc-butoxicarbonilo (Boc).
El reordenamiento de Hofmann también se puede utilizar para producir carbamatos de α,β-insaturadas o α-hidroxiamidas o nitrilos de α,β-amidas acetilénicas con buenos rendimientos (≈70%).
Aplicaciones
- En la preparación del ácido antranilico de la ftallimida
- Nicotinamida se convierte en 3-Aminopyridine
- La estructura simétrica de α-fenil propanamida no cambia después de la reacción de Hofmann.
- En la síntesis de la gabapentina, comenzando con la mono-amidación de ácido diacético 1,1-ciclohexano anhídrido con amoníaco a 1,1-ciclohexano mono-amida de ácido diacético, seguido de una reorganización Hofmann
Contenido relacionado
Ley de Fick
Miscibilidad
Masa molar
