Reacción de Simmons-Smith
La reacción de Simmons-Smith es una reacción queletrópica orgánica que involucra un carbenoide organozinc que reacciona con un alqueno (o alquino) para formar un ciclopropano. Lleva el nombre de Howard Ensign Simmons, Jr. y Ronald D. Smith. Utiliza un intermediario de radical libre de metileno que se entrega a ambos carbonos del alqueno simultáneamente, por lo tanto, la configuración del doble enlace se conserva en el producto y la reacción es estereoespecífica.

Mecanismo
Ejemplos
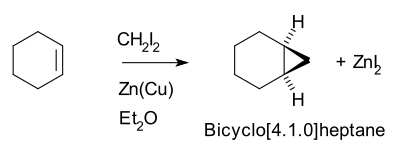
Así, el ciclohexeno, el diyodometano y un par zinc-cobre (como yoduro de yodometilzinc, ICH2ZnI) producen norcarano (biciclo[4.1.0]heptano).
La reacción de Simmons-Smith generalmente se prefiere a otros métodos de ciclopropanación; sin embargo, puede resultar costosa debido al alto costo del diyodometano. Se han desarrollado modificaciones que implican alternativas más económicas, como el dibromometano o diazometano y el yoduro de zinc. La reactividad del sistema también se puede aumentar utilizando la modificación Furukawa, intercambiando el par zinc-cobre por dietilzinc.
La reacción de Simmons-Smith generalmente está sujeta a efectos estéricos y, por lo tanto, la ciclopropanación generalmente tiene lugar en la cara menos obstaculizada. Sin embargo, cuando un sustituyente hidroxi está presente en el sustrato cerca del doble enlace, el zinc se coordina con el sustituyente hidroxi, dirigiendo la ciclopropanación cis al grupo hidroxilo (que puede no corresponder a la ciclopropanación del grupo estéricamente). cara más accesible del doble enlace): se puede ver un modelo 3D interactivo de esta reacción en ChemTube3D.
Reacción asimétrica de Simmons-Smith
Aunque los métodos de ciclopropanación asimétricos basados en compuestos diazo (las ciclopropanaciones catalizadas por metales) existen desde 1966, la reacción asimétrica de Simmons-Smith se introdujo en 1992 con una reacción de alcohol cinamílico con dietilzinc, diyodometano y una disulfonamida quiral en diclorometano:
El grupo hidroxilo es un requisito previo que sirve como anclaje para el zinc. Aquí se puede ver un modelo 3D interactivo de una reacción similar (se requiere Java). En otra versión de esta reacción el ligando se basa en salen y se añade ácido de Lewis DIBAL:
Alcance y limitaciones
Alquenos aquirales
La reacción de Simmons-Smith se puede utilizar para ciclopropanar alquenos simples sin complicaciones. Los alquenos aquirales no funcionalizados se ciclopropanan mejor con la modificación de Furukawa (ver más abajo), usando Et2Zn y CH2I2 en 1,2-dicloroetano. La ciclopropanación de alquenos activados por grupos donadores de electrones se produce rápida y fácilmente. Por ejemplo, a menudo se utilizan éteres enólicos como olefinas sustituidas con trimetilsililoxi debido a los altos rendimientos obtenidos.

A pesar de la naturaleza aceptora de electrones de los haluros, muchos haluros de vinilo también se ciclopropanan fácilmente, produciendo ciclopropanos sustituidos con fluoro, bromo y yodo.

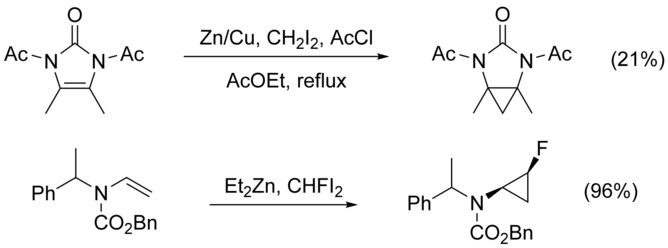
La ciclopropanación de alquenos N sustituidos se complica por la N-alquilación como vía competitiva. Esto se puede evitar agregando un grupo protector al nitrógeno; sin embargo, la adición de grupos aceptores de electrones disminuye la nucleofilicidad del alqueno, lo que reduce el rendimiento. Se ha demostrado que el uso de reactivos altamente electrófilos como CHFI2, en lugar de CH2I2, aumenta el rendimiento en estos casos.
Polienos
Sin la presencia de un grupo director en la olefina, se observa muy poca quimioselectividad. Sin embargo, se preferirá un alqueno que sea significativamente más nucleofílico que cualquier otro. Por ejemplo, la ciclopropanación se produce de forma muy selectiva en los éteres enólicos.
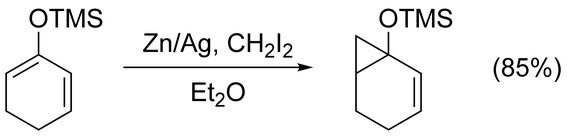
Compatibilidad de grupos funcionales
Un aspecto importante de la reacción de Simmons-Smith que contribuye a su amplio uso es su capacidad para usarse en presencia de muchos grupos funcionales. Entre otros, la reacción mediada por haloalquilzinc es compatible con alquinos, alcoholes, éteres, aldehídos, cetonas, ácidos carboxílicos y derivados, carbonatos, sulfonas, sulfonatos, silanos y estannanos. Sin embargo, se observan comúnmente algunas reacciones secundarias.
La mayoría de las reacciones secundarias ocurren debido a la acidez de Lewis del subproducto, ZnI2. En reacciones que producen productos sensibles a los ácidos, se puede agregar un exceso de Et2Zn para eliminar el ZnI2 que se forma, formando el EtZnI menos ácido. La reacción también se puede apagar con piridina, que eliminará el ZnI2 y el exceso de reactivos.
La metilación de heteroátomos también se observa en la reacción de Simmons-Smith debido a la electrofilia de los carbenoides de zinc. Por ejemplo, el uso de un exceso de reactivo durante tiempos de reacción prolongados casi siempre conduce a la metilación de los alcoholes. Además, Et2Zn y CH2I2 reaccionan con tioéteres alílicos para generar iluros de azufre, que posteriormente pueden sufrir un reordenamiento 2,3-sigmatrópico y no ciclopropanarán un alqueno en la misma molécula a menos que se utilice un exceso de reactivo de Simmons-Smith.

Modificaciones
Si bien la reacción de Simmons-Smith a menudo se analiza en su forma básica, se han propuesto varias modificaciones tanto del catalizador de zinc como del carbono agregado.
Modificación Furukawa
La modificación Furukawa implica la sustitución del par zinc-cobre por dialquil zinc, el más activo de los cuales resultó ser Et2Zn. La modificación se propuso en 1968 como una forma de convertir olefinas catiónicamente polimerizables, como los éteres vinílicos, en sus respectivos ciclopropanos. También se ha descubierto que es especialmente útil para la ciclopropanación de carbohidratos, siendo mucho más reproducible que otros métodos. Al igual que la reacción no modificada, la reacción modificada de Furukawa es estereoespecífica y, a menudo, es mucho más rápida que la reacción no modificada. Sin embargo, el reactivo Et2Zn es pirofórico y, como tal, debe manipularse con cuidado.
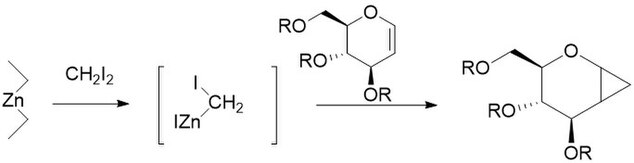
Modificación de la chareta
La modificación Charette reemplaza el CH2I2 que normalmente se encuentra en la reacción de Simmons-Smith con compuestos arildiazo, como el fenildiazometano, en la Ruta A. Tras el tratamiento con estequiométrico cantidades de haluro de zinc, se produce un compuesto organozinc similar al carbenoide discutido anteriormente. Puede reaccionar con casi todos los alquenos y alquinos, incluidos los estirenos y los alcoholes. Esto es especialmente útil, ya que se sabe que el Simmons-Smith no modificado desprotona los alcoholes. Desafortunadamente, como se muestra en la Ruta B, el intermedio también puede reaccionar con el compuesto diazo de partida, dando cis- o trans- 1,2-difenileteno. Además, el intermedio puede reaccionar con alcoholes para producir yodofenilmetano, que puede sufrir además una reacción SN2 para producir ROCHPh, como en la vía C.
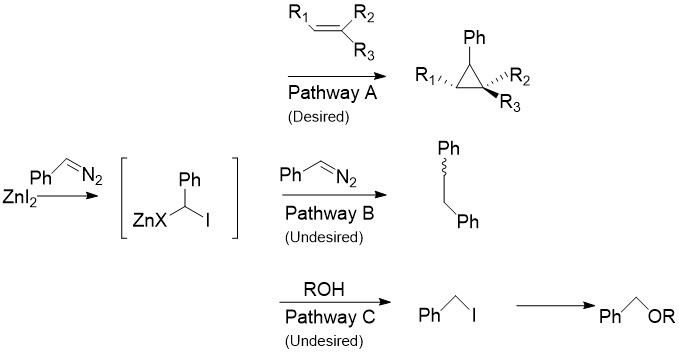
Reactivos distintos del zinc
Aunque no se utilizan comúnmente, los reactivos de Simmons-Smith que muestran propiedades reactivas similares a las del zinc se han preparado a partir de compuestos de aluminio y samario en presencia de CH2IX. Con el uso de estos reactivos, se pueden ciclopropanar selectivamente alcoholes alílicos y olefinas aisladas en presencia de otros. El yoduro de yodo o clorometilsamario en THF es un excelente reactivo para ciclopropanar selectivamente el alcohol alílico, presumiblemente dirigido por quelación al grupo hidroxilo. Por el contrario, el uso de reactivos de dialquil(yodometil)aluminio en CH2Cl2 ciclopropanará selectivamente la olefina aislada. La especificidad de estos reactivos permite que los ciclopropanos se coloquen en sistemas poliinsaturados que los reactivos a base de zinc ciclopropanarán total y no selectivamente. Por ejemplo, i-Bu3Al ciclopropanará el geraniol en la posición 6, mientras que Sm/Hg ciclopropanará en la posición 2, como se muestra a continuación.

Sin embargo, ambas reacciones requieren cantidades casi estequiométricas del compuesto metálico de partida, y Sm/Hg debe activarse con el altamente tóxico HgCl2.
Usos en síntesis
La mayoría de las aplicaciones modernas de la reacción de Simmons-Smith utilizan la modificación de Furukawa. A continuación se enumeran aplicaciones especialmente relevantes y confiables.
Inserción para formar γ-cetoésteres
Un intermediario de ciclopropano generado por Furukawa-modified Simmons-Smith se forma en la síntesis de esteres γ-keto de β-keto. El reactivo Simmons-Smith se une primero al grupo de carbono y posteriormente al α-carbono del pseudo-enol que la primera reacción forma. Este segundo reactivo forma el ciclopropilo intermedio que se fragmenta rápidamente en el producto.

Formación de amido-espiro [2.2]pentanos a partir de alenamidas
Una reacción de Simmons-Smith modificada por Furukawa ciclopropana ambos dobles enlaces en una alenamida para formar amido-espiro [2.2] ciclopentanos, con dos anillos de ciclopropilo que comparten un carbono. También se forma el producto de la monociclopropanación.

Síntesis de productos naturales
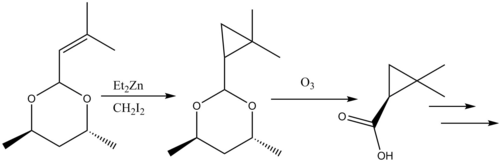
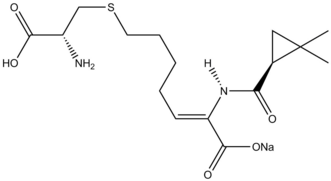
Se han revisado las reacciones de ciclopropanación en la síntesis de productos naturales. El inhibidor de β-lactamasa Cilastatina proporciona un ejemplo instructivo de la reactividad de Simmons-Smith en la síntesis de productos naturales. Un sustituyente alilo en el material de partida se ciclopropana con Simmons-Smith y posteriormente el ácido carboxílico se desprotege mediante ozonólisis para formar el precursor.
Síntesis de fármacos
La reacción de Simmons-Smith se utiliza en la síntesis de GSK1360707F y ropanicant.
Contenido relacionado
Ley de Fick
Masa molar
Miscibilidad