Reacción de Passerini
La reacción de Passerini es una reacción química en la que intervienen un isocianuro, un aldehído (o cetona) y un ácido carboxílico para formar una α-aciloxiamida. Esta reacción de adición es una de las reacciones multicomponente basadas en isocianuro más antiguas y fue descrita por primera vez en 1921 por Mario Passerini en Florencia, Italia. Normalmente se lleva a cabo en disolventes apróticos, pero también se puede realizar en líquidos iónicos como agua o disolventes eutécticos profundos. Es una reacción de tercer orden; primer orden en cada uno de los reactivos. La reacción de Passerini se utiliza a menudo en química combinatoria y medicinal, con utilidad reciente en química verde y química de polímeros. Como los isocianuros exhiben una alta tolerancia a los grupos funcionales, quimioselectividad, regioselectividad y estereoselectividad, la reacción de Passerini tiene una amplia gama de aplicaciones sintéticas.
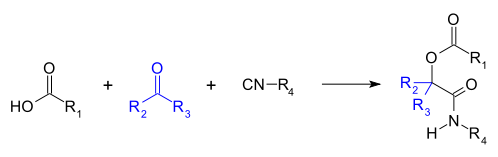
Mecanismo
Se ha planteado la hipótesis de que la reacción de Passerini se produce a través de dos vías mecanicistas. Las vías de reacción dependen del disolvente utilizado.
Mecanismo concertado
Se teoriza que se produce un mecanismo concertado, observado en las reacciones SN2 y Diels-Alder, cuando los reactivos de Passerini están presentes en altas concentraciones en disolventes apróticos.

Este mecanismo implica una reacción trimolecular entre el isocianuro, el ácido carboxílico y el carbonilo en una secuencia de adiciones nucleofílicas. La reacción transcurre primero a través de un intermediario imidato y luego sufre un reordenamiento de Mumm para producir el producto de Passerini.
Como el reordenamiento de Mumm requiere una segunda molécula de ácido carboxílico, este mecanismo clasifica la reacción de Passerini como una reacción organocatalítica.
Mecanismo iónico
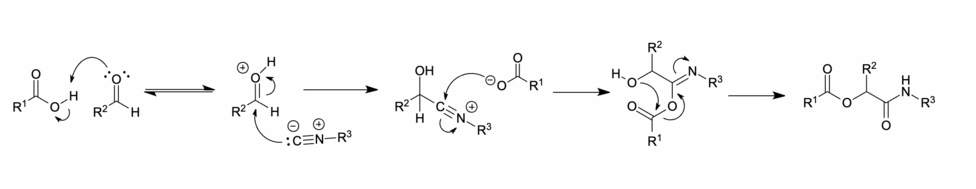
En disolventes polares, como metanol o agua, el carbonilo se protona antes de la adición nucleofílica del isocianuro, lo que produce un ion nitrilio intermedio. A esto le sigue la adición de un carboxilato, transferencia de grupo acilo y transferencia de protones, respectivamente, para dar el producto Passerini deseado.
Control de reacción
Los pesos moleculares de los polímeros sintetizados mediante Passerini se pueden controlar mediante medios estequiométricos. Por ejemplo, la longitud y el peso de la cadena del polímero se pueden ajustar mediante la estequiometría de isocianuro, y la geometría del polímero se puede influir mediante reactivos de partida. Para facilitar la reacción de Passerini entre reactivos voluminosos estéricamente impedidos, se puede utilizar un dispositivo fluídico de vórtice para inducir condiciones de alto cizallamiento. Estas condiciones emulan los efectos de la alta temperatura y presión, lo que permite que la reacción de Passerini se desarrolle con bastante rapidez. La reacción de Passerini también puede exhibir enantioselectividad. La adición de isocianuro de terc-butilo a una amplia variedad de aldehídos (aromáticos, heteroaromáticos, olefínicos, acetilénicos, alifáticos) se logra utilizando un sistema catalítico de tetracloruro y una bifosforamida quiral que proporciona un buen rendimiento y buenas enantioselectividades. Para otros tipos de isocianuros, la velocidad de adición del isocianuro a la mezcla de reacción dicta buenos rendimientos y altas selectividades.
Aplicaciones
Además de formar productos de α-aciloxi amida, la reacción de Passerini se puede utilizar para formar heterociclos, polímeros, aminoácidos y productos medicinales.
Heterociclos

La reacción de Passerini original produce depsipéptidos acíclicos que son lábiles en condiciones fisiológicas. Para aumentar la estabilidad del producto para uso medicinal, se han utilizado reacciones de ciclación post-Passerini para producir heterociclos como β-lactámicos, butenólidos e isocumarinas. Para permitir estas ciclaciones, los reactivos se funcionalizan previamente con grupos reactivos (por ejemplo, halógenos, azidas, etc.) y se usan junto con otras reacciones (por ejemplo, Passerini-Knoevenagel, Passerini-Dieckmann) para producir productos heterocíclicos. A través de esta reacción se han producido compuestos como derivados de oxirano y aziridina de tres miembros, b-lactamas de cuatro miembros y 4,5-dihidropirazoles tetrasustituidos de cinco miembros.
Polímeros

Esta reacción también se ha utilizado para la polimerización, la formación de monómeros y la modificación posterior a la polimerización. La reacción de Passerini también se ha utilizado para formar polímeros de secuencia definida. Se pueden usar sustratos bifuncionales para sufrir modificaciones posteriores a la polimerización o servir como precursores para la polimerización. Como esta reacción tiene una alta tolerancia a los grupos funcionales, los polímeros creados mediante esta reacción son muy diversos y tienen propiedades ajustables. Las macromoléculas que se han producido con esta reacción incluyen macroamidas, depsipéptidos macrocíclicos, dendrímeros de tres componentes y moléculas centrales mesógenas ramificadas en estrella de tres brazos.
Aminoácidos y productos farmacéuticos
La reacción de Passerini se ha empleado para la formación de estructuras como α-aminoácidos, α-hidroxi-β-aminoácidos, α-cetoamidas, β-cetoamidas, α-hidroxicetonas y α-aminoxiamidas. La reacción de Passerini ha sintetizado α-aciloxicarboxamidas que han demostrado actividad como medicamentos contra el cáncer junto con los fullerenos [C60] funcionalizados utilizados en química medicinal y vegetal. Esta reacción también se ha utilizado como paso sintético en la síntesis total de productos farmacéuticos disponibles comercialmente como telaprevir (VX-950), un antiviral vendido por Vertex Pharmaceuticals y Johnson & Johnson.

Contenido relacionado
Ley de Fick
Miscibilidad
Masa molar