Reacción de henry
La reacción de Henry es una reacción clásica de formación de enlaces carbono-carbono en química orgánica. Descubierto en 1895 por el químico belga Louis Henry (1834-1913), es la combinación de un nitroalcano y un aldehído o cetona en presencia de una base para formar β-nitroalcoholes. Este tipo de reacción también se conoce como reacción de nitroaldol (nitroalcano, aldehído y alcohol). Es casi análoga a la reacción aldólica que se descubrió 23 años antes y que acopla dos compuestos carbonílicos para formar compuestos β-hidroxicarbonílicos conocidos como "aldollos". (aldehído y alcohol). La reacción de Henry es una técnica útil en el área de la química orgánica debido a la utilidad sintética de sus productos correspondientes, ya que pueden convertirse fácilmente en otros intermedios sintéticos útiles. Estas conversiones incluyen la deshidratación posterior para producir nitroalquenos, la oxidación del alcohol secundario para producir α-nitrocetonas o la reducción del grupo nitro para producir β-aminoalcoholes.

Muchos de estos usos se han ejemplificado en la síntesis de diversos productos farmacéuticos, incluido el betabloqueante (S)-propranolol, el inhibidor de la proteasa del VIH Amprenavir (Vertex 478) y la construcción de la subunidad de carbohidratos de la clase de antibióticos antraciclina. L-Acosamina. El esquema sintético de la síntesis de L-acosamina se puede encontrar en la sección de Ejemplos de este artículo.
Mecanismo
La reacción de Henry comienza con la desprotonación del nitroalcano en la posición del carbono α formando un nitronato. El pKa de la mayoría de los nitroalcanos es aproximadamente 17. Aunque esta estructura es nucleofílica tanto en el carbono desprotonado como en los oxianiones del grupo nitro, el resultado observado es que el carbono ataca al compuesto carbonílico. El β-nitroalcóxido resultante es protonado por el ácido conjugado de la base que originalmente desprotonó la estructura nitroalquilo, dando el respectivo β-nitroalcohol como producto.

Es importante señalar que todos los pasos de la reacción de Henry son reversibles. Esto se debe a la falta de un paso comprometido en la reacción para formar el producto. Es por esta razón que la investigación se ha orientado hacia modificaciones que impulsen la reacción hasta su finalización. Puede encontrar más información sobre esto en la sección de modificación de este artículo.
Curso Estereoquímico
La siguiente figura ilustra uno de los modelos comúnmente aceptados para la estereoselección sin ninguna modificación de la reacción de Henry. En este modelo, la estereoselectividad se rige por el tamaño de los grupos R en el modelo (como una cadena de carbono), así como por un estado de transición que minimiza el dipolo orientando el grupo nitro y el oxígeno carbonilo entre sí (en lados opuestos). de la molécula). Los grupos R desempeñan un papel en el estado de transición de la reacción de Henry: cuanto más grandes sean los grupos R en cada uno de los sustratos, más tenderán a alejarse unos de otros (comúnmente denominados efectos estéricos).
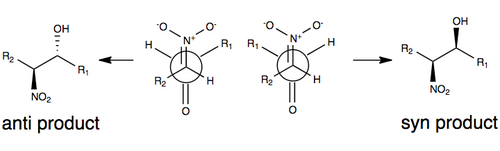
Debido a la reversibilidad de la reacción y la tendencia a una fácil epimerización del átomo de carbono nitrosustituido (entre varios factores), la reacción de Henry normalmente producirá una mezcla de enantiómeros o diastereómeros. Es por esta razón que las explicaciones para la estereoselectividad siguen siendo escasas sin alguna modificación de la reacción. En los últimos años, el foco de la investigación se ha desplazado hacia modificaciones de la reacción de Henry para superar este desafío sintético.
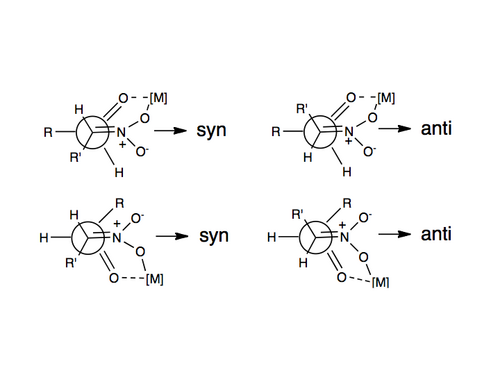
El primer ejemplo de una reacción enantioselectiva con nitroaldol se informó en 1992 utilizando catalizadores de Shibasaki. Uno de los métodos más frecuentemente empleados para inducir enantio o diastereoselectividad en la reacción de Henry es el uso de catalizadores metálicos quirales, en los que el grupo nitro y el oxígeno carbonilo se coordinan para formar un metal que está unido a una molécula orgánica quiral. Algunos metales que se han utilizado incluyen zinc, cobalto, cobre, magnesio y cromo. Arriba se ilustra una descripción de esta coordinación.
Características generales
Una de las muchas características de la reacción de Henry que la hace sintéticamente atractiva es que utiliza sólo una cantidad catalítica de base para impulsar la reacción. Además, se puede usar una variedad de bases que incluyen bases iónicas tales como hidróxidos, alcóxidos, carbonatos y fuentes de anión fluoruro (por ejemplo, TBAF) de metales alcalinos o bases de aminas orgánicas no iónicas que incluyen TMG, DBU, DBN y PAP. Es importante señalar que la base y el disolvente utilizados no tienen una gran influencia en el resultado general de la reacción.
Limitaciones
Uno de los principales inconvenientes de la reacción de Henry es la posibilidad de que se produzcan reacciones secundarias. Aparte de la reversibilidad inherente de la reacción (o "retro-Henry") que puede impedir que la reacción avance, el β-nitroalcohol también tiene el potencial de sufrir deshidratación. En el caso de sustratos estéricamente impedidos, también es posible que se produzca una autocondensación catalizada por bases (reacción de Cannizzaro). A continuación se muestra un esquema general de la reacción de Cannizzaro.

Modificaciones
Se han realizado una serie de modificaciones a la reacción de Henry. De estos, algunos de los más importantes incluyen el empleo de condiciones de alta presión y, a veces, sin disolventes para mejorar la quimio y regioselectividad y catalizadores metálicos quirales para inducir enantio o diastereoselectividad. La reacción aza-Henry también se utiliza para producir nitroaminas y puede ser una ruta sintética confiable para la síntesis de diaminas vecinas.
Quizás una de las modificaciones sintéticamente más útiles de la reacción de Henry es el uso de un organocatalizador. El ciclo catalítico se muestra a continuación.

Benjamin List describió que si bien esta es una explicación amplia, su breve reseña ilustra que se trata de una explicación mecanicista plausible para casi todas las reacciones que involucran un organocatalizador. Un ejemplo de este tipo de reacción se ilustra en la sección Ejemplos de este artículo.
Además de las modificaciones mencionadas anteriormente a la reacción de Henry, hay una variedad de otras. Esto incluye la conversión de compuestos de alquilnitro no reactivos a sus dianiones correspondientes que reaccionarán más rápido con sustratos de carbonilo, las reacciones se pueden acelerar usando PAP como base, la utilización de la reactividad de aldehídos con nitroalcanos α,α-doblemente desprotonados para dar alcóxidos de nitronato que producen principalmente alcoholes sin-nitro una vez protonados, y finalmente generación de aniones nitronato en los que un átomo de oxígeno en el grupo nitro está protegido con sililo para producir alcoholes anti-β-nitro en presencia de una fuente de anión fluoruro cuando reacciona con un aldehído.
Ejemplos
- Aplicación industrial
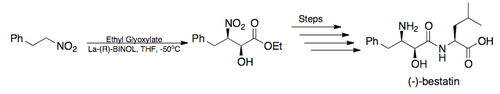
- En 1999, Menzel y compañeros de trabajo desarrollaron una ruta sintética para obtener L-acosamina, la subunidad de carbohidratos de la clase antraciclina de antibióticos:
- Aplicación industrial
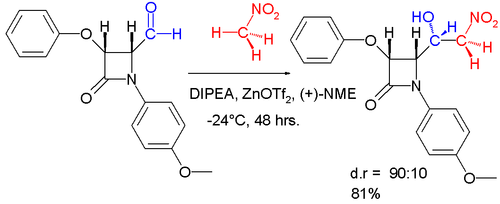
- Un producto de adición de aldol enantioselectiva se puede obtener en síntesis asimétrica por reacción de benzaldehído con nitrometano y el sistema de catalizadores que consiste en triflate de zinc como ácido Lewis, diisopropyletilamina (DIPEA), y N-metileefedrina (NME) como y como ligand quiral. A continuación se muestra una variación diastereoselectiva de esta reacción.
- Síntesis total
- En 2005, Barua y compañeros de trabajo completaron la síntesis total del potente inhibidor de la aminopeptidasa (–)-bestatina, en un rendimiento global del 26% del rendimiento total empleando la reacción asimétrica de Henry de Shibasaki como el paso clave. ( ilustrado infra)
- Organocatalysis
- En 2006, Hiemstra y colaboradores exploraron el uso de derivados quininos como catalizadores asimétricos para la reacción entre aldehídos aromáticos y nitrometano. Mediante el uso de derivados particulares, pudieron inducir la enantioselección directa mediante el uso del catalizador adecuado.
- Biocatalysis
- En 2006, Purkarthofer et al. encontraron que (S)-hidroxinitrile lyase from Hevea brasiliensis cataliza la formación de (Salcoholes beta-nitro. En 2011, Fuhshuku y Asano mostraron que elRlyase hidroxinitrilo selectivo de Arabidopsis thaliana podría catalizar la síntesis de (R)-Beta-nitro alcoholes de nitrometano y aldehídos aromáticos.
Contenido relacionado
Ley de Fick
Miscibilidad
Masa molar